制备犬胸主动脉脱细胞血管支架的新方法
2014-09-15李炜赁可周艳荣陈柏成陈林安琪
李炜 赁可 周艳荣 陈柏成 陈林 安琪
基础研究
制备犬胸主动脉脱细胞血管支架的新方法
李炜 赁可 周艳荣 陈柏成 陈林 安琪
作者单位:400037 重庆市,第三军医大学附属新桥医院心血管外科(李炜、陈柏成、陈林);
四川大学附属华西医院心血管外科(赁可、安琪);
第三军医大学附属西南医院儿科(周艳荣)
目的 研究制备犬胸主动脉脱细胞血管支架的新方法,制备出理想的犬胸主动脉脱细胞基质,从而为构建组织工程血管提供支架材料。方法 在无菌条件下从成年比格犬体内取出胸主动脉血管段(28根),随机分成4组:A组血管段设为正常对照组;B组血管段置于-70℃的冰箱和4℃冰箱内反复冻融2次;C组血管段在0.1%的SDS溶液中持续震荡1 d;D组血管段经历反复冻融后置于1%Triton X-100的PBS溶液和1 μmol/L PMSF的混合液中常温下震荡2 d,于0.01%的SDS溶液中持续震荡1 d,最后加入核酸酶Dnase 0.2 mg/L和Rnase 0.02 mg/L消化24 h。四组血管段经历不同的过程后,全部从大体形态、光镜、电子显微镜观察、力学性能测试、免疫组化等角度进行检测并做统计学分析。结果 0.1%SDS法虽能完全脱除细胞,但制备的脱细胞基质弹力纤维排列紊乱,部分发生断裂,且不能保持良好的形状和张力强度,管腔有不同程度的塌陷;反复冻融+1%Triton X-100+PMSF+0.01%SDS法不仅能完全脱除细胞,保持基质纤维的正常排列结构,而且制备的脱细胞基质能保持良好的形状和力学性能,管腔无塌陷。结论 联合应用反复冻融、Triton X-100、PMSF和SDS的方法能够将犬胸主动脉的细胞成分除去,是一种制备脱细胞血管支架的有效方法。
组织工程; 脱细胞支架; 犬; 胸主动脉
心血管疾病是一类常见的疾病,它的发病率已经出现逐年上升的趋势。其中复杂先天性心脏病一直以来都是心脏外科治疗的重点和难点,其发病率相对固定,病死率较高。先天性心脏病外科中的许多手术诸如ROSS手术、Restelli手术、B-T分流手术、永存动脉干矫治术等都需用各种带瓣或不带瓣的血管作为移植材料。为满足心脏外科疾病尤其是冠心病和先心病修补材料的需要,血管移植物的来源就成为人们关注的问题。
目前文献报道的可以充当血管修复材料的有高分子人工管道、深低温保存的同种带瓣大动脉、异种血管等。但均因组织相容性较差、易造成管腔阻塞、物理性能差、远期效果不理想、超急排异反应等缺点无法广泛使用。组织工程血管的研究为解决先天性心脏病或冠心病外科血管移植材料的来源开辟了一条新的思路。采用异种血管,经物理或化学方法去除其血管壁内的细胞成分,获得的脱细胞组织基质不再具有抗原性物质,但仍保存了血管原有的基本形态和结构。在此基础上,将体外培养和扩增受体的血管平滑肌细胞和内皮细胞先后种植于脱细胞组织基质,可望制备成功能用于临床完整的组织工程血管,其效果远优于其他血管材料的效果,理论上类似于自身组织的移植。
本实验的目的是在验证0.1%SDS法制备犬胸主动脉脱细胞基质可行性的同时,进一步探索出制备犬胸主动脉脱细胞基质的新方法,制备比较理想的犬胸主动脉脱细胞基质,为构建组织工程化血管提供支架材料,也为以后构造出完整的组织工程血管打下基础。
1 材料与方法
1.1 材料 Triton X-100分析纯(美国Sigma公司),蛋白酶抑制剂PMSF(广州威佳有限公司),胰蛋白酶和乙二胺四乙酸(EDTA)分析纯(Gibico公司),0.5%新洁而灭(成都生化试剂厂),PBS(自配),DNA核酸酶(成都奥克生物试剂公司),RNA核酸酶(成都奥克生物试剂公司),十二烷基磺酸钠(sodium dodecyl sulfate,SDS)分析纯(上海润捷化工有限公司)。
1.2 动物实验
1.2.1 血管采取 成年比格犬28只,体重10~15 kg,雌雄均可。将其固定于手术床上,进行气管插管、全身麻醉。胸骨旁切口入路,切断肋软骨,撑开器撑开显露胸主动脉,急性处死后,在无菌条件下取其胸主动脉,立即置入含肝素的生理盐水中,冲洗排尽内腔积血,轻柔剥离其外层的疏松结缔组织,将获取的胸主动脉(犬处死后10 min内取出)迅速放入无菌EP管中备用。
1.2.2 实验血管分组 将获得的血管段(28根)随机分为以下4组:A组(7根)正常对照组;B组(7根)反复冻融处理组;C组(7根)单纯使用0.1%SDS组;D组(7根)反复冻融+Triton X-100+PMSF+0.01%SDS组。
1.2.3 实验过程 A组(7根):正常血管段不加任何处理,置于4℃冰箱中。B组(7根):将血管段放入1.5 ml冻存管,并向管中加入含10%二甲亚砜(DMSO)的M199培养液,把冻存管以封口胶密封,立即放入-70℃的冰箱中24 h,再放入4℃冰箱中24 h,如此反复冻融2次共4 d,最后将血管段置于4℃冰箱中。C组(7根):用无菌生理盐水灌冲血管内腔数次,以去掉残留在血管壁上的残血,将血管段用0.5%新洁而灭PBS溶液浸泡30 min消毒灭菌后用无菌PBS溶液充分震荡冲洗3次,每次30 min,随后加入0.1%的SDS溶液中持续震荡1 d,无菌PBS震荡冲洗3次,每次30 min,得到的血管段置于4℃冰箱中。D组(7根):将血管段放入1.5 ml冻存管中,并向管中加入含10%二甲亚砜(DMSO)的M199培养液,把冻存管以封口胶密封,立即放入-70℃的冰箱中24 h,再放入4℃冰箱中24 h,如此反复冻融2次共4 d。血管段自冰箱中取出后用无菌生理盐水灌冲血管内腔数次,以此去掉残留在血管壁上的内皮细胞及残血,用0.5%新洁而灭PBS溶液浸泡30 min,后用无菌PBS溶液充分震荡冲洗3次,每次30 min。然后加入1%Triton X-100的PBS溶液和1 μmol/L的PMSF的混合液中常温下震荡 2 d,该混合液中含有青霉素钠(100 μg/ml)、链霉素(100 U/ml)、制菌霉素(100 U/ml),再以无菌PBS震荡冲洗3次,每次30 min。加入0.01%的SDS溶液中持续震荡1 d,无菌PBS震荡冲洗3次,每次30 min。最后加入核酸酶Dnase 0.2 mg/L和Rnase 0.02 mg/L消化24 h,无菌PBS震荡冲洗3次,每次30 min。得到的血管段放入70%的乙醇中于4℃冰箱中保存。
1.3 检查指标
1.3.1 大体观察 观察血管段经历不同处理过程后的外观情况,包括颜色、弹性、韧性、管腔有无塌陷、内膜是否光滑、表面是否变黏等。
1.3.2 苏木精-伊红染色 组织标本 10%甲醛固定,常规石蜡包埋切片,HE(苏木素-伊红)染色,镜下观察细胞及血管结构,尤其观察脱细胞处理前后血管壁内的细胞脱除情况,以及纤维成分的排列情况[1]。
1.3.3 弹力纤维染色 组织标本10%甲醛固定,常规石蜡包埋切片,行弹力纤维染色。弹力纤维被染成棕红色,胶原纤维被染成粉红色,观察血管内弹力纤维排列情况,看弹力膜是断裂还是保存完好。
1.3.4 扫描电子显微镜检查 2.5%的戊二醛固定12 h,30%、50%、70%、90%、100%的乙醇逐级脱水,再用醋酸戊二酯固定置换;CO2临界干燥点干燥,种植片表面喷金后,在SEM下观察,重点看血管壁中的内皮细胞和平滑肌细胞的脱除情况以及弹力膜是遭到破坏还是保存完好。由四川大学华西医学院电镜室对脱细胞支架进行扫描电子显微镜检查。
1.3.5 力学性能测试 测试四组标本的载荷、应力、应变、位移等力学指标,并进行比较。
1.3.6 免疫组化反应 常规石蜡切片,脱蜡至水。室温下以0.3%H2O2浸泡30 min,PBS洗3次,每次5 min,再以0.3%Triton X-100 37℃浸泡30 min,PBS洗3次,每次5 min。加正常羊血清,置切片于湿盒内 37 ℃孵育 30 min,加(1∶100)鼠抗人 MHCⅠ抗体(阴性对照组不加一抗,加PBS),湿盒内4℃孵育72 h。PBS洗3次,每次5 min,加生物素标记的马抗鼠抗体(1∶100),湿盒内37℃孵育1 h。PBS洗3次,每次5 min,加ABC复合物湿盒内37℃孵育1 h。PBS洗3次,每次5 min,DAB显色5 min,蒸馏水终止显色,用明矾苏木精复染。脱水透明,中性树胶封片。从免疫组化阳性反应多少来评价细胞脱除情况。
2 结果
2.1 形态学观察
2.1.1 大体观察 正常犬胸主动脉剥去外膜充分冲洗后,管壁呈淡红色,弹性良好,管腔无塌陷,内膜光滑,经反复冻融后表面变黏,余同正常血管。经脱细胞处理后,血管管壁呈暗黄色,管壁较脱细胞前变薄,管腔略塌陷,内膜光滑,SDS组弹性不佳,反复冻融+Triton X-100+SDS组弹性良好(图 1)。
2.1.2 组织学观察
2.1.2.1 HE(苏木素-伊红)染色 如图2所示,正常对照组血管和反复冻融组血管的切片中能看到深蓝色的细胞核,纤维组织染成红色,排列整齐。0.1%SDS组血管切片中已见不到深蓝色的细胞核,但组织结构显得疏松。反复冻融+1%Triton X-100+PMSF+0.01%SDS组的切片中未见深蓝色的细胞核及核物质,纤维组织排列整齐,未见组织疏松或破坏。
2.1.2.2 弹力纤维染色 如图3所示,可见正常对照组、反复冻融组及反复冻融+1%Triton X-100+PMSF+0.01%SDS组血管的弹力膜(棕红色)完好,弹力纤维之间空隙较大,排列规整,未见紊乱及断裂。0.1%SDS组血管的弹力纤维排列紊乱,部分发生断裂。
2.1.2.3 扫描电镜检查 经历反复冻融的血管壁内细胞发生固缩破坏,弹力膜完好。单纯使用0.1%SDS组的血管细胞已经脱除,但是弹力膜发生断裂。反复冻融+1%Triton X-100+PMSF+0.01%SDS组的血管壁内已经见不到内皮细胞和平滑肌细胞,弹力膜完好,且表面凹凸不平,有较多空隙(图4)。
2.2 力学性能测试 将四组血管(各7条)用于力学性能的测试。将血管沿圆周向剪成5 mm×20 mm的长条状,用INSTRON8874生物力学测试系统(Instron Co.,USA)行单轴拉伸试验。实验条件:常温常压下100N传感器,加载速度为20 mm/min,荷载下降50%时停止加载,测定各种力学指标,并进行对比分析,结果见表1及图5。
表1 各组血管力学指标(±s)
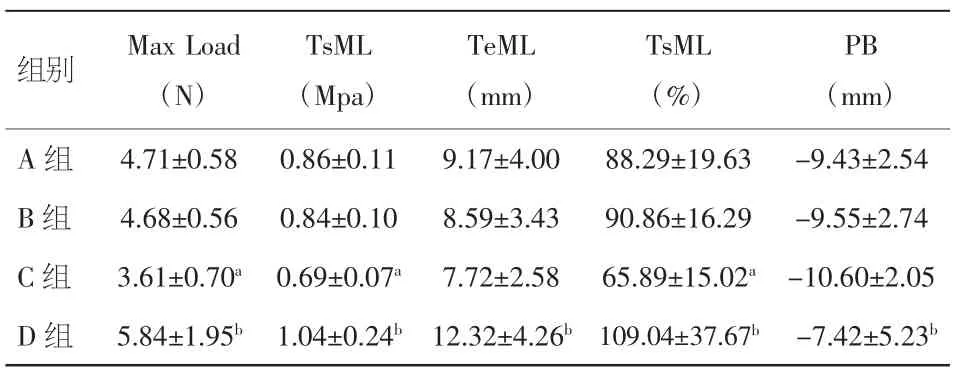
表1 各组血管力学指标(±s)
注:与 A、B 组比较,aP<0.05;与 C 组比较,bP<0.05
组别 Max Load(N)PB(mm)A 组 4.71±0.58 0.86±0.11 9.17±4.00 88.29±19.63 -9.43±2.54 B 组 4.68±0.56 0.84±0.10 8.59±3.43 90.86±16.29 -9.55±2.74 C 组 3.61±0.70a0.69±0.07a7.72±2.58 65.89±15.02a-10.60±2.05 D 组 5.84±1.95b1.04±0.24b12.32±4.26b109.04±37.67b-7.42±5.23bTsML(Mpa)TeML(mm)TsML(%)
2.3 MHCⅠ免疫组化检测
2.3.1 定性分析 A组和B组中的血管内皮细胞及平滑肌细胞高度表达MHCⅠ,阳性反应为红色丝状物质,呈细胞形态分布,见于血管壁的内膜和中膜。C组和D组中的血管经历不同的脱细胞处理过程后,内膜层已无内皮细胞,未见免疫组化阳性反应;中膜层亦无平滑肌细胞,仅见很少量免疫组化阳性反应,呈小碎片散在分布,不呈细胞形态,阳性染色面积较A、B两组明显减少。免疫组化染色结果如图6所示。
2.3.2 定量分析 由图像分析可见,正常对照组及反复冻融组血管壁MHCⅠ高度表达,经脱细胞处理后MHCⅠ明显减少。去除小颗粒面积阈值为21,阳性颗粒面积与视场面积比,即MHCⅠ表达率(见表2及图6)。
表2 各组血管MHCⅠ表达率(±s)

表2 各组血管MHCⅠ表达率(±s)
注:与A、B组比较,aP<0.01
组别 例数 MHCⅠ表达率(%)A 组 7 24.58±3.30 B 组 7 24.00±3.07 C 组 7 1.45±0.19aD 组 7 1.40±0.17a
3 讨论
3.1 脱细胞血管支架的特点 我们选择血管支架材料的时候要考虑到以下几点:有利于细胞黏附和增殖的三维空间结构;具备适当的力学强度和良好的生物相容性;能促进分化和新生组织的形成及与血管生成因子的相互结合调控等作用[2]。
脱细胞组织基质(acellular tissue matrix,ACTM)是应用物理或化学方法将异体或异种组织进行脱细胞处理,从而去除组织移植过程中引起排斥反应的相关抗原,以用于修复损伤组织的一种十分理想的新型生物材料。它有以下特点:
第一,它保留了天然血管的胞外基质成分和完整的组织结构。基质中的一些氨基酸残基序列如精氨酸-甘氨酸-天冬氨酸、精氨酸-谷氨酰胺-天冬氨酸-缬氨酸等[3,4],可以被细胞膜的整合素受体识别,促进细胞在基质上的吸附,参与细胞分裂和加快细胞分化[5]。研究表明,脱细胞基质主要由胶原纤维、弹性纤维、糖蛋白(GAG)等组成[6]。胶原纤维和弹性纤维是维持血管弹性和机械强度的主要物质,且抗原性低,生物可降解性好;GAG是一种非免疫原性的物质,可以结合生长因子和细胞因子,对细胞的黏附、迁移、增殖和分化起调节作用[6,7]。这些成分共同形成了一个符合生理要求的微环境,促使细胞生长增殖和组织再生[8]。
第二,脱细胞支架中可溶性蛋白、脂质、核酸等细胞成分被完全去除,因此移植体内后引起的免疫排异和钙化的发生率大大降低[9]。
第三,大量胶原纤维和弹性纤维的存在维持了血管的弹性和机械强度[10,11],使脱细胞支架具有与天然血管相近的机械特性[12](包括手术缝合固定易操作性),对保证血管移植物的长期通畅性起关键作用[13],同时也防止了远期动脉瘤的发生。
第四,种植种子细胞后,可有一定的恢复和生长能力。
3.2 脱细胞方法的探讨 目前制备血管脱细胞基质的方法主要有 3种:酶消化法、去污剂法和酶-去污剂法。
3.2.1 单纯酶消化法 早些年人们多使用胰蛋白酶Trypsin作为主要的消化酶降解血管中的细胞成分[14]。Trypsin来源于动物体内,属于生物酶类,本质上是一种蛋白质,被血清中的成分中和后不会产生任何有细胞毒性的残留成分,所以是一种理想的脱细胞试剂。为了避免Trypsin消化后DNA成分的残留,又有人利用RNase和DNase来消化残留的DNA成分,使脱细胞支架材料中的残余DNA含量少于0.1%,降低了移植后发生钙化的可能性(组织学及扫描电镜分析证实,经过RNase和DNase消化后,支架材料的结构并没有发生明显的变化)。但目前的研究表明,单纯酶脱细胞法对其基质纤维有一定程度的损伤,会使基质管壁变薄,管腔轻微塌陷,张力强度降低。故单纯酶脱细胞法并不是一种理想的脱细胞方法。
3.2.2 单纯去垢剂法 去垢剂使用较多的是十二烷基磺酸钠(SDS)和聚乙二醇辛基苯基醚(Triton X-100)。Triton X-100和SDS脱细胞的原理都是破坏细胞的脂质膜结构,使细胞及细胞器碎裂而脱除。最近的研究表明,去垢剂对材料的力学性质有很大的影响。离子型去垢剂SDS脱细胞效果强,但会使大量细胞在短时间内破裂,释放大量蛋白酶,从而损伤较多的细胞外基质纤维,如果脱细胞支架上的胶原及弹性膜等结构保存不完整,则将影响种子细胞的黏附、增殖、分化和生物力学特性[15]。
据文献报道,SDS处理后会使血管壁中的弹性膜变直,失去弹性[16];另外SDS处理可使胶原蛋白的三维螺旋结构变得不稳定,同时材料的弹性蛋白网变得膨胀[17]。这种变形的弹性蛋白成分在体内容易发生降解,降低生物材料在体内的存在时间,导致血管移植物的扩张膨胀以至于形成动脉瘤。而非离子去垢剂Triton X-100比离子去垢剂更温和,细胞内蛋白酶释放缓慢,因此对细胞外基质损伤比较小,但其脱细胞效果在不同的组织中是不同的。有研究表明,Triton X-100处理的瓣膜基本上没有细胞成分,而动脉等组织内仍然有细胞残留[18]。因此Triton X-100的脱细胞方法要根据需要配合使用SDS。
3.2.3 酶-去污剂法 由于单纯的酶消化法对细胞外基质成分有损害,单纯的去污剂法又难以全部脱除细胞,所以人们普遍将酶消化法和去污剂法结合起来制备血管脱细胞基质。然而,根据资料,酶-去污剂法制备血管脱细胞基质的效果还不一致,有些报道效果良好[19,20],有些报道基质管腔塌陷或不全塌陷[6]。鉴于此,国内外学者开始考虑各种新型的脱细胞方法,取得了一些阶段性的进展。
3.3 本试验中脱细胞血管支架的制备特点 本次实验中,在使用去垢剂之前,我们增加了反复冻融的过程。这样的过程在以往的文献中也有提到,但冻融的时间及条件不同,并且文献中没有对反复冻融后血管的大体及微观改变提出充足的实验室依据,也没有对发生改变的原因进行分析。我们通过实验发现,反复冻融对整个血管段的外观及力学性能无明显影响,光镜下观察血管基质的纤维成分排列正常,弹力膜完好,但血管中的细胞成分已经发生破坏,电镜观察到经反复冻融的细胞大多发生了明显的破裂。导致细胞破裂的原因我们考虑如下:细胞是由各种膜构成的结构,在细胞表面及内部各种细胞器表面都包被着膜样结构,这种膜样结构使得细胞与周围环境、细胞器与细胞内的液体环境相互独立,彼此分开。当细胞受到温度的反复剧烈变化时,细胞及其内部细胞器的体积就会随之而变化,从而导致细胞中的各种膜样结构破坏,细胞发生溶解。然而所有的上述过程都是在低温条件下发生的,这种低温条件可以有效地抑制细胞内蛋白酶的活性,从而保护基质纤维成分,也使得血管的力学性能不会发生明显改变。
本实验中我们使用十二烷基磺酸钠(SDS)和聚乙二醇辛基苯基醚(Triton X-100)来脱除细胞。虽然有文献报道单独使用这两种洗脱剂可以脱去血管细胞(SDS的常用浓度为1%,Triton X-100的最佳浓度为1%[21]),但所需时间较长,最长 170余小时[6],并且单独使用时Triton X-100作用较弱,不能完全去除细胞,效率低下,而SDS又作用过强,虽然去细胞的效果好,但是即使利用0.1%SDS消化主动脉血管,在血管基质中的残余成分仍有很大毒性,致使支架的生物相容性差,细胞无法生长[22]。目前国内有很多人在使用SDS脱细胞,浓度大多在0.1%~1.0%范围内。在阜外心血管病医院外科所做的一项国家863高技术研究发展计划资助项目中建议:用质量浓度为0.03%SDS脱瓣膜的ECs,而脱主动脉壁的ECs SDS浓度应增至0.1%。本实验重复后发现,单独使用0.1%SDS时剂量仍然偏大,血管壁内弹力膜破坏严重,且细胞毒性较大,细胞无法生长。Rieder等[22]的研究也表明,使用0.1%SDS制备的脱细胞血管基质由于细胞毒性过大,细胞根本无法在上面存活。Triton X-100和SDS脱细胞的原理都是破坏细胞的脂质膜结构,使细胞及细胞器碎裂而脱除。本实验将Triton X-100放在SDS之前,是因为SDS为离子型去垢剂,脱细胞效果强,短时间内大量细胞破裂后释放的蛋白酶较多,从而引起较多的蛋白纤维损伤,影响血管的结构和力学特性,故让柔和的非离子型去垢剂Triton X-100先去除部分细胞及内在的蛋白酶,使细胞内的蛋白酶不至于短时间内大量释放,降低胶原纤维、弹力纤维的损伤。利用核酸酶对残余的DNA、RNA进行充分消化,可以进一步降低血管支架的抗原性,也降低了疾病传播的概率[23,24]。PMSF是一种蛋白酶抑制剂,在脱细胞溶液中加入PMSF,可以减少非特异蛋白酶的激活,对胞外基质成分具有保护作用。从电镜观察结果可知,D组的血管内膜面充满了孔隙,这对于细胞的长入至关重要。
总之,本实验中采用的反复冻融+Triton X-100+PMSF+0.01%SDS的方法能够完全脱去犬动脉血管壁中的细胞成分,同时对血管壁的纤维成分及整个血管的力学性能没有影响,是制备脱细胞血管支架的有效方法。
(本文图片第383~384页)
[1]Schaner PJ,Martin ND,Tulenko TN,et al.Decellularized vein as a potentialscaffold for vascular tissue engineering.J Vasc Surg,2004,40:146-153.
[2]段小军,杨柳,周跃.生物材料在治疗性血管生成中的应用.中华创伤骨科杂志,2004,6:1399-1403.
[3]Vande Vondele S,Voros J,Hubbell JA.RGD-grafted poly-L-lysine-graft-(polyethylene glycol) copolymers block non-specific protein adsorption while promoting cell adhesion.Biotechnol Bioeng,2003,82:784-790.
[4]Kim TG,Park TG.Biomimicking extracellular matrix:cell adhesive RGD peptide modified electrospun poly(D,L-lactic-co-glycolic acid)nanofiber mesh.Tissue Eng,2006,12:221-233.
[5]王石泉,朱爱萍,胡勤刚,等.组织工程血管构建的研究进展.中国修复重建外科杂志,2001,15:286-290.
[6]韩雪峰,杨大平,郭铁芳.曲拉通X-100对制备脱细胞血管基质影响的实验研究.中华外科杂志,2002,40:27.
[7]熊猛,鲁开化,商庆新,等.血管组织工程基质材料及管形支架的制备.西北国防医学杂志,2004,25:3.
[8]Kallenbach K,Leyh RG,Lefik E,et al.Guided tissue regen-eration∶porcine matrix does not transmit PERV.Bioma-terials,2004,25:3613.
[9]Schmidt CE,Baier JM.Acellular vascular tissues∶natural biomaterials for tissue repair and tissue engineering.Biomaterials,2000,21:2215.
[10]Dahl SL,Koh J,Prabhakar V,et al.Decellularized native and engineered arterial scaffolds for transplantation.Cell Transplant,2003,12:659-666.
[11]Boccafoschi F,Habermehl J,Vesentini S,et al.Biological performances of collagen-based scaffolds for vascular tissue engineering.Biomaterials,2005,26:7410-7417.
[12]Conklin BS,Richter ER,Kreutziger KL,et al.Development and evaluation of a novel decellularized vascular xenograft.Med Eng Phys,2002,24:173.
[13]Greenwald SE,Berry CL.Improving vascular grafts:the importance of mechanical and haemodynamic properties.J Pathol,2000,190:292.
[14]刘国锋,杨大平,郭铁芳,等.小口径组织工程血管脱细胞生物支架材料的研究.中国康复理论与实践,2008,14:234-236.
[15]Booth C,Korossis SA,Wilcox HE,et al.Tissue engineering of cardiac valve prostheses Ⅰ :development and histological characterization of anacellular porcine scaffold.J Heart Valve Dis,2002,11:457-462.
[16]Chang Y,Hsu CK,Wei HJ,et al.Cell-free xenogenic vascular grafts fixed with glutaraldehyde or genipin:in vitro and in vivo studies.Journal of Biotechnology,2005,120:207-219.
[17]Courtman DW,Pereira CA,Omar S,et al.Biomechanical and ultrastructural comparison of cryopreservation and a novel cellular ex-traction of porcine aortic valve leaflets.J Biomed Mater Res,1995,29:1507-1516.
[18]Grauss RW,Hazekamp MG,Oppenhuizen F,et al.Histological evaluation of decellularized porcine aortic valves∶matrix changes due to different decellularization methods.Eur J Cardiothorac Surg,2005,27:566.
[19]顾春虎,刘维永,张近宝,等.不同试剂脱除猪胸主动脉壁细胞的对比研究.心脏杂志,2005,17:207-209.
[20]范恒华,张伯勋,梁向党,等.脱细胞血管基质制备和异体移植的实验研究.中华外科杂志,2005,43:870-874.
[21]Bergmeister H,Boeck P,Kasimir MT,et al.Effect of laser perforation on the remodeling of acellular matrix grafts.Journal of Biomedical Materials Research Part B:Applied Biomaterials,2005,74:495-503.
[22]Rieder E,Kasimir MT,Silberhumer G,et al.Decellularization protocols of porcine heart valves differ importantly in efficiency of cell removal and susceptibility of the matrix to recellularization with human vascular cells.J Thorac Cardiovas Surg,2004,127:399.
[23]Greenwald SE,Berry CL.Improving vascular grafts:the importance of mechanical and haemodynamic properties.J Pathol,2000,190:292.
[24]Harashina T.Arterial allografts and heterografts in microvacular wein grafting.J plast Surg(Br),1978,31:16.
New method to prepare good acellular matrices of canine thoracic aortas
LI Wei*,LIN Ke,ZHOU Yan-rong,et al.*Department of Cardiovascular Surgery,Xinqiao Hospital,Third Military Medical University,Chongqing 400037,China
Objective This paper is to explore a new method to remove all the cells from canine thoracic aortas for preparing good acellular matrices of canine thoracic aortas and then providing scaffolds for constructing tissue-engineering blood vessels.Methods Twenty eight canine thoracic aortas were divided into four groups randomized:group A(n=7)was normal canine thoracic aortas,group B(n=7)was frozen and thawed repeatedly for two times,group C(n=7)was treated with 0.1%SDS,group D(n=7)was frozen and thawed repeatedly for two times and then treated with phosphate-buffered saline(PBS)containing 1%Triton X-100 and 1 μmol/L phenyl methyl sulfonyl fluoride(PMSF)for two days,finally treated with 0.01%SDS for one day.Treated specimens were observed with naked eyes,optical microscope and scanning electron microscope,their mechanic properties were measured and compared among them.Results Although method of 0.1%SDS could entirely remove the cells of samples,the elastic fibers of vessel wall were in a great mess or destroyed,the acellular matrices prepared with it did not maintain shape and strain.The method in group D not only entirely removed the cells of samples and maintained the normal structure of matrix fiber in samples,but also maintained good shape and mechanical properties of the acellular matrices prepared.Conclusion The method in group D is a better and new method for preparing acellular matrices of canine thoracic aortas.
Tissue engineering; Acellular matrix; Dog; Thoracic aortas
AN Qi,E-mail:www.anqi_hx.163.com
安琪,E-mail:www.anqi_hx.163.com
10.3969/j.issn.1672-5301.2014.04.015
Q95-33;R654.2
A
1672-5301(2014)04-0337-06
2014-01-20)
