冠心病合并糖代谢异常患者血浆PPAR-γ、APN及胰岛素抵抗水平的变化
2014-09-15刘娟李晓燕孙青张红明韩淑芳高玉琪陈英剑
刘娟 李晓燕 孙青 张红明 韩淑芳 高玉琪 陈英剑
临床研究
冠心病合并糖代谢异常患者血浆PPAR-γ、APN及胰岛素抵抗水平的变化
刘娟 李晓燕 孙青 张红明 韩淑芳 高玉琪 陈英剑
作者单位:250031 山东省济南市,济南军区总医院心内科(刘娟、李晓燕、孙青、张红明、韩淑芳、高玉琪),检验科(陈英剑)
目的 比较冠心病(CHD)合并糖代谢异常患者血浆PPAR-γ、APN及胰岛素抵抗水平的变化,并探讨相互的关系。方法 根据口服葡萄糖耐量试验(OGTT),将160例CHD患者分为A组[CHD合并糖尿病(DM)组,51例]、B组(CHD合并糖耐量受损(IGT)组,59例]和 C组(单纯CHD组,50例);选取 50名健康体检者为D组(健康对照组,50例)。采用酶联免疫吸附法(ELISA法)检测受试者血浆PPAR-γ、APN及空腹胰岛素(FIN)水平。结果 ①A组、B组的FIN、HOMA-IR显著高于C组、D组(P<0.01),且A组显著高于B组(P<0.01),C组、D组之间差异无统计学意义(P>0.05)。②A组、B组、C组、D组四组的血浆PPAR-γ、APN浓度逐渐升高,各组之间差异有统计学意义(P<0.05)。③血浆PPAR-γ水平与APN水平呈显著正相关(r=0.579,P<0.01),与 HOMA-IR呈显著负相关(r=-0.547,P<0.01)。 结论 单纯 CHD、CHD合并 IGT、CHD合并DM患者血浆PPAR-γ、APN水平依次降低,胰岛素抵抗水平依次增高。CHD患者血浆PPAR-γ水平可能与APN、胰岛素抵抗水平及糖代谢异常的程度相关。
冠状动脉疾病; 糖代谢异常; 过氧化物酶体增殖物激活受体-γ; 脂联素; 胰岛素抵抗
目前的研究证明,胰岛素抵抗(insulin resistance,IR)是冠心病(cronary heart diseas,CHD)与糖代谢异常之间的关键病理生理环节,是高血压、糖代谢紊乱、血脂异常的共同发病基础[1]。
过氧化物酶体增殖物激活受体-γ(peroxisome proliferator activated receptor-γ,PPAR-γ)是一类由配体激活的核转录因子,大量研究已经证明其参与脂肪形成、葡萄糖稳态和脂质代谢,可以改善IR,也在炎症和肿瘤生长中发挥关键作用[2,3]。脂联素(Adiponectin,APN)可以调节胰岛素敏感性和能量平衡,遗传因素与环境因素均与低脂联素浓度相关联,并且可能导致IR、2型糖尿病、动脉粥样硬化的发展[4]。研究表明,肥胖和代谢综合征患者循环APN浓度降低,在给予PPAR-γ激动剂治疗后,血浆APN水平较前显著增加[5]。由于血浆APN水平可反映PPAR-γ活性,故现在APN越来越多地用作PPAR-γ疗效的生物标志物。本研究旨在探讨冠心病合并糖代谢异常人群血浆PPAR-γ、APN及IR水平的变化,并对其作进一步的相关性分析,以期指导临床实践。
1 对象与方法
1.1 研究对象 选取2012年3月至2013年10月在济南军区总医院心血管内科门诊或住院确诊为CHD的患者为研究对象,对其进行口服葡萄糖耐量试验(oral glocuse tolerance test,OGTT),从中随机选取160例,根据OGTT结果分为3组:A组[CHD合并糖尿病(DM)组,51例]、B组[CHD合并糖耐量受损(IGT)组,59例]、C组(单纯 CHD 组,50例),均给予常规 CHD治疗,包括阿司匹林、他汀类、硝酸酯类等药物。另选取同期于我院行健康查体的病史与实验室检查均正常者为D组(健康对照组,50例)。所有研究对象均签署知情同意书。排除标准:①2个月内有任何形式的降糖药物干预治疗;继发性血糖升高;②高血压、结缔组织病、自身免疫性疾病及恶性肿瘤病史;③近3个月内急性心肌梗死或脑卒中或短暂性脑缺血发作病史;④肝肾功能不全者,NYHA心力衰竭分级Ⅲ或Ⅳ级;⑤近期有创伤手术史及急性感染性疾病史;⑥妊娠、哺乳期;⑦正在服用TZDs、贝特类、ARBs药物
1.2 研究方法
1.2.1 一般资料的收集 入选患者均记录姓名、性别、年龄,详细询问病史、用药史、既往史,测量血压、身高、体重,计算体重指数(BMI):

1.2.2 血样采集 入选患者均禁食8~10 h,次日清晨空腹抽取肘静脉血8 ml,4 ml送检测定肝功、血脂、生化等指标;4 ml离心3000 rpm ×10 min,分离血清保存于-80℃冰箱。待标本收集全后,采用ELISA 法测定空腹胰岛素(FIN)、PPAR-γ、APN 含量。空腹抽血后口服葡萄糖粉75 g加水250~300 ml(5~10 min内饮完),2 h后采静脉血测定血糖。
1.2.3 血浆 PPAR-γ、APN、FIN的检测 均采用ELISA法测定。人APN ELISA试剂盒由Becton Dickinson公司提供,人PPAR-γ和人FIN ELISA试剂盒由美国tszelisa公司提供,批内和批间差异均小于9%,并严格按照试剂盒说明书进行操作。
1.2.4 计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR) 采用稳态模式评估法(Homeostasis model assessment,HOMA)计算:
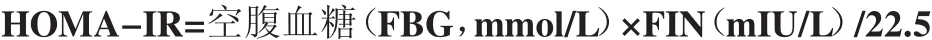
1.3 统计学方法 采用SPSS 19.0统计学软件。主要统计指标行正态性检验,正态分布数据用±s表示,两组间均数比较用t检验,四组间均数比较用单因素方差分析,四组间两两比较用SNK法(q检验)。采用t检验和方差分析的资料均进行方差齐性检验,若方差不齐,用Kruskal Wallis检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征比较
2.1.1 一般临床资料比较 四组间年龄、性别、血压两两比较差异无统计学意义。A组、B组、C组的BMI均高于 D 组,差异有统计学意义(P<0.05)。见表1。
2.1.2 基本生化、血脂指标比较 四组间TC、LDL、TG、Cr、BUN 差异均无统计学意义(P>0.05)。A 组、B组、C组的 HDL均低于 D 组(P<0.05),A 组、B组、C组三组之间差异无统计学意义(P>0.05);B组、C组、D组的FBG均低于A组(P<0.01),B组、C组、D组三组之间差异无统计学意义(P>0.05);A组、B组的 2 h PG 高于 C 组、D 组(P<0.01),且 A组的2 h PG高于B组,C组、D组两组间的2 h PG差异均无统计学意义(P>0.05)。见表2。
表1 一般临床资料的比较(±s)
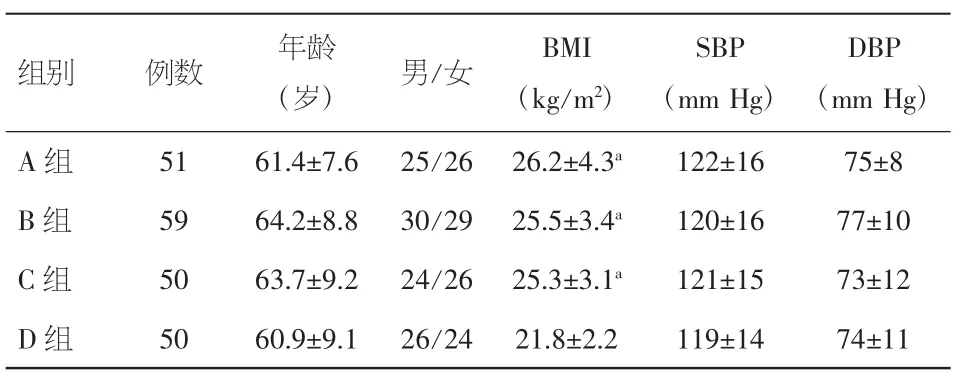
表1 一般临床资料的比较(±s)
注:与 D 组比较,aP<0.05。BMI:体重指数;SBP:收缩压;DBP:舒张压
组别 例数 年龄DBP(mm Hg)A 组 51 61.4±7.6 25/26 26.2±4.3a122±16 75±8 B 组 59 64.2±8.8 30/29 25.5±3.4a120±16 77±10 C 组 50 63.7±9.2 24/26 25.3±3.1a121±15 73±12 D 组 50 60.9±9.1 26/24 21.8±2.2 119±14 74±11(岁) 男/女 BMI(kg/m2)SBP(mm Hg)
表2 四组基本生化、血脂指标比较(±s)

表2 四组基本生化、血脂指标比较(±s)
注:与 D 组比较,aP<0.05;与 C 组比较,bP<0.05;与 B 组比较,cP<0.05。TC:总胆固醇;LDL:低密度脂蛋白;TG:甘油三酯;HDL:高密度脂蛋白;FBG:空腹血糖;2 h PG:餐后2 h血糖;BUN:尿素氮;Cr:肌酐
组别 例数 TC(mmol/L)2 h PG(mmol/L)A 组 51 4.07±1.52 2.35±0.70 1.61±0.72 1.29±0.31a74.63±14.62 4.72±1.02 8.26±0.72abc14.56±2.89abcB 组 59 4.15±1.71 2.20±0.92 1.71±1.09 1.31±0.35a73.42±15.53 4.81±1.52 5.60±0.39 9.24±0.81abC 组 50 4.43±1.32 2.32±1.02 1.62±1.06 1.30±0.34a76.36±13.96 4.85±1.35 5.03±0.42 6.77±1.65 D 组 50 4.01±0.54 2.06±0.54 1.56±0.92 1.82±0.32 77.60±14.32 4.90±1.46 4.98±0.41 6.76±1.43 LDL(mmol/L)TG(mmol/L)HDL(mmol/L)Cr(μmol/L)BUN(mmol/L)FBG(mmol/L)
2.2 FIN、HOMA-IR水平的比较 A组、B组的FIN、HOMA-IR均高于C组、D组(P<0.01),且A组的 FIN、HOMA-IR 高于 B 组(P<0.01),C、D 组的FIN、HOMA-IR差异无统计学意义(P>0.05)。见表3。
2.3 血浆PPAR-γ、APN水平比较 A组、B组、C组的血浆 PPAR-γ、APN水平均低于 D组(P<0.05),且 A 组、B 组的血浆 PPAR-γ、APN 水平均低于 C 组(P<0.01),A 组的血浆 PPAR-γ、APN 水平低于 B组(P<0.01),各组间差异有统计学意义。见表4。
2.4 PPAR-γ与 APN、HOMA-IR的相关性分析血浆PPAR-γ水平与APN呈显著正相关(r=0.579,P<0.01),与 HOMA-IR 呈显著负相关(r=-0.547,P<0.01)。见图 1、图 2。
表 3FIN、HOMA-IR 的比较(±s)
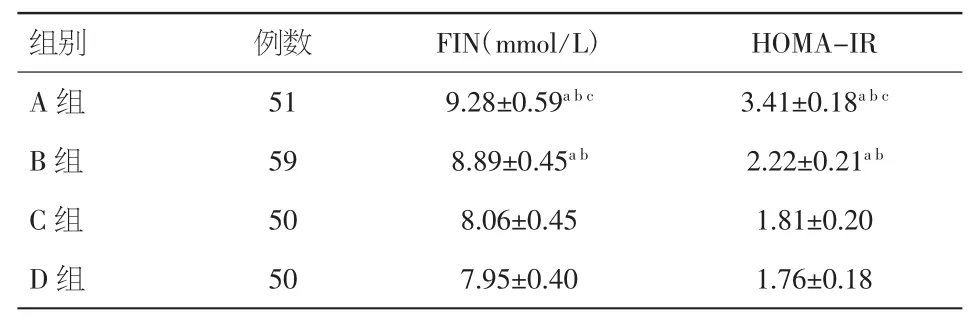
表 3FIN、HOMA-IR 的比较(±s)
注:与 D 组比较,aP<0.05;与 C 组比较,bP<0.05;与 B 组比较,cP<0.05。FIN:空腹胰岛素;HOMA-IR:胰岛素抵抗指数
组别 例数 FIN(mmol/L) HOMA-IR A 组 51 9.28±0.59abc3.41±0.18abcB 组 59 8.89±0.45ab2.22±0.21abC 组 50 8.06±0.45 1.81±0.20 D 组 50 7.95±0.40 1.76±0.18
表 4 血浆 PPAR-γ、APN 水平比较(±s)
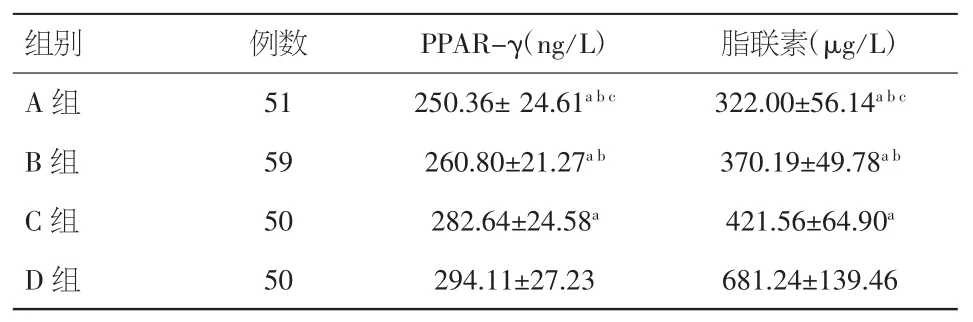
表 4 血浆 PPAR-γ、APN 水平比较(±s)
注:与D 组比较,aP<0.05;与C组比较,bP<0.01;与B组比较,cP<0.01
组别 例数 PPAR-γ(ng/L) 脂联素(μg/L)A 组 51 250.36± 24.61abc322.00±56.14abcB 组 59 260.80±21.27ab370.19±49.78abC 组 50 282.64±24.58a421.56±64.90aD 组 50 294.11±27.23 681.24±139.46

图1 血浆PPAR-γ与APN散点图
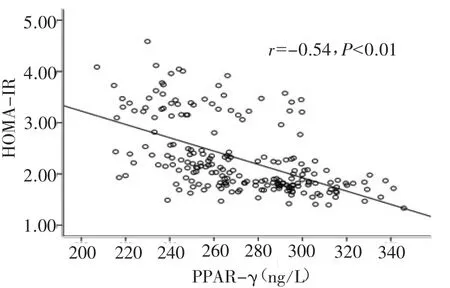
图2 血浆PPAR-γ与HOMA-IR散点图
3 讨论
糖代谢异常是心血管疾病最重要的危险因素之一,在CHD人群中普遍存在。糖代谢异常的发病机制尚未完全阐明,但大量研究均提示主要与IR有关,表现为胰岛素对靶组织的敏感性降低。本研究中,健康对照组、单纯CHD组、CHD合并IGT组、CHD合并DM组四组患者的基线临床特征比较显示,CHD三个亚组的BMI显著高于健康对照组;而公认的“优良脂”——HDL,CHD三个亚组则显著低于健康对照组;糖代谢指标FIN、HOMA-IR在糖代谢异常的两个亚组(CHD合并IGT组、CHD合并DM组)中显著增高,且CHD合并DM组升高明显,显示CHD、糖代谢异常人群普遍存在肥胖、糖脂代谢紊乱。
基因组学的研究表明,PPAR-γ与多个基因相关联影响胰岛素的作用,改善IR[6]。此外,PPAR-γ活化可增加脂肪细胞对胰岛素的敏感性,这可能通过直接激活基因编码的胰岛素信号通路部分地被介导[7,8]。PPAR-γ可在内皮细胞中表达,通过抑制NF-κB、AP-1、蛋白激酶C信号通路和氧化应激反应抑制促炎性细胞因子和趋化因子的表达,从而降低内皮细胞的活性和炎症反应[9]。PPAR-γ也可通过加强胆固醇外流,减少巨噬细胞数量,降低细胞外基质效应,稳定易损斑块,在斑块形成的不同阶段发挥抗动脉粥样硬化的保护作用[10,11]。APN在脂质代谢、抗炎、抗动脉粥样硬化中显示出重要作用[12,13],其血浆水平与IR、血压、血脂、肥胖均存在一定程度的相关性,是唯一被证明与心血管疾病、代谢综合征及DM呈负相关的脂肪因子[14]。Hotta等[15]研究表明,冠状动脉疾病和DM患者血浆APN浓度显著降低。测定血浆APN水平可早期识别心血管事件高危患者,把DM的干预提前到IGT阶段。PPAR-γ在APN表达、装配和分泌的调节中发挥主要作用,进而影响APN基因的活化,APN的细胞水平和多聚化也可以通过PPAR-γ来调节[16]。PPAR-γ通过直接结合到保守的DNA顺式作用元件进而调控APN的转录。在人类和小鼠的体内和体外研究表明,TZDs及选择性PPAR-γ激动剂均可使APN的表达和分泌上调[17,18]。由于血浆APN水平忠实地反映PPAR-γ活性,现在APN越来越多地用作PPAR-γ疗效的生物标志物。
本研究发现,CHD三个亚组的PPAR-γ、APN水平较健康对照组显著降低,且CHD合并DM组降低最明显,CHD合并IGT组次之,单纯CHD组降低程度最小。四组患者血清PPAR-γ、APN水平依次降低,而IR水平依次增高。进一步的相关分析表明,血清PPAR-γ水平与血清APN水平呈正相关(r=0.579,P<0.01),与 HOMA-IR 呈负相关(r=-0.547,P<0.01),提示 CHD患者血清 PPAR-γ水平与APN水平、IR及糖代谢异常的程度相关,为进一步的临床研究提供了试验依据。但本研究样本量相对较少,并且仅对患者的血清学指标作了初步探讨,论证力度不够强,导致结果有一定的局限性,尚需大规模的临床及基础研究加以证实。
[1]Jensen NS.Obesity and cardiovascular disease:is body structure a factor?Curr Opin Lipidol,1997,8:200-204.
[2]Langle Y,Lodillinsky C,Belgorosky D,et al.Role of peroxisome proliferator activated receptor-gamma in bacillus Calmette-Guérin bladder cancer therapy.J Urol,2012,188:2384-2390.
[3]Jung UJ,Torrejon C,Chang CL,et al.Fatty acids regulate endothelial lipase and inflammatory markers in macrophages and in mouse aorta:a role for PPARγ.Arterioscler Thromb Vasc Biol,2012,32:2929-2937.
[4] Ziemke F,Mantzoros CS.Adiponectin in insulin resistance lessons:from translational research.Am J Clin Nutr,2010,91:S258-261.
[5]Kusminski CM,Scherer PE.The road from discovery to clinic:adiponectin as a biomarker of metabolic status.Clin Pharmacol Ther,2009,86:592-595.
[6]Monsalve FA,Pyarasani RD,Delgado-Lopez F,et al.Peroxisome proliferator-activated receptor targets for the treatment of metabolic diseases.Mediators of Inflammation,2013,17:18.
[7]Higashi Y,Holder K,Delafontaine P,et al.Thiazolidinediones up-regulate insulin-like growth factor-1 receptor via a peroxisome proliferator-activated receptor gamma-independent pathway.J Biol Chem,2010,285:36361-36368.
[8]Eldor R,DeFronzo RA,Abdul-Ghani M,et al.In vivo actions of peroxisome proliferator-activated receptors:glycemic control,insulin sensitivity, and insulin secretion. Diabetes Care,2013,36:S162-174.
[9] Xu Y,Yang X,Wang Z, et al.Estrogen sulfotransferase(SULT1E1)regulates inflammatory response and lipid metabolism of human endothelial cells via PPARγ.Mol Cell Endocrinol,2013,369:140-149.
[10]Pelham CJ,Keen HL,Lentz SR,et al.Dominant negative PPARγ promotes atherosclerosis,vascular dysfunction, and hypertension through distinct effects in endothelium and vascular muscle.Am J Physiol Regul Integr Comp Physiol,2013,304:R690-701.
[11]Weber C,Noels H.Atherosclerosis:current pathogenesis and therapeutic options.Nature Medicine,2011,17:1410-1422.
[12]Rodina AV,Severin SE.The role of adiponectin in the pathogenesis of the metabolic syndrome and approach to therapy.Patol Fiziol Eksp Ter,2013,Jan-Mar(1):15-26.
[13]鲍国萍,韩玉龙,徐达华,等.冠心病合并心力衰竭患者血清脂联素水平变化.中国心血管病研究,2009,7:432-434.
[14] Antoniades C, Antonopoulos AS, Tousoulis D, etal.Adiponectin:fromobesity tocardiovascular disease.Obes Rev,2009,10:269-279.
[15]Hotta K,Funahashi T,Arita Y,et al.Plasma concentrations of a novel,adipose-specific protein,adiponectin,in type 2 diabetic patients.Arterioscler Thromb Vasc Biol,2000,20:1595-1599.
[16]Liu M,Liu F.Up-and down-regulation of adiponectin expression and multimerization:Mechanisms and therapeutic implication.Biochimie,2012,94:2126-2130.
[17]Fu N,Yang X,Ba K,et al.Low-intensity pulsed ultrasound induced enhanced adipogenesis of adipose-derived stem cells.Cell Prolif,2013,46:312-319.
[18]Wong WT,Tian XY,Xu A,et al.Adiponectin is required for PPAR-γ mediated improvement of endothelial function in diabetic mice.Cell Metab,2011,14:104-115.
The changes of the plasma levels of PPAR-γ and APN in coronary heart disease patients combined with abnormal glucose metabolism
LIU Juan*,LI Xiao-yan,SUN Qing,et al.*Department of Cardiology,Jinan Military General Hospital of PLA,Jinan 250031,China
Objective To compare the changes of the plasma peroxisome proliferator activated receptor-γ(PPAR-γ)and adiponectin(APN)levels in patients of coronary heart disease(CHD)combined with abnormal glucose metabolism,and to explore their relationship.Methods According to the oral glucose tolerance test(OGTT),160 patients with CHD were divided into group A (CHD combined with DM,n=51),group B(CHD combined IGT group,n=59)and group C (simple CHD group,n=50).50 healthy volunteers were regarded as group D(normal control group,n=50).Plasma PPAR-γ,APN and fasting insulin(FIN)levels of patients were tested by enzyme-linked immunosorbent assay(ELISA).Results ⑴The plasma FIN and HOMA-IR levels of group A,group B were higher than group C and group D(P<0.05),and the serum FIN and HOMA-IR levels of group A were higher than group B(P<0.05).⑵The plasma PPAR-γ and APN concentration gradually increased in the group A,group B,group C,group D,there were significant differences among the groups.⑶The plasma levels of PPAR-γ were significantly positively correlated with plasma APN levels(r=0.579,P<0.01),and significantly negatively correlated with HOMA-IR(r=-0.547,P<0.01).Conclusion Plasma PPAR-γ levels and APN levels of the simple CHD,CHD combined with IGT,CHD combined with DM patients decrease,while the degree of insulin resistance increase,suggesting that the plasma levels of PPAR-γ in patients with CHD may be associat-ed with APN levels,the degree of insulin resistance and abnormal glucose metabolism.
Coronary heart disease; Aboormal glucose metabolism; PPAR-γ; Adiponectin; Insulin resistance
LI Xiao-yan,E-mail:lixiaoyan902006@126.com
李晓燕,E-mail:lixiaoyan902006@126.com
10.3969/j.issn.1672-5301.2014.08.009
R541.4
A
1672-5301(2014)08-0702-05
2014-04-11)
