低HDL-C者外周血白细胞胆固醇流出调节基因表达及相关研究
2014-09-15仝其广陆尤马芙蓉毛雯张苗苗王春玲范煜东吴迪刘鹏刘艳霞胡大一
仝其广 陆尤 马芙蓉 毛雯 张苗苗 王春玲 范煜东 吴迪 刘鹏 刘艳霞 胡大一
临床研究
低HDL-C者外周血白细胞胆固醇流出调节基因表达及相关研究
仝其广 陆尤 马芙蓉 毛雯 张苗苗 王春玲 范煜东 吴迪 刘鹏 刘艳霞 胡大一
作者单位:100028 北京市,煤炭总医院心内科(仝其广、陆尤、马芙蓉、毛雯、张苗苗、王春玲、范煜东、吴迪、刘鹏);沈阳军区总医院干二科(刘艳霞);北京大学人民医院心脏中心(胡大一)
目的 研究低HDL-C患者外周血白细胞ABCA1和ABCG1 mRNA的表达状态。方法 采用实时荧光定量PCR方法,测定外周血白细胞ABCA1和ABCG1 mRNA表达水平。结果 低HDL-C患者ABCA1表达水平较对照组显著降低(0.23±0.09比1.18±0.49,P=0.042),ABCG1 mRNA表达差异无统计学意义(3.09±1.08比 3.94±1.48,P=0.355);低 HDL-C 者高敏 CRP(hs-CRP)水平明显高于对照组(2.34±1.68比1.15±0.48,P=0.008);血清 hsCRP 水平与 ABCA1 mRNA 表达呈负相关(r=-0.330,P=0.043),与血清 HDL-C水平无相关性(r=0.19,P=0.254)。多因素线性回归分析表明,ABCA1 mRNA表达水平与血清hs-CRP水平呈边缘性相关(β=-0.330,P=0.079)。结论 低HDL-C患者外周血ABCA1 mRNA表达水平降低,炎症因素或许是其机制之一。这可能是低HDL-C者心血管病风险增高的一个因素。
低高密度脂蛋白胆固醇; 外周血白细胞; 基因表达; 胆固醇流出
低HDL-C是心血管病的一个重要危险因素。流行病学早已发现,血清HDL-C水平降低可引起冠心病风险显著增高[1-4]。众所周知,HDL是参与胆固醇逆转运(RCT)的重要因子,通过HDL将外周组织(包括血管壁内)的胆固醇转运至肝脏代谢、排泄。这是目前认为HDL发挥抗动脉粥样硬化的关键所在。ABCA1和ABCG1基因是RCT径路中调控细胞内胆固醇流出的关键因子,与HDL等细胞外受体协同作用,完成RCT的过程。低HDL-C患者RCT基因的表达如何,相关影响因素怎样,目前尚少见报道。
1 对象与方法
1.1 研究对象 选择在煤炭总医院住院或体检的个体。其中低HDL-C组18例,男性15例,女性3例,平均年龄(64.33±5.53)岁;对照组 20 例,男性12例,女性 8例,平均年龄(65.8±15.65)岁。收集研究对象的基本资料、家族史、既往史、吸烟和饮酒史等。吸烟者定义为吸烟指数≥100支/年,且戒烟不超过2年。按照中国血脂异常防治指南定义低HDL-C标准为HDL-C<1.04 mmol/L。
凡有下列情况者予以排除:急性心肌梗死或急性脑卒中、糖尿病、入院前或体检前一个月内服用他汀或其他降脂药物、心力衰竭、严重肝肾功能损害、血液病、甲状腺疾病、肿瘤、绝经后用激素替代治疗妇女。
1.2 研究方法
1.2.1 血清学指标测定 清晨空腹(12 h)取静脉血,按标准方法测定血脂、血糖、血清肌酐、尿素氮和高敏CRP(hs-CRP)等生化指标。
1.2.2 外周血单核细胞胆固醇流出调节基因mRNA表达
1.2.2.1 RNA提取 清晨空腹取静脉血(12 h)2 ml置入EDTA抗凝管,并加入RNA保存液中,-80℃冰箱保存,一周内完成RNA提取。按照文献方法提取外周血白细胞RNA[5]。所有标本RNA均进行纯度、浓度和完整性检验(图1为提取RNA)。
1.2.2.2 基因表达 首先将白细胞总RNA逆转录成 cDNA。逆转录体系(20 μl体系):RNA 3 μl,5×Buffer 4 μl,dNTP 1 μl,Oligo(dT)1 μl,逆转录酶0.5 μl,DEPC H2O 10.5。
逆转录程序:42℃保温60 min。95℃ 5 min,4℃ 1~5 min,迅速放入-20℃长期冻存,统一进行表达实验。
荧光定量 PCR(反应体系为 25 μl):含基因组cDNA 1 μl,上游和下游引物分别为 5 pmol,dNTPmix 5 nmol,Taq 酶 1 U,Sybr Green 1(10×)1 μl及灭菌去离子水适量,应用自动循环仪进行扩增。扩增条件为:预变性94℃ 5 min。反应循环为:变性94℃ 30 s,退火56℃~61℃ 30 s,延伸72℃30 s,循环35次,最后72℃延伸 10 min。基因mRNA表达以β-actin标化。
引物:β-actin 上游引物 5’-TCCTTCTGCATCCTGTCGGCA-3’,下游引物 5’-CAAGAGATGGCCACGGCTGCT-3’;ABCA1 基因,上游引物 5’-GGCTGTGTCTCGTATTGTCTG-3’,下游引物 5’-CCTTGTGGCTGGAGTGTCA-3’;ABCG1 上游引物5’-AGAAAGACTTTGAAAGAGTT-3’,下游引物 5’-GGTAAATCACATACTTTGTT-3’。
RNA提取、引物合成及荧光定量PCR均由北京鼎国昌盛生物技术有限责任公司负责完成。
1.3 统计学方法 所有数据采用SPSS 18.0软件进行统计分析。计量资料以±s表示。偏态分布转化为正态分布后再进行分析。两组间比较采用t检验或Mann-Whitney U检验。计数资料应用卡方检验,参数间单因素相关分析采用Pearson分析,线性回归用于参数独立相关分析。双侧P<0.05为差异有统计学意义。
表1 低HDL-C与对照组一般临床资料(±s)

表1 低HDL-C与对照组一般临床资料(±s)
注:与对照组比较,aP<0.01
组别 例数 年龄(岁) 男/女 体重指数(kg/m2) 高血压(%) 饮酒(%) 吸烟(%)低 HDL-C 组 18 64.33±5.53 15/3 25.14±1.99 50.0 33.3a76.7a对照组 20 65.80±15.65 12/8 26.38±5.39 60.0 0.0 10.0
2 结果
2.1 低HDL-C组与对照组一般临床资料比较 选择低HDL-C组18例,对照组20例。两组基础资料比较发现,低HDL-C组吸烟和饮酒比例明显高于对照组(P<0.01);而两组年龄、男女比例、体重指数相近,高血压患病比例差异无统计学意义。见表1。
2.2 两组临床生化指标比较 从表2可见,低HDL-C组血清HDL-C水平明显低于对照组,hs-CRP水平则明显高于对照组。两组之间TC、TG和LDL-C浓度差异无统计学意义,肾功能指标和血糖水平差异也无统计学意义。
2.3 细胞胆固醇流出调节基因mRNA表达 图1为人外周血白细胞总RNA琼脂糖电泳分析结果(28S和18S核糖体RNA),提示提取RNA完整性良好。由图2、3可知,低HDL-C组两个胆固醇逆转运基因mRNA表达较对照组都呈降低趋势,其中ABCA1基因表达差异有统计学意义。
表2 低HDL-C组与对照组生化指标(±s)

表2 低HDL-C组与对照组生化指标(±s)
注:与对照组比较,aP<0.05
组别 例数 TC(mmol/L)Cr(μmol/L)低 HDL-C 组 18 4.17±2.28 1.19±0.67 0.83±0.13a2.19±0.48 2.34±1.68 6.39±1.87 5.78±1.86 79.83±20.00对照组 20 4.08±1.07 1.68±2.06 1.36±0.17 2.24±0.97 1.15±0.48 5.62±0.55 5.58±2.18 68.54±28.91 TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)hs-CRP(mg/dL)BS(mmol/L)BUN(mmol/L)
图1 人外周血白细胞RNA琼脂糖凝胶电泳结果
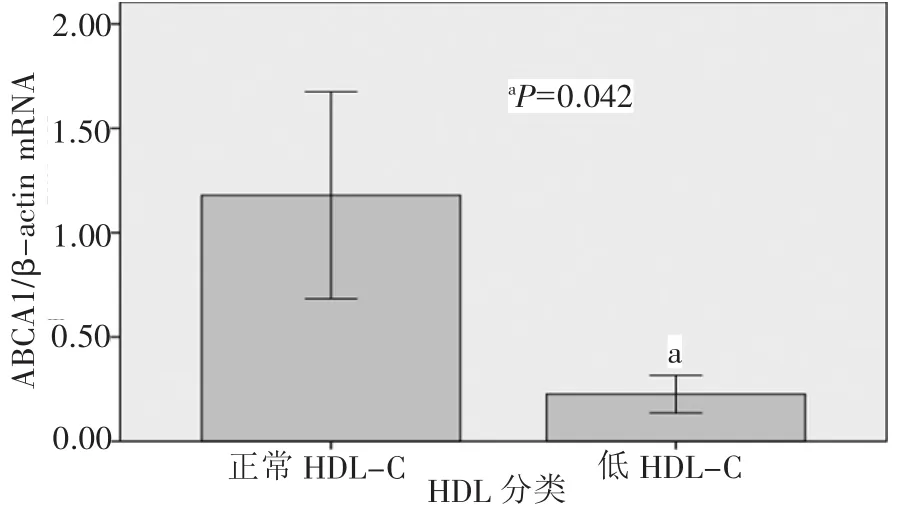
图2 不同HDL-C水平组ABCA1 mRNA表达比较
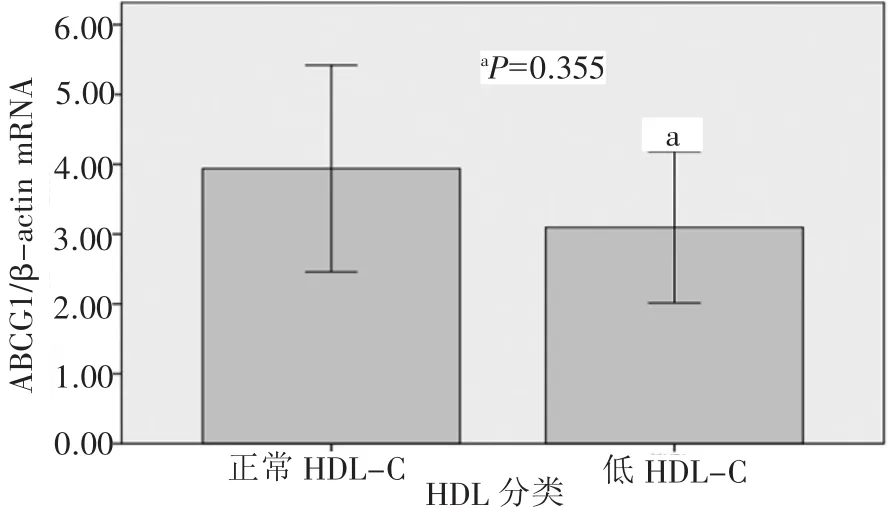
图3 不同HDL-C水平组ABCG1 mRNA表达比较
2.4 外周血细胞胆固醇流出调节基因ABCA1 mRNA表达相关性分析 对ABCA1 mRNA表达进行单因素相关分析,结果显示,ABCA1 mRNA表达水平与血清hs-CRP水平呈负相关(r=-0.330,P=0.043),与血清 HDL-C 水平无相关性(r=0.19,P=0.254)。多因素线性回归分析表明,ABCA1 mRNA表达水平与血清hs-CRP水平呈边缘性相关(β=-0.330,P=0.079);吸烟是影响 HDL-C 水平的相关因素(β=-0.283,P=0.004)。
3 讨论
低HDL-C是重要的心血管病危险因素。HDL通过接受从巨噬细胞等细胞内转出的胆固醇发挥抗动脉粥样硬化作用。细胞内胆固醇的流出主要受ABCA1、ABCG1和SR-BI基因的调控。这些基因表达增强能促进细胞内胆固醇的外流,防止细胞内胆固醇积聚及动脉粥样硬化的发生。本研究观察到,低HDL-C患者ABCA1 mRNA的表达明显降低,ABCG1表达虽有降低趋势,但差异无统计学意义,提示低HDL-C患者伴有ABCA1胆固醇通路受损。这与Holven等[6]的报道相一致。该研究发现15例低HDL-C患者ABCA1 mRNA表达明显降低。另一方面,白细胞ABCA1表达的抑制可促进动脉粥样硬化的发生[7]。虽然本研究未能进行转录后蛋白功能的探讨,不过细胞胆固醇流出调控基因表达的减弱很可能会导致细胞内胆固醇的积聚,从而促进动脉粥样硬化的发生发展。
外周血ABCA1 mRNA表达是否会影响血清HDL-C水平?进一步分析资料未见血清HDL-C水平与ABCA1mRNA表达之间的相关性,这表明外周血细胞ABCA1 mRNA表达对血清HDL-C水平无影响。文献也报道,外周组织的巨噬细胞RCT基因表达对血浆HDL-C浓度影响甚微[8],主要是肝细胞ABCA1等基因表达程度影响了血清HDL-C水平。本研究血清HDL-C水平与ABCA1表达无相关性也证实了这一点。肝脏ABCA1是apoA-I脂化的根本因素,是维持血浆HDL-C水平的决定因素[9]。外周血白细胞ABCA1 mRNA表达有可能影响细胞内胆固醇水平,并没有对血清胆固醇水平产生作用。
CRP作为一种炎症标志,也被认为是心血管病的危险因素。本研究中低HDL-C患者血清hsCRP水平较对照组明显升高,HDL-C水平与hs-CRP处于低度负相关状态。由于入选对象排除了感染、器官衰竭、肿瘤等情况,因此提示该部分病例体内存在一定程度的炎性反应。Wang等[10]在体外细胞培养实验中进一步观察到CRP可抑制人巨噬细胞源性泡沫细胞胆固醇的流出。Li等[11]也发现CRP低调外周血单核细胞ABCA1和ABCG1的mRNA表达。本课题同样表明,血清hsCRP水平与ABCA1 mRNA表达呈负相关。这些都提示低HDL-C患者ABCA1 mRNA表达降低可能与炎症有关。另外,有学者观察到抑制小鼠巨噬细胞RCT可促进细胞的炎症表型[12]。同样Holven发现,低HDL-C患者血清新碟呤(neopterin,一种炎性指标)水平明显升高,与之相伴随的是患者外周血单核细胞ABCA1和ABCG1表达降低,而抗炎因子如脂联素(adiponectin)缺乏能抑制ABCA1表达和ApoA-I合成[13,14],因此低HDL-C患者体内炎性因素增强,炎症可影响胆固醇流出调控基因的表达。低HDLC有可能通过炎症表型间接降低ABCA1表达。可见,低HDL-C、炎症和ABCA1表达抑制存在一定的内在联系。
脂质学说和炎症学说是动脉粥样硬化发生的两个主要学说。显然,低HDL-C患者存在血管保护性脂质HDL的降低,细胞胆固醇流出调节基因表达降低所致细胞内胆固醇积聚(致动脉粥样硬化作用增强),以及炎性因素的影响,这些都会显著增高心血管病发病的危险性。血清学因素、基因学水平、脂质学因素和炎症因素之间存在一定的联系。尽管目前为止专门升高HDL-C水平的临床试验仍未能获得积极的结果,但是针对HDL的干预仍然是值得探讨和努力的一个方向。
本研究也存在不足之处。如未检测胆固醇流出调节基因蛋白水平的表达,没有探讨低HDL-C患者HDL相关基因是否存在基因变异问题等。不过,从本研究中显示的吸烟对血清HDL-C水平的重要影响来看,研究病例存在HDL基因变异的可能性较小。
[1]Kannel WB.High-density lipoproteins:epidemiologic profile and risks of coronary artery disease.Am J Cardiol,1983,52:B9-12B.
[2]Castelli WP.Cardiovascular disease and multifactorial risk:challenge of the 1980s.Am Heart J,1983,106:1191-200.
[3]Assmann G,Cullen P,Schulte H.The Münster Heart Study(PROCAM).Results of follow-up at eight years.Eur Heart J,1998,19:A2-11.
[4]Cremer P,Nagel D,Mann H,et al.Ten-year follow-up results from the Goettingen Risk,Incidence and Prevalence Study(GRIPS).I.Risk factors for myocardial infarction in a cohort of 5790 men.Atherosclerosis,1997,129:221-230.
[5]Zhou H,Tan KC,Shiu SW,et al.Determinants of leukocyte adenosine triphosphate-binding cassette transporter G1 gene expression in type 2 diabetes mellitus.Metabolism,2008,57:1135-1140.
[6]Holven KB,Retterstol K,Ueland T,et al.Subjects with low plasma HDL cholesterol levels are characterized by an inflammatory and oxidative phenotype.PLoS ONE,2013,8:e78241.
[7]van Eck M,Bos IS,Kaminski WE,et al.Leukocyte ABCA1 controls susceptibility to atherosclerosis and macrophage recruitment into tissues.Proc Natl Acad Sci USA,2002,99:6298-6303.
[8]Haghpassand M,Bourassa PA,Francone OL,et al.Monocyte/macrophage expression of ABCA1 has minimal contribution to plasma HDL levels.J Clin Invest,2001,108:1315-1320.
[9]Timmins JM,Lee JY,Boudyguina E,et al.Targeted inactivation of hepatic Abca1 causes profound hypoalphalipoproteinemia and kidney hypercatabolism of apoA-I.J Clin Invest,2005,115:1333-1342.
[10]Wang X,Liao D,Bharadwaj U,et al.C-reactive protein inhibits cholesterol ef flux from human macrophage-derived foam cells.Arteriosclerosis Thrombosis and Vascular Biology,2008,28:519-526.
[11]Li CJ,Guo RY,Lou Jy,et al.The transcription levels of ABCA1,ABCG1 and SR-BI are negatively associated with plasma CRP in Chinese populations with various risk factors for atherosclerosis.Inflammation,2012,35:1641-1648.
[12]Westerterp M,Murphy AJ,Wang M,et al.Deficiency of ABCA1 and ABCG1 in macrophages increases inflammation and accelerates atherosclerosis in mice.Circ Res,2013,112:1456-1465.
[13]Oku H,Matsuura F,Koseki M,et al.Adiponectin deficiency suppresses ABCA1 expression and ApoA-I synthesis in the liver.FEBS Lett,2007,30:5029-5033.
[14]Matsuura F,Oku H,Koseki M,et al.Adiponectin accelerates reverse cholesterol transport by increasing high density lipoprotein assembly in the liver.Biochem Biophys Res Commun,2007,358:1091-1095.
Cholesterol efflux regulating gene expression in peripheral blood leukocytes and associated factors for subjects with low plasma HDL cholesterol levels
TONG Qi-guang*,LU You,MA Fu-rong,et al.*Department of Cardiology,Coal General Hospital,Beijing 100028,China
Objective To investigate ATP binding cassette transporters(ABCA1 and ABCG1)gene expression in peripheral blood leukocytes from subjects with low plasma HDL cholesterol levels.Methods Thirtyeight cases were enrolled,peripheral blood leukocytes ABCA1 and ABCG1 mRNA expression were measured by real-time quantitative PCR.Results ABCA1 mRNA expression in subjects with low plasma HDL cholesterol levels was obviously less than that in controls(0.23±0.09 vs 1.18±0.49,P=0.042),there was not different between two groups for ABCG1 mRNA expression(3.09±1.08 vs 3.94±1.48,P=0.355).The serum hscrp concentration in subjects with low plasma HDL cholesterol levels was statistically greater than that in controls(2.34±1.68 vs 1.15±0.48,P=0.008),negatively associated with ABCA1 mRNA expression(r=-0.330,P=0.043),and not related to plasma HDL-C concentration (r=0.19,P=0.254).Using multivariant linear regression analysis method,it was shown that ABCA1 mRNA expression was borderly associated with the serum hsCRP level(β=-0.330,P=0.079).Conclusion ABCA1 mRNA expression in the peripheral blood leukocytes from subjects with low plasma HDL cholesterol levels was reduced,inflammation maybe a cause,and it is one probably factor to result in higher cardiovascular disease risk for these patients.
Low plasma HDL cholesterol; Peripheral blood leukocytes; Gene expression; Cholesterol efflux
首都医学发展科研基金(项目编号:2007-3127)
10.3969/j.issn.1672-5301.2014.08.002
R54
A
1672-5301(2014)08-0677-04
2014-05-04)
