环氧化合物交联明胶水凝胶的制备及表征
2014-09-14陈肖会关国平
陈肖会,关国平,王 璐
东华大学 纺织面料技术教育部重点实验室(上海, 201620)
环氧化合物交联明胶水凝胶的制备及表征
陈肖会,关国平,王 璐﹡
东华大学 纺织面料技术教育部重点实验室(上海, 201620)
目的明胶水凝胶因其良好的生物相容性而成为一种应用前景很好的组织工程材料。该研究采用不同浓度的明胶,添加了适量的环氧化合物交联剂聚乙二醇二缩水甘油醚(PGDE),制备了不同的明胶水凝胶。红外光谱显示,PGDE以两端开环的方式交联到了明胶分子上。随着明胶和交联剂浓度的增大,水凝胶的溶胀率从1218.19%下降到525.23%,最大压缩应力显著增大,从27.64 kPa增大到113.20 kPa,压缩正切模量也从0.19 kPa增大到0.59 kPa,力学性能得到了明显提高。PGDE交联明胶水凝胶具有优异的弹性回复性能,弹性回复率最高可达98.03%。溶血率试验结果表明,凝胶有良好的血液相容性。
明胶;水凝胶;PGDE; 化学交联
0 引言
明胶是通过热变性或者物理化学降解作用,将胶原蛋白的三股螺旋结构裂解为单链大分子而获得的[1]。明胶既保留了胶原蛋白的一些识别序列,使其既有利于细胞粘附、分化和生长,又表现出比胶原蛋白低的抗原性[2],使得明胶成为理想的组织工程原材料。明胶水凝胶因其多孔的三维网状结构,含有大量的水分,而与细胞外基质(ECM)结构相似,使得明胶水凝胶具有优异的生物相容性。然而,纯明胶水凝胶的力学性能很差,体温和液体环境下易溶于水,限制了其应用范围。
通过交联作用可以提高明胶水凝胶的力学性能,降低溶胀率,增加降解时间,得到符合组织工程要求的生物材料。交联剂的选择很重要,明胶常用的交联剂为戊二醛[3-4]、甲醛[5]、EDC(碳化二亚胺)[6]与京尼平[7]等。但是醛类有较强的毒性,其中戊二醛交联明胶的细胞毒性为4级,而且易导致组织硬化、钙化[8],EDC和京尼平是近年来开始使用的交联剂,价格比较昂贵。据报道,制备丝素凝胶材料采用的环氧化合物交联剂聚乙二醇二缩水甘油醚(PGDE)的毒性远远低于戊二醛,在医用的合格范围内[9],且材料柔韧性良好[10]。Moonsri等[11]采用PGDE作为交联剂得到了力学性能良好的丝素膜。至今,未见关于PGDE交联明胶水凝胶的文献报道。本课题采用PGDE作为交联剂,制备了化学交联明胶水凝胶,并对其凝胶时间、力学性能、溶胀性能、分子交联结构和生物相容性进行了测试和表征,为环氧化合物交联明胶水凝胶的深入研究提供一定的理论依据。
1 实验材料与方法
1.1实验材料
明胶,化学纯CP,国药集团化学试剂有限公司。氯化钠,分析纯AR,上海凌峰化学试剂有限公司。聚乙二醇二缩水甘油醚(PGDE,分子量526 g/mol),美国Aldrich公司。其他所有化学试剂均为分析纯AR。
1.2水凝胶的制备
称取一定量的明胶,在50℃下溶解在蒸馏水中。然后向明胶水溶液中加入适量的PGDE、质量分数为2%的催化剂NaCl, 充分混合均匀,密封后快速放入60℃环境使其凝胶。制备方案如表1所示。

表1 水凝胶试验方案设计(表中水凝胶试样代号为G/P-[明胶%(w/w)]/[PGDE%(w/w)])Tab.1 Experimental design of hydrogel
1.3水凝胶的性能表征
1.3.1 凝胶时间
凝胶时间的测定以倾斜溶液90℃,没有液体流出,且液面平整为准。
1.3.2 分子结构表征
为了确定水凝胶内部交联位点,水凝胶样品在Nicolet 6700上进行了傅里叶变换红外光谱分析,波长范围4 000~400 cm-1,采用ATR法进行制样。样品处理过程如下:凝胶之后的样品先在蒸馏水中浸泡72 h,每12 h换一次水,以除去未反应物[12-13]。然后在-20℃预冷24 h,再真空冷冻干燥48 h得到干燥的样品。
1.3.3 溶胀行为
水凝胶的溶胀性采用称重法进行表征。首先,水凝胶样品放在磷酸盐缓冲液PBS(pH=7.4),37±1℃环境下放置24 h,然后把样品从PBS中取出,用滤纸吸干表面的水分后称重。样品在-20℃预冷24 h,真空冷冻干燥48 h后称取干重。溶胀率采用公式(1)进行计算:

(1)
式中W、W0分别为溶胀平衡的质量(g)和冷冻干燥之后的质量(g)。
1.3.4 力学性能
采用LLY-06D型人体内生物管道压缩弹性测试仪进行水凝胶的力学性能测试。力学测试之前,水凝胶在PBS中浸泡24 h溶胀平衡,然后用手术刀切成一定的尺寸(10 mm×10 mm×6 mm)。具体测试步骤如下:(1)将试样放在试样台上,试样厚度记为L0;(2)以10 mm/min的速度对试样进行压缩,至试样厚度的90%,持续压缩10 s,记录最大压缩强力及伸长值;(3)以10 mm/min的速度移除压力,记录外力完全移除后试样的厚度,记为L;(4)每个样品测试三次,压缩应力-应变曲线通过计算得到,其中测试头直径为5 mm,压缩正切模量Etan选取20~30%应变处的模量值[7],弹性回复率R采用式(2)进行计算:

(2)
1.3.5 溶血试验
凝胶的溶血试验根据GB/T 16886[14]、ISO 10993[15]和相关文献报道[16]的方法进行。阳性对照采用蒸馏水,阴性对照采用生理盐水。首先,分别向试样组和阴性对照组每个离心管中各加入生理盐水10 mL,同时向阳性对照组每个离心管中加入蒸馏水10 mL,然后分别向试样组每个离心管中加入水凝胶0.25 g。全部离心管浸入37℃水浴锅平衡30 min。用移液枪取抗凝全血(人静脉血+K2-EDTA) 2 mL,加入2.5 mL生理盐水,轻轻摇晃均匀,得到稀释的抗凝全血。向所有管子加入0.2 mL稀释的抗凝全血,轻轻摇匀后放入37℃水浴锅继续保温60 min。所有管子离心10 min(1000 r/min)。最后吸取上清液于比色皿中,分光光度计在545 nm处测吸光度值A。溶血率采用下面公式进行计算:

(3)
2 实验结果与讨论
2.1凝胶时间
明胶浓度和PGDE浓度与形成凝胶所需时间的关系,见图1。从图1可以看出,随着明胶浓度的增大,凝胶时间缩短。同样随着PGDE浓度的增大,凝胶时间也明显缩短。8% PGDE与4% PGDE对比,随着明胶浓度的增大,前者凝胶时间缩短更快(图中拟合方程中,8% PGDE斜率更大)。这可能是由于高浓度的明胶为PGDE提供了更多的交联位点,使得交联反应进行的更加顺利。这比丝素溶液与PGDE的交联反应[10]快得多。此外,明胶溶液不加任何交联剂,在29℃[7]以下都可以发生明胶分子之间的物理交联,在4℃静置十几分钟即可完全反应。但是一旦温度超过29℃便又溶解成水溶液。

图1 明胶和交联剂浓度对凝胶时间的影响 Fig.1 Influence of gelatin and crosslinking agent concentration on gelling time
2.2FT-IR
红外光谱图通过反映分子内部的基团振动,从而得知分子链构成。如图2所示,PGDE(c)在1108 cm-1出现烷醚键-CH2-O-CH2-不对称伸缩振动所产生的特征吸收峰,对比明胶(a),可知交联水凝胶(b)新增了此特征吸收峰,证明PGDE与明胶发生了化学反应,结合到了明胶分子上。PGDE在2869 cm-1、912 cm-1和856 cm-1处,出现环醚的特征吸收,交联明胶水凝胶(b)没有此特征峰,说明PGDE以两端开环的形式交联到了明胶分子中。另外,此处的交联明胶水凝胶,事先用蒸馏水浸泡72 h以去除多余的PGDE,此处交联水凝胶没有出现PGDE两端环醚的特征吸收峰,说明未反应的交联剂可以通过浸洗去除。比较图2明胶(a)和交联水凝胶(b),在 1 635 cm-1和1 645 cm-1处均出现酰胺Ⅰ的特征吸收, 1 548 cm-1处均出现酰胺Ⅱ的特征吸收峰,说明明胶与PGDE发生化学交联之后,仍保留其酰胺结构。
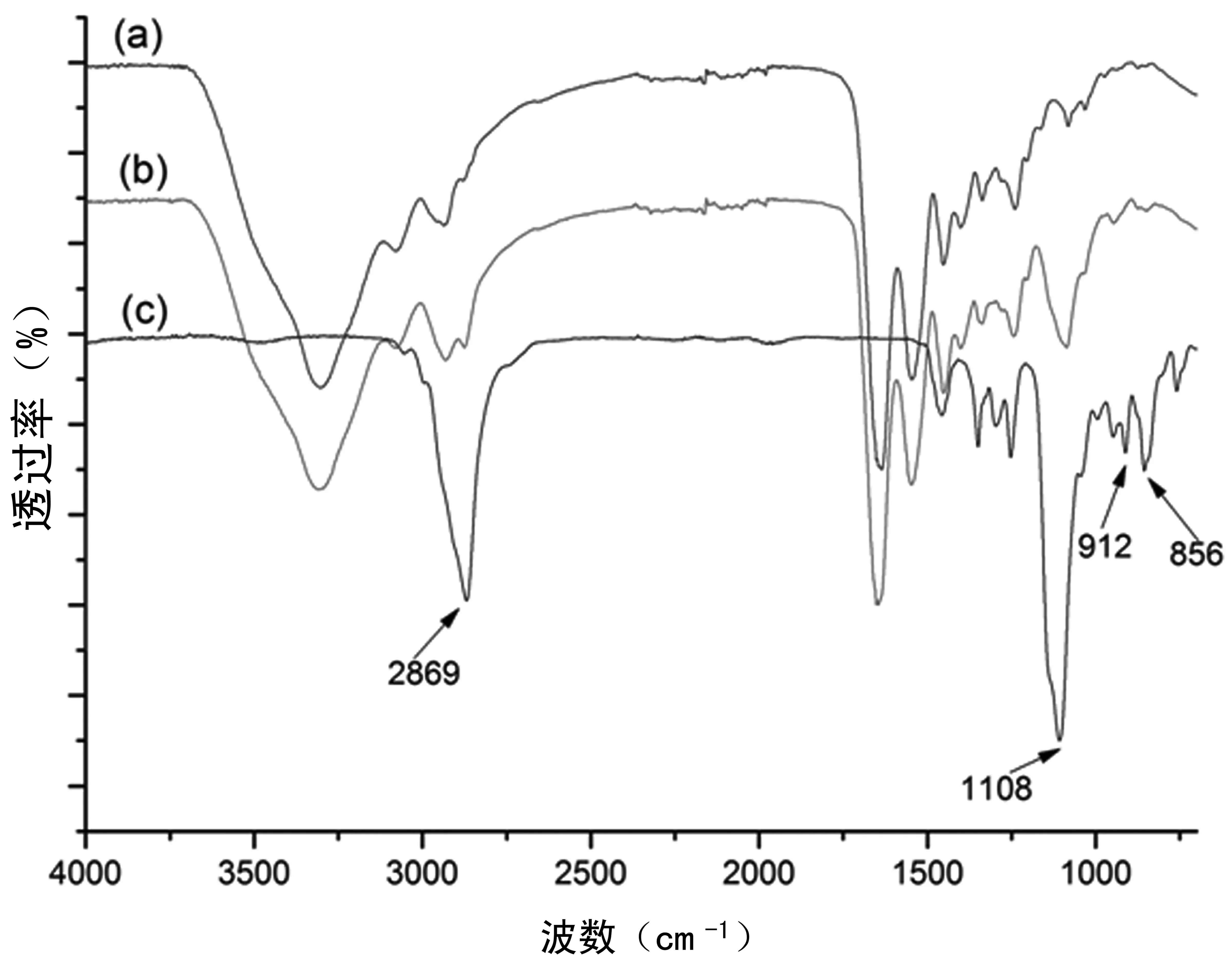
图2 红外光谱图(a)明胶 (b)交联水凝胶(G/P-8/8) (c)PGDEFig.2 FT-IR spectra of (a)gelatin (b)cross-linked hydrogel(G/P-8/8) (c)PGDE
2.3溶胀率
水凝胶的高溶胀度有利于细胞的粘附、生长,可防止体液和营养物质的流失[17]。从图3中可以看出,随着明胶浓度的增大,水凝胶的溶胀率下降。PGDE浓度为8%时,当明胶浓度从8%增加到16%时,其溶胀率从1 218.19%下降为778.17%。这一方面是因为随着明胶浓度的增大,分子内部物理交联增多,结构更紧密,阻碍了水分子的渗透。另一方面,更多的明胶分子提供了更多的基团参与交联反应,增大了水凝胶的交联度,使得结构更加致密[18]。
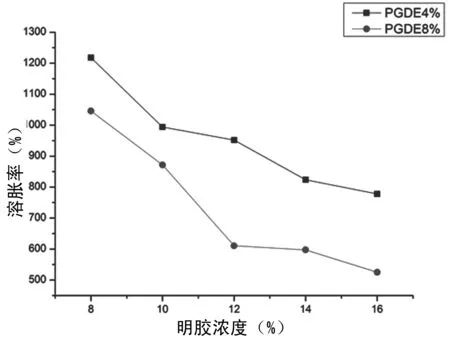
图3 明胶和交联剂浓度对水凝胶试样溶胀率的影响Fig.3 Influence of gelatin and crosslinking agent concentration on swelling ratio of hydrogel sample
比较图3中两条曲线可以发现,随着交联剂浓度的增大,溶胀率下降,这与文献报道一致[7]。说明交联反应使得明胶水凝胶的结构更加致密了。水凝胶的溶胀率与交联密度、渗水率、孔隙尺寸有直接关系[19]。改善水凝胶的溶胀行为能够影响其孔隙尺寸和力学性能[20]。
2.4力学性能
化学交联明胶水凝胶的压缩应力-应变曲线如图4所示,从图4可以看到,凝胶有优异的回弹性。具体压缩指标如表2所示,随着交联剂浓度的增大,水凝胶的正切模量Etan增大,与文献报道相符[7]。这可以解释为高浓度的交联剂提供了更多的交联位点,使得水凝胶内部交联密度增大,即水凝胶刚性增加。不难发现,随着交联剂浓度的增大,最大压缩应力σmax显著增大,原因可能是随着PGDE浓度的增大,交联位点增多,交联密度增大,需要更大的力才可以变形到设定值。此外可以看到,随着明胶浓度的增大,压缩正切模量Etan增大,最大压缩应力σmax也增大,这是因为明胶浓度的增大,使得水凝胶整体密度增大, 高聚物缠结更加紧密,结构更加致密,水凝胶更加坚韧,不易变形。PGDE交联明胶水凝胶的σmax值与京尼平[7]交联明胶水凝胶、EDC[17]交联明胶水凝胶在相同的数量级内。可以看到随着明胶和PGDE浓度的增大,水凝胶的最大压缩应力σmax显著增大,从27.64 kPa增大到113.20 kPa,压缩正切模量Etan也从0.19 kPa增大到0.59 kPa,这和水凝胶溶胀行为的结果相吻合,即明胶和PGDE浓度越高,结构越致密,水分子越不易渗入,溶胀率越低,水凝胶强力越高。明胶水凝胶的弹性回复率R相当高,最高可达98.03%,这可能跟交联明胶水凝胶有相当致密的均匀多孔结构有关。

图4 压缩应力-应变曲线(图中水凝胶试样为G/P-16/8)Fig.4 Compressive stress-strain curves (obtained for sample G/P-16/8)

表2 明胶水凝胶试样的力学性能Tab.2 Mechanical properties of gelatin hydrogel sample
2.5血液相容性
溶血实验是血液相容性的主要评价方法。溶血率的测定是通过检测材料与血液直接接触过程中,红细胞破裂所释放血红蛋白及红细胞素的量,来表征材料的体外溶血程度。材料的溶血率高,说明对红细胞的破坏程度大。溶血率小于5%,符合医用材料的溶血率试验要求。G/P-12/4试样的溶血试验结果如表3所示,由表中数据可知凝胶的溶血率1.209 4%小于5%,符合医用材料的溶血率试验要求。

表3 溶血率测试结果Tab.3 Results of hemolysis test
3 结论
本课题研究显示环氧化合物PGDE能够成功地交联明胶,且未反应的交联剂可以通过浸洗去除,排除凝胶上残留PGDE对生物相容性的不良影响。本研究制得的水凝胶,具有优异的弹性回复性,且随着明胶和交联剂浓度的增大,水凝胶结构更加致密,水分子不易渗入,溶胀率减小,最大压缩应力增大,因此我们可以通过适当调整明胶和PGDE的浓度来获得力学性能良好的水凝胶材料。材料的血液相容性良好,可以预测其具有良好的生物性能。在提高其力学性能的同时,仍保留了良好的生物相容性,PGDE交联明胶水凝胶有望成为理想的组织工程材料。
[1] Wenqian Xiao, Wenlong Liu, Jing Sun, et al. Ultrasonication and genipin cross-linking to prepare novel silk fibroin-gelatin composite hydrogel[J]. Bioactive and Compatible Polymers, 2012, 27(4): 327-341.
[2] Wen Zhao, Xing Jin, Yang Cong, et al. Degradable natural polymer hydrogels for articular cartilage tissue engineering[J]. J Chem Technol Biotechnol, 2013, 88: 327-339.
[3] 刘根起, 赵晓鹏, 唐韬. 明胶水凝胶电刺激响应行为的研究[J]. 高分子学报, 2003, 3: 398-402.
[4] Cristina MA Lopes, Maria I Felisberti. Mechanical behaviour and biocompatibility of poly(1-vinyl-2-pyrrolidinone)-gelatin IPN hydrogels[J]. Biomaterials, 2003, 24: 1279-1284.
[5] 王映红, 程树军, 慕朝伟, 等. 明胶膜的制备及其交联性能的研究[J]. 功能高分子学报, 2003, 16(1): 36-40.
[6] Ofner and Bubnis. Chemical and swelling evaluation of amino group crosslinking in gelatin and modified gelatin matrices [J]. Pharmaceutical research, 1996, 13(12): 1821-1827.
[7] Damian M Kirchmajer, Clare A Watson, Marie Ranson, et al. Gelapin, a degradable genipin cross-linked gelatin hydrogel [J]. RSC Adv 2013, 3: 1073-1081.
[8] 金勋杰, 杨显生, 姬烨, 等. 蛋白交联剂京尼平与戊二醛的生物学特性比较[J]. 中国临床康复, 2006, 10(25): 60-62.
[9] 田莉, 陈宇, 闵思佳. 环氧化合物制备丝素凝胶材料的细胞毒性研究[J]. 生物医学工程学杂志, 2007, 24(6): 1309-1313.
[10] 闵思佳, 陈芳芳, 吴豪翔. 环氧化合物与丝素蛋白化学交联凝胶的结构[J]. 高等学校化学学报, 2005, 26(5): 964-967.
[11] Piyarut Moonsri, Ruangsri Watanesk, Surasak Watanesk, et al. Fibroin membrane preparation and stabilization by polyethylene glycol diglycidyl ether [J]. Applied polymer science, 2008, 108: 1402-1406.
[12] 陈芳芳, 闵思佳, 田莉. 交联丝素凝胶制备条件的分析[J]. 纺织学报, 2006, 27(10): 1-5.
[13] Nicole J Einerson, Kelly R Stevens, Weiyuan John Kao. Synthesis and physicochemical analysis of gelatin-based hydrogels for drug carrier matrices[J]. Biomaterials, 2002, 24: 509-523.
[14] GB/T16886-2003. 医疗器械生物学评价[S].
[15] ISO 10993-2009. Biological evaluation of medical devices[S].
[16] Zhou Huiyun, Zhang Yanping, Zhang Weifen, et al. Biocompatibility and characteristics of injectable chitosan-based thermosensitive hydrogel for drug delivery[J]. Carbohydrate polymers, 2011, 83: 1643-1651.
[17] 杨中民, 周智华, 孔令臣. 明胶/透明质酸复合支架材料的制备与性能[J]. 粉末冶金材料科学与工程, 2012, 17(6): 810-817.
[18] Simone S Silva, Antonella Motta, Marcia T Rodrigues, et al. Novel genipin-cross-linked chitosan/silk fibroin sponges for cartilage engineering strategies[J]. Biomacromolecules, 2008, 9: 2764-2774.
[19] Shapiro and Oyen. Hydrogel composite materials for tissue engineering scaffolds[J]. JOM, 2013, 65(4): 505-516.
[20] Nicholas A Peppas, J Zach Hilt, Ali Khademhosseini, et al. Hydrogels in biology and medicine: from molecular principles to bionanotechnology [J]. Adv Mater, 2006, 18: 1345-1360.
PreparationandCharacterizationofGelatinHydrogelwithEpoxideasCrosslinkingAgent
Chen Xiaohui, Guan Guoping, Wang Lu*
Key Laboratory of Textile Science & Technology, Ministry of Education, Donghua University, (Shanghai, 201620)
Gelatin hydrogel is a promising tissue engineering material due to its good biocompatibility. In this study, several components of gelatin hydrogels were prepared with certain concentrations of gelatin and cross-linking agent epoxide polyethylene glycol diglycidyl ether (PGDE). FT-IR spectrum showed that PGDE was induced onto gelatin chains by opening the rings on both sides. As the concentrations of gelatin and cross-linking agent increased, swelling ratio of hydrogel declined from 1 218.19% to 525.23%, compressive stress at failure increased significantly from 27.64 kPa to 113.20 kPa,compressive tangent modulus also increased from 0.19 kPa to 0.59 kPa., indicating the mechanical properties were improved obviously. The PGDE cross-linked gelatin hydrogel had excellent elastic resilience, the highest elastic recovery was 98.03%. And that the hydrogel also has good blood compatibility, as indicated in the hemolysis test.
gelatin, hydrogel, polyethylene glycol diglycidyl ether(PGDE), chemical cross-linking
10.3969/j.issn.1674-1242.2014.01.004
国家自然科学基金项目(51003014)
陈肖会,硕士研究生,研究方向:天然蛋白质水凝胶
王璐, E-mail: wanglu@dhu.edu.cn
R318
A
1674-1242(2014)01-0018-05
2013-11-11)
