李果实发育过程中糖含量变化与糖代谢相关酶的关系
2014-09-14李金龙马光恕
李金龙,马光恕
(1.黑龙江省八一农垦大学,黑龙江大庆163319;2.黑龙江省农科院园艺分院,哈尔滨150069)
果实生长过程中,糖的积累影响着果实品质的形成。李子中存在的糖以蔗糖、葡萄糖、果糖为主,不同的含量构成了不同的风味。影响糖代谢酶有蔗糖磷酸合成酶(suerose phosphate synthase,SPS)、蔗糖合成酶(sucrose synthase,SS)和转化酶(Invertase,Ivr).在香蕉[1]、梨[2]、苹果[3]、番茄,葡萄[4]中,已经报道了果实品质与糖代谢的相关研究,但是在李子中,相关的报道却未曾发现。所以,本实验以黑龙江本地品种‘龙园蜜李’为研究对象,通过对其果实发育过程中糖积累与糖代谢相关酶的关系,探索李果实糖积累机理,及其糖代谢相关酶的变化规律,为以后深入研究提高李果实品质,提供理论依据。
1 材料和方法
1.1 实验材料
采自黑龙江省农院园艺分院核果研究室,品种名为‘龙园蜜李’,花期为5月2~7日。选取果实生长过程中比较有代表性的五个时期,进行采摘,分别为:坐果初期(5月18日)、生理落果期(6月2日)、果实着色器(8月9日)、果实成熟期(8月17日)、果实过熟期(8月31日),选择树体健康,且树龄一致的果树,采用随机选取的方式,每次采果20个。采后果实迅速放于液氮中速冻,装袋标记后存放于-30℃的冰箱中保存。
1.2 试验方法
1.2.1 果实中葡萄糖、果糖、蔗糖含量的测定
葡萄糖、果糖、蔗糖含量的测定采用张志良等编写的分光光度计法[5]。将样品先置于110℃烘箱烘15min,然后调制70℃过夜。秤取50mg样品倒入10mL刻度离心管内加入4mL的 80%乙醇,至于80℃水浴中不断搅拌40min,离心,收集上清液,其残渣加2mL 80%乙醇重复提2次,合并上清液。在上清液中加入10mg活性炭,80℃脱色30min,80%乙醇定容至10mL,过滤后取滤液按照标准曲线制备方法,在480nm下测定吸光度,计算糖含量。
1.2.2 果实中蔗糖合成酶、蔗糖磷酸合成酶和转化酶活性的测定
蔗糖合成酶、蔗糖磷酸合成酶和转化酶活性的测定均采用高俊凤等编写的分光光度计法[6]。蔗糖合成酶活性的测定:取3支10mL具塞试管,加入0.4mL酶反应液,0.1mL UDPG和0.05mL透析后的酶液,补水至1mL,于30℃水浴中反应10min后,沸水浴3min中止反应,对照用蒸馏水代替UDPG。蔗糖磷酸合成酶的测定:在酶反应液中用10mol/L果糖-6-磷酸代替果糖,其余均按蔗糖合成酶的方法测定。蔗糖合成酶、蔗糖磷酸合成酶活力单位均为mg蔗糖·FW-1·L-1。
酶活力(mg蔗糖·FW-1·L-1)=C·Vt·n·FW-1·t-1·Vs-1
式中:C是从标准曲线查得的蔗糖量(mg);FW是样品鲜重(g);t是反应时间(h);Vt是提取酶液总体积(mL);Vs是测定时取用酶液体积(mL);n是提取液测定中的稀释倍数。
转化酶的测定:取3支5 mL具有试管,加入0.95 mL反应液和50·L 透析后的酶液,30℃水浴中反应10 min中止反应。用煮死酶液作对照(煮沸10min)。往各反应试管中再加3,5-二硝基水杨酸试剂1 mL,沸水浴5 min,冷却至室温,于540nm比色测定生成的还原糖量。酶活力以mg 葡萄糖·FW-1·h-1表示。
酶活力(mg 葡萄糖·FW-1·h-1)= C·Vt·n·FW-1·t-1·Vs-1
式中:C表示从标准曲线查得的葡萄糖量(mg);FW表示组织鲜重(g);t表示反应时间(h);Vt表示提取酶液的总体积(mL);Vs表示测定时取用酶液体积(mL);n表示提取液测定中的稀释倍数。
2 结果与分析
2.1 果实发育中糖含量的变化
从图1发现,在坐果初期,果实内糖含量都维持在一个较低水平,葡萄糖含量略高于果糖和蔗糖,随着果实的生长发育,进入着色期后,果实内糖含量迅速增加,且蔗糖含量增长速度最快,明显高于葡萄糖和果糖,到达成熟期时,果实内蔗糖含量达到最高值4.34%,过熟后,蔗糖含量略有下降。果糖的含量在坐果初期略低于葡萄糖,进入着色期后,果糖含量高于葡萄糖。果实发育过程中,葡萄糖含量最低,蔗糖是李果实积累量最高的糖类。
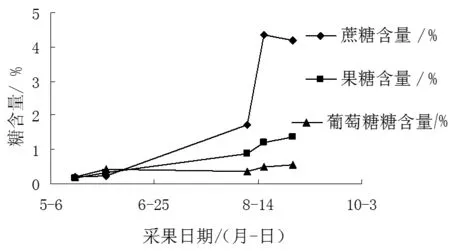
图1 糖含量变化
2.2 果实中糖积累相关酶的变化
2.2.1 蔗糖转化酶

图2 lvr酶活性变化趋势
从图2发现,蔗糖转化酶是影响果实糖积累的重要酶之一[3]。坐果初期,蔗糖转化酶活性最高,为0.44 mg葡萄糖/ h ·FW。随着果实的生长,转化酶活性呈现下降趋势,进入着色期后,下降趋势最明显,进入成熟期后,转化酶活性变化为0.066 mg葡萄糖/ h·FW,过熟期转化酶活性略有下降。
2.2.2 蔗糖合成酶和蔗糖磷酸合成酶

图3 SS酶和SPS酶活性变化趋势
从图3中发现,蔗糖合成酶和蔗糖磷酸合成酶在坐果初期,活性较低,仅为0.40 mg蔗糖/ h ·FW和0.20 mg蔗糖/ h·FW,随着果实的发育,蔗糖合成酶含量增长速度较快,达到最大值0.67 mg蔗糖/ h ·FW,而蔗糖磷酸合成酶在果实发育过程中活性变化不明显,后期略有增加,为0.174 mg蔗糖/ h ·FW。
2.3 果实中糖的含量与糖代谢酶的相关性分析

表1 ‘龙园蜜李’果实内糖含量与其相关代谢酶活性的相关性
由表1可以看出,李果实中的糖积累量和蔗糖代谢的酶存在一定的相关性,蔗糖的含量与转化酶成显著负相关性,与蔗糖合成酶、蔗糖磷酸合成酶分别呈现极显著正相关性和显著正相关性;果糖含量和转化酶呈现显著正相关性,说明李果实生长过程中,蔗糖的积累主要由蔗糖磷酸合成酶和蔗糖合成酶共同完成。
3 讨论
本实验通过对李子生长发育过程中的研究发现,果实坐果初期,蔗糖积累含量低,转化酶活性占主导,活性旺盛,这与在菠萝[7]、甜瓜[8]等水果中的变化趋势相一致。随着果实进入着色期,转化酶活性迅速下降,蔗糖合成酶活性显著提高,蔗糖磷酸合成酶活性变化不明显,但蔗糖积累量迅速增加,成为果实内含量最高的糖,表明李子属于蔗糖积累型水果。在对香蕉[9]、芒果[10]等水果的研究调查中发现,蔗糖磷酸合成酶活性要高于蔗糖合成酶,蔗糖合成以蔗糖磷酸合成酶为主。从相关性分析上可以看出,李子糖积累与蔗糖合成酶和蔗糖磷酸合成酶活性分别呈现极显著和显著性,而与转化酶活性呈现负相关,说明这些酶是影响李果实糖积累的关建酶。
[1]袁扬静,胡玉林,谢江辉.温度对采后香蕉果实糖代谢及其酶活性的影响[J].热带作物学报,2011,32(1):66-71.
[2]宋晓晖.不同有机肥对李果实和叶片糖代谢影响的研究[D].南京:南京农业大学,2012.
[3]郭燕.几个苹果品种果实糖酸积累及糖代谢相关酶活性变化研究[D].杨凌:西北农林科技大学,2012.
[4]谢周,孙兴民,张萌,等.根域限制对‘宝满’葡萄光合特性及糖代谢的影响[J].中国农学通报,2012,28(22):190-197.
[5]张志良.植物生理学实验指导[M].北京:高等教育出版社,2009.
[6]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[7]祖鹤.鲜切菠萝加工保鲜关键技术研究[D].海口:海南大学,2010.
[8]李天来,李骥尧,刘轶飞.硝酸钙对嫁接网纹甜瓜果实糖含量及糖代谢相关酶活性的影响[J].中国蔬菜,2011,7(14):15-23.
[9]匡云波.香蕉叶片糖代谢若干关键酶基因的克隆及其在低温胁迫下的表达研究[D].福州:福建农林大学,2012.
[10]魏长宾, 武红霞,马蔚红,等.芒果成熟阶段蔗糖代谢及其相关酶类研究[J].西南农业学报,2008,21(4):972-975.
