DC-CIK生物免疫治疗联合放疗在肝癌治疗中的临床效果
2014-09-13朱珍英竺顺斌孙春华
朱珍英 竺顺斌 陈 刚 鲍 晋 张 秦 孙春华
我国是肝癌的高发国家,且原发性肝癌起病隐匿,确诊时多已发展到晚期阶段,手术治疗较为困难[1]。临床上多采用肝动脉栓塞化疗、放疗等治疗肝癌,但研究发现,肝癌细胞对射线具有一定的抵抗性,部分患者的放疗效果不理想[2]。随着免疫学分子和细胞生物学的发展,树突状细胞-细胞因子诱导的杀伤细胞(dendritic cell-cytokine-induced killers,DC-CIK)生物免疫治疗成为了肿瘤治疗的重要辅助手段[3]。本研究选取78例患者作为研究对象,观察DC-CIK生物免疫治疗联合放疗治疗不同类型肝癌的临床疗效。
1 资料与方法
1.1 一般资料
选取2012年2月到2014年2月我院收治的78例患者作为研究对象,其中男性54例,女性24例,年龄46~74岁,平均(61.8±11.4)岁;78例患者中52 例有肝硬化,9例合并有门静脉高压,其他患者无合并症状。将患者随机分为2组,对照组39例,其中男性28例,女性11例,年龄49~72岁,平均(60.8±10.9)岁,其中26例患者合并肝硬化,5例合并有门静脉高压;观察组39例,其中男性26例,女性13例,年龄46~74岁,平均(62.6±11.3)岁,其中26例患者合并肝硬化,4例合并有门静脉高压。2组患者的性别、年龄和病情无统计学差异(P>0.05),具有可比性。
1.2 病例纳入标准
78例患者均符合以下标准:①患者的临床分期为Ⅲ期或Ⅳ期,为晚期肝癌;患者预计生存期≥3个月。②患者存在手术禁忌证或患者及家属不愿接受手术,患者接受放射治疗前未接受化疗手术等其他治疗方法。③患者无严重的血液系统疾病,骨髓造血功能无异常。④所有患者在知情的前提下自愿参与本次研究,符合医学伦理学原则。
1.3 治疗方法
1.3.1 放疗 2组患者均接受放射治疗,采用电子直线加速器进行全肝移动照射,放射剂量为30~50 Gy,每周为一疗程。
1.3.2 DC-CIK生物免疫治疗 观察组在放疗的基础上联合DC-CIK生物免疫治疗。DC-CIK生物免疫治疗方法如下:①自体DC-CIK细胞的制备。CD细胞培养:抽取患者的外周血,使用血细胞分离机分离单核细胞,使用Ficoll 淋巴细胞分离液进一步分离淋巴细胞。洗涤分离的细胞,使用BIN无血清培养基制备细胞悬液,置于5%的CO2孵育箱孵育2 h。将细胞悬液移除后加入500 U/L的IL-4和1 000 U/mL的GM-CSF,继续培养2~3 d后换液1次,第6天加入500 U/mL的TNF-α。CIK 细胞培养:分离淋巴细胞后加入1 000 U/mL的重组人IFN-γ和含有10%AB型人血清的PMI-1640培养液,孵育24 h后更换成含100 ng/mL小鼠抗人CD3单克隆抗体、1 000 U/mL的 IL-1 和IL-2 的RPMI-1640完全培养液继续培养2 d后换含IL-2的完全培养液隔日换液维持培养。将培养到第7天的DC和CIK细胞按1∶5混合,制备DC-CIK细胞悬液。②DC-CIK细胞回输:静脉回输5×109个/L的DC-CIK 细胞,每4次为1个疗程,患者根据病情进行3~8个疗程的治疗。
1.4 观察指标
比较2种方法的临床治疗效果,观察患者治疗前后的免疫功能和生活质量,观察2组患者的不良反应的发生情况。①患者的临床治疗效果评价:按照RECIST 实体瘤近期疗效评价标准[4]评价肿瘤的治疗效果,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),总有效率=(CR+PR+SD)/总病例数。同时,每半年对患者进行一次电话随访,持续3年,记录患者的生存期。②患者的免疫功能评价:治疗前后分别抽取患者的外周血并提取单核细胞,使用流式细胞仪分析患者T细胞亚群、调节性T细胞及NK细胞变化,评价患者的免疫功能的变化。③患者的生活质量评价:患者生活质量评价采用KPS[5]评分,比较患者治疗前后的生活质量的变化。④患者不良反应的发生:观察患者有无出现肝肾功能的损害等严重并发症,其他并发症包括恶心呕吐、发热和乏力等。
1.5 统计学处理

2 结果
2.1 2种方法的临床治疗效果评价
2组患者RECIST 实体瘤近期疗效评价结果具有统计学差异(Z=11.82,P<0.05),观察组患者的治疗总有效率为80.05%,明显高于对照组的56.41%(χ2=6.02,P<0.05);2组患者的生存随访结果具有统计学差异(Z=15.32,P<0.05),观察组患者平均生存期为(23.8±7.4)个月,治疗组为(14.9±3.3)个月,差异具有统计学意义(t=6.88,P<0.05)。见表1。
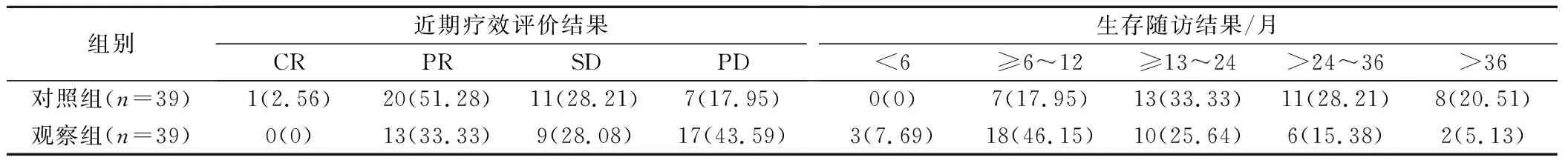
表1 2种方法的临床治疗效果评价(例,%)
2.2 患者治疗前后的免疫功能和生活质量情况
经过治疗后,2组患者的KPS评分较治疗前明显好转(P<0.05),观察组患者治疗后的免疫功能较治疗前明显好转,具有统计学差异(P<0.05)。治疗后观察组患者的免疫功能和KPS评分明显高于对照组(P<0.05)。见表2。

表2 患者治疗前后的免疫功能和生活质量
注:*为与对照组比较,P<0.05;#为与治疗前比较,P<0.05。
2.3 2组患者的不良反应的发生情况
2组患者均未发生严重的肝肾功能损害,部分患者出现较轻微的不良反应:观察组5例(12.82%)患者出现不良反应,其中恶心呕吐1例,发热3例,乏力1例;对照组4例(10.26%)患者出现不良反应,其中发热1例,乏力3例。2组患者的不良反应发生率无统计学差异(χ2=0.00,P>0.05)。
3 讨论
研究表明,放疗可以有效减少肝癌的肿瘤面积,改善患者预后,但由于肝癌细胞对放射线具有一定的抵抗作用,单纯放疗在肝癌治疗中的效果并不理想[6]。随着免疫学和细胞生物学的发展,DC-CIK生物免疫治疗作为肿瘤的一种新型的肿瘤辅助治疗的手段,受到了广泛的关注。
本研究发现,观察组患者的肿瘤控制效果、生存期和生活质量均明显高于对照组,DC-CIK生物免疫治疗联合放疗在肝癌的治疗中疗效较为显著。这一结果与钟国成等[7]的结果较为一致。此外,经过治疗后,观察组患者血中的CD3+和CD16+CD56+的T淋巴细胞明显增加,CD4+/CD8+升高,患者的机体免疫功能较治疗前明显好转。这一结果与DC-CIK生物免疫治疗的机制密切相关。DC细胞与CIK细胞共同培养可活化2个细胞群体,使IL-2和IFN-γ的表达和分泌明显升高。DC细胞分泌多种细胞因子可促进CIK细胞成熟,从而获得肿瘤杀伤活性更强的DC-CIK细胞。当DC-CIK细胞回输到患者体内后, CD3+CD56+的T细胞以MHC非限制机制杀伤杀灭体内肝癌细胞,而部分CD3+CD8+的T细胞和CD3+CD4+的T细胞则能特异性清除体内肿瘤细胞。同时成熟的DC细胞通过诱导T细胞的分化和活化NK细胞,可发挥免疫调节作用,增强患者的免疫力[8]。研究中,2组患者的不良反应发生率无明显差异,患者均未发生严重的不良反应。观察组不良反应以发热为主,经过对症治疗后均明显减轻。故联合治疗并不会明显增加患者的不良反应,较为安全。综上所述,DC-CIK生物免疫治疗联合放疗治疗肝癌的临床疗效较为显著,患者不良反应发生率较低,值得推广应用。
[1] 汤钊猷.提高肝癌疗效的我见〔J〕.中华肝胆外科杂志,2010,16(8):561-562.
[2] 刘红丹.三维适形放疗在治疗原发性肝癌中的研究进展〔J〕.实用癌症杂志,2013,28(1):103-104.
[3] 王广伟,顾元龙,刘敏丰,等.负载自身肿瘤裂解物的树突状细胞联合杀伤细胞对肝癌患者术后免疫功能的影响〔J〕.中华普通外科杂志,2012,27(4):337-338.
[4] Jang GS,Kim MJ,Ha H,et al.Comparison of RECIST version 1.0 and 1.1 in assessment of tumor response by computed tomography in advanced gastric cancer〔J〕.Chin J Cancer Res,2013,25(6):689-694.
[5] 郑 琳,郭晨阳,黎海亮,等.肝动脉化疗栓塞联合索拉非尼治疗原发性肝癌〔J〕.中华消化外科杂志,2013,12(3):236-237.
[6] 张江洲.肝癌放疗的应用进展〔J〕.实用癌症杂志,2013,28(2):215-217.
[7] 钟国成,张小玉,孙 薏,等.抗原致敏DC联合CIK在原发性肝癌治疗中的应用〔J〕.中国肿瘤临床,2009,36(24):1404-1408.
[8] 孟冉冉,张跃伟,赵广生,等.树突状细胞肿瘤疫苗抗肿瘤研究进展〔J〕.中华肿瘤防治杂志,2012,19(20):1597-1600.
