NF-κB及Rb蛋白在进展期胃癌中的表达及E-cadherin/catenin复合物在转移淋巴结中再表达的临床意义
2014-09-13张宇龙张国栓崔专义王桂琦
张宇龙 张国栓 崔专义 王桂琦
胃癌是我国最常见的恶性肿瘤之一,转移是其主要致死原因,淋巴结转移是影响预后的重要因素。上皮钙粘蛋白(E-cadherin)可介导同种亲和性的细胞间的黏附,其功能需要与其配体-连接素(catenin)结合成复合体才能起作用[1],其表达异常与人类恶性肿瘤的浸润、转移及肿瘤病人的预后密切相关[2]。NF-κB可在转录水平调控许多基因的表达,可调控细胞凋亡、增殖的相关基因。视网膜母细胞基因(Rb基因)是人体1种重要的肿瘤抑制基因,同时Rb蛋白又受多种因子在多种层次上的调控,使其功能与细胞生长、分化相适应[3]。本实验应用SP(生物素-链霉菌抗生物素蛋白-过氧化酶)免疫组化法检测了NF-κB、Rb及E-cadherin/catenin复合物在进展期胃癌及其相应转移淋巴结中的表达状况,探讨其与进展期胃癌临床病理因素、其相互之间及其与患者预后之间的关系。
1 材料与方法
1.1 标本来源
收集2005年3月-2008年6月在石家庄市第一医院外科手术切除并经病理组织学检查证实的进展期胃癌标本86例,男性70例,年龄30~79 岁,平均59.8岁;女性16例,年龄42 ~72 岁,平均年龄 59.2岁。其中71例获得随访。病理类型:黏液腺癌21例、管状腺癌57例、印戒细胞癌4例和腺鳞癌2例、未分化癌1例,鳞癌1例。其中高分化14例,中分化21例,低分化51例;侵及浆膜层78例,未侵及浆膜8例。入选病例均未接受过化疗或放疗,无长期服用非甾体类抗炎药、皮质激素药物史。
1.2 试剂
兔抗人多克隆NF-κB、α及β-catenin抗体购于NeoMarkers公司,鼠抗人单克隆E-cadherin抗体购于ZYMED公司,鼠抗人单克隆γ-catenin及兔抗人多克隆Rb抗体购于Santa Cruz公司,SP法试剂盒购于北京中杉公司。
1.3 方法
标本用10%甲醛固定,石蜡包埋,4 μm连续切片。采用免疫组织化学SP法,试剂盒使用按说明书进行操作。切片常规脱蜡入水,3%过氧化氢阻断内源性过氧化物酶,微波抗原修复,5%羊血清处理20 min,滴加NF-κB一抗4 ℃过夜,DAB(3,3-二氨基联苯氨)显色,苏木精复染;PBS代替一抗作为阴性对照,以每张切片上相对正常的黏膜作为阳性对照。
1.4 结果判定
E-cadherin/catenin复合物只有明显胞膜染色的细胞被判定为正常染色;如染色不连续,明显减弱或者缺失,或者出现胞质染色,则被评定为不正常染色。每张切片按照全部癌细胞中的正常染色细胞的百分率评定为三级:1级为0~50%;2级为51% ~ 80%;3级为81% ~100%[4]。对于原发灶,如被评定为3级,则被认为是E-cadherin/catenin复合物的正常表达,而1级和2级染色则被认为是E-cadherin/catenin复合物的不正常表达;对于转移淋巴结为3级而原发灶为1级或2级,或转移淋巴结为2级而其原发灶为1级,则被评定为E-cadherin/catenin复合物再表达阳性;否则为再表达阴性。
NF-κB显色阳性部位为胞质或胞核,阳性细胞百分数≤5%为0分,6% ~ 25%为1分,26% ~ 50%为2分,≥51%为3分;基本不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分,将两项积分相乘为最后得分,0 ~ 1分为阴性,≥2分为阳性。
Rb染色阳性信号为棕黄色,定位于细胞核和细胞质,背景清晰,间质无着色。每张切片由两名病理医师双盲观测计数200个肿瘤细胞,依据镜下阳性染色细胞占癌细胞总数的比例判定:阴性(-):无棕黄色染色或阳性细胞数<10%;弱阳性(+):阳性细胞数在10% ~25%;阳性(++):阳性细胞数在25% ~50%;强阳性(+++):阳性细胞数>50%。
1.5 统计学方法
应用SPSS 13.0统计软件包进行分析,对所得数据采用χ2检验以及需要校正的χ2检验分析差异,应用Sperman秩相关分析各指标表达的相关性,采用Wilcoxon’s log-rank test 对生存曲线进行组间差别检验,应用Cox’s proportional-hazard对影响生存率的变量进行多变量分析。检验标准α= 0.05。
2 结果
2.1 各指标在胃癌组织及转移淋巴结中表达情况
NF-κB蛋白在86例进展期胃癌组织中表达阳性率达81.40%,Rb蛋白在86例进展期胃癌组织中表达阳性率达65.12%。E-cadherin/catenin复合物在原发灶中只有1例正常表达,85例异常表达,异常表达率为98.84%,该复合物在转移淋巴结中再表达阳性率为63.95%(表1)。
2.2 NF-κB、Rb蛋白表达及E-cadherin/catenin复合物再表达与胃癌临床病理因素的关系
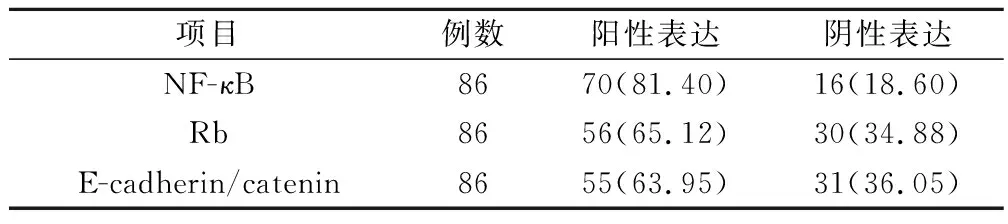
表1 NF-κB、Rb蛋白表达及E-cadherin/catenin复合物再表达(例,%)
NF-κB表达与胃癌病理类型(印戒细胞癌、未分化癌、磷癌及腺磷癌因样本含量过小,故未予统计)密切相关(P<0.05);NF-κB表达与肿瘤细胞分化程度密切相关(P<0.05);NF-κB表达与肿瘤大小及肿瘤浸润深度无关(P>0.05)。Rb蛋白表达与肿瘤细胞分化程度密切相关(P<0.05);Rb蛋白表达与胃癌病理类型、肿瘤大小及肿瘤浸润深度无关(P>0.05)。E-cadherin/catenin复合物在转移淋巴结中再表达与肿瘤细胞分化程度密切相关(P<0.05);与胃癌病理类型、肿瘤大小及肿瘤浸润深度无关(P>0.05)(表2)。
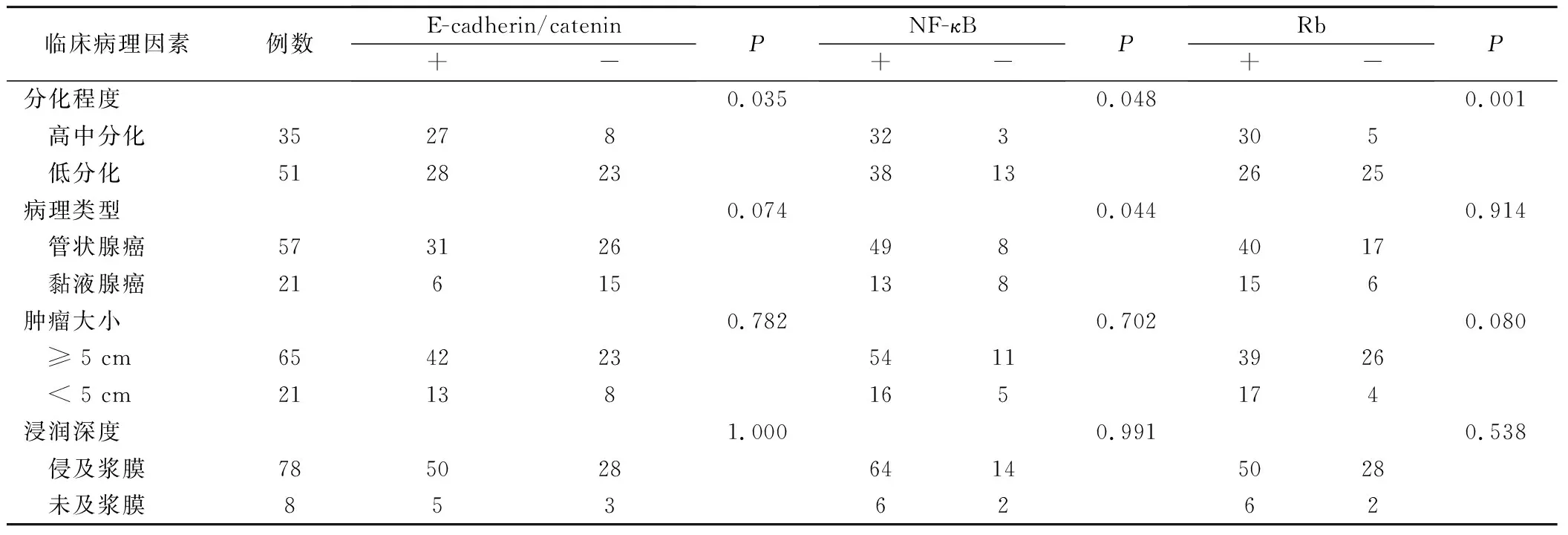
表2 NF-κB、Rb蛋白表达及E-cadherin/catenin复合物再表达与胃癌临床病理因素的关系/例
2.3 NF-κB、Rb蛋白表达及E-cadherin/catenin复合物再表达与患者预后的关系
Kaplan-Meier曲线显示NF-κB、Rb蛋白表达与患者预后无关,NF-κB表达阳性生存均数的95%可信区间为(32,43),中位生存时间为26个月,表达阴性生存均数的95%可信区间为(20,33),中位生存时间为27个月,表达阳性与阴性比较无显著性差异(P>0.05),Rb蛋白表达阳性生存均数的95%可信区间为(29,41),中位生存时间为25个月,表达阴性生存均数的95%可信区间为(28,44),中位生存时间为30个月,表达阳性与阴性比较无显著性差异(P>0.05);E-cadherin/catenin复合物在转移淋巴结内再表达情况与患者的预后密切相关,E-cadherin/catenin复合物再表达阳性生存均数的95%可信区间为(26,35),中位生存时间为25个月,表达阴性生存均数的95%可信区间为(37,61),中位生存时间为43个月,表达阳性与阴性比较差异显著(P<0.05)。应用Wilcoxon’s log-rank test对生存曲线进行组间差别检验,发现差别无显著统计学意义。
通过多变量分析发现,E-cadherin/catenin复合物及β-catenin在胃癌转移淋巴结内再表达可以作为独立的预后因素(P<0.05 )(表3)。

表3 NF-κB、Rb蛋白表达及E-cadherin/catenin复合物再表达的多变量分析
2.4 NF-κB、Rb蛋白表达与E-cadherin/catenin复合物再表达的相关性
Sperman秩相关分析显示NF-κB、Rb蛋白表达与E-cadherin/catenin复合物在转移淋巴结内癌细胞中再表达均无显著相关性。
3 讨论
NF-κB是1种多向性的核转录因子,可调控细胞凋亡、增殖的相关基因,可在转录水平调控许多基因的表达。近来的研究倾向于NF-κB可拮抗细胞凋亡,并在晚G1期抑制细胞周期的进程[5]。其表达已经成为诊断白血病、乳腺癌、卵巢癌和结肠癌的肿瘤的一项指标[6]。关于NF-κB在胃癌中的作用机制尚未明确,可能与NF-κB激活其下游基因C-myc的表达或在转录水平激活端粒酶逆转录酶(hTERT)[7]有关,已知C-myc蛋白表达异常增加可诱发恶性转化和肿瘤形成,有研究显示小鼠C-myc基因启动子上存在NF-κB的作用位点,并能在一定条件下被后者转录激活[8]。本研究显示,NF-κB蛋白在进展期胃癌中存在高表达,表明NF-κB蛋白的表达与胃癌的发生、发展可能存在密切关系。另有报道NF-κB蛋白与E-cadherin/catenin复合物中的β-catenin在胃癌肿瘤原发灶中的表达存在协同作用,但是本研究显示NF-κB蛋白与包括β-catenin在内的E-cadherin/catenin复合物在转移淋巴结内癌细胞中的再表达无相关关系,本研究结果显示NF-κB蛋白的表达与患者预后生存率无关。
Rb基因是经典的抗癌基因,Rb基因在正常情况下对细胞分裂起着重要的抑制作用,这种抑制作用的减弱将导致细胞发生异常增殖,最终发生癌变,不典型增生与胃癌中Rb蛋白表达率明显低于正常胃癌粘膜,提示Rb蛋白表达缺失与胃癌的发生密切相关。有实验证实,不是所有的Rb突变均可见测到Rb蛋白的缺失,相反可导致一种无功能的Rb蛋白,即突变型的Rb蛋白表达[9]。而有学者证实野生型Rb蛋白有抑制细胞增殖的功能,突变型Rb蛋白则失去抑制作用[10]。本研究显示,Rb蛋白在进展期胃癌原发灶中存在相对的高表达,Rb蛋白的表达与胃癌肿瘤细胞的分化程度密切相关,这与Rb基因做为一个经典的抑癌基因的作用是相符的。有学者认为Rb基因产物表达可作为辅助临床判断胃癌预后的生物学指标,但本研究显示Rb蛋白的表达与患者的预后生存率无显著关系,可能是由于生成了突变型Rb蛋白的影响。
细胞黏附功能的丧失不仅参与肿瘤的侵袭转移,而且使细胞间信息的交流受阻,肿瘤细胞丧失接触性生长抑制,可能在上皮细胞早期恶性转化、无限增殖、失去分化中起到重要作用[11-12]。而E-cadherin/catenin复合物与肿瘤的关系尤为引人注目。Jawhari等[13]研究发现异型增生胃粘膜E-cadherin异常表达高达21%,可能是发生在E-cadherin基因水平上的异常,是发展成恶性较高、浸润生长的分子学基础。在一些有关进展期胃癌和食道癌的报道中,α-catenin的表达与肿瘤临床病理形态的关系更加密切。BukholmIK等已经注意到乳腺癌患者转移灶内癌组织β-catenin再表达的情况[14],Brabletz等[15]研究发现结肠癌中存在β-catenin异常表达,β-catenin异常表达者生存时间与正常表达着有显著差异,与生存期密切相关,是独立的胃癌生存期预测因子。Jawhari等[13]研究发现,异常增生胃粘膜组织γ-catenin28%异常表达,γ-catenin异常染色体在浸润型胃癌100%,同时与肿瘤分期、分化明显相关。目前绝大多数的研究都是关于肿瘤原发灶的,很少涉及转移灶。刘津等[16]研究发现相当一部分胃癌细胞在原发灶内E-cadherin/catenin复合体表达异常或者缺失,导致细胞间粘附功能下降,癌细胞脱落转移,而淋巴结转移灶的胃癌细胞则会重新出现该复合体的阳性表达,促使转移癌细胞间粘附功能增强,促使其形成有效的转移灶。本研究显示,E-cadherin/catenin复合物在胃癌原发灶的正常表达极低,仅有1例完全正常表达,其余均有不同程度的表达异常或缺失,而其中有55例出现了该复合物在转移淋巴结内癌细胞中再表达阳性,表明该复合物在肿瘤细胞转移及转移后发生聚集形成有效转移灶的过程中可能发挥着重要作用。E-cadherin/catenin复合物在高、中分化胃癌的再表达阳性率显著高于低分化肿瘤,表明高分化肿瘤更容易出现再表达阳性,解释了临床实际出现的高分化胃癌患者的生存率并不高于低分化胃癌患者这一现象,表明该复合物在转移淋巴结癌细胞中再表达情况发挥了重要作用。本研究显示E-cadherin/catenin复合物在转移淋巴结内癌细胞中再表达情况与患者的预后密切相关,可以作为一个独立的预测预后的因子,其中β-catenin的再表达情况也与患者的预后密切相关,这与刘津等[16]报道的研究结果相一致。
He等[17]发现C-mgc基因是β-Cat-Tcf/lef复合物的靶基因。AntonNoraks等研究表明CD1也是β-catenin的靶基因。Alberts[18]发现,C-mgc基因是NF-κB系统的靶基因, NF-κB通过上调C-mgc基因转承活性,而调节C-mgc的表达。另外,细胞周期素(CD1)是1种作用于G1期的细胞周期相关蛋白,促进G1/G0期进入S期,Guttridge等研究证实,NF-κB可启动CD1的转录促进细胞增殖[19]。Rb对细胞增殖分化的调控与多种cyclins、CDKs、TGF-β2的参与有关。可以看出NF-κB、Rb蛋白与E-cadherin/catenin复合物在分子水平上有共同的作用基因,而且有报道说NF-κB蛋白与β-catenin在胃癌原发灶协同表达[20]。
综上所述,三者在胃癌的发生、发展、转移及预后等方面可能存在着某种联系。可能是NF-κB在胞质中受到各种理化、生物等刺激与特异性抑制物解离激活而进入胞核,在分子水平影响多基因的转录,促进细胞癌变; Rb基因产物的磷酸化状态发生变化,不能继续阻止细胞由G1到S期的演进,促进细胞癌变;在以上两者发生作用的同时,E-cadherin/catenin复合物在癌变细胞的表达及其功能发生异常或者缺失,使细胞间粘附作用减弱的同时促进了肿瘤的生长、转移,而该复合物在转移淋巴结内癌细胞中发生的再表达阳性情况有效的促进了转移癌细胞的聚集,影响了的预后。这可能是有关于胃癌发生、发展、转移及预后的一个完整过程,然而其机理仍需进一步证实。本研究显示NF-κB、Rb蛋白在肿瘤原发灶的表达与E-cadherin/catenin复合物在转移淋巴结癌细胞中再表达三者间无相关性,提示三者间的作用机制仍需进一步研究。
[1] Kintner C.Regulation of embryonic cell adhesion by the c-adherin Cytoplasmic domain〔J〕.Cell,1992,69(2):225-236.
[2] Tamura S.The E-cadherin-medeated cell-cell adhesion system in human cancers〔J〕.Br J Surg,1997,84(7):899-900.
[3] Weiberg RA.The retinoblastoma and cell cycle control〔J〕.Cell,1995,81(3):323-330.
[4] Andrews NA,Jones AS,Heliwell TR,et al.Exression of the E-cadherin-catenin cell adherin complex in primary squamous cell carcinoma of the head and neck and their nodal metastases〔J〕.Br J Cancer,1997,75:1474-1480.
[5] Grumont RJ,Rourke IJ,Strasser A,et al.B lymphocytes differentially use the Rel and nuclear factor kappaB1 (NF-KappaB1) transcription factors to regulate cell cycle progression and apoptosis in quiescent and mitogfenactivated cell 〔J〕.J Exp Med,1998,187(5):663-674.
[6] 於亮亮,于皆平,冉宗学,等.核因子与大肠肿瘤细胞凋亡及增生的关系〔J〕.世界华人消化杂志,2002,10(3):309-312.
[7] 王 维,罗和生,余保平.胃癌及癌前病变中核因子-kappaB和端粒酶逆转录酶的表达与意义〔J〕.中国癌症杂志,2002,12(4):289-292.
[8] La Rosa FA,Pierce JW,Sonenshein GE,et al.Differential regulation of the c-myc oncogene promoter by the NF-kappa B rel family of transcriptionactors 〔J〕.Mol cell biol,1994,14(2):1039-1044.
[9] Mittnach S,Weinberg RA.G1/S phosphorylation of the retinoblastoma protein is associated with an altered affinity for the nuclear compartment〔J〕.Cell,1991,65(3):381-393.
[10] Robbims PO,Horonitz JM,M malligan RC,et al.Negative regulation of human C-fos expression by retinoblastomas gene product〔J〕.Nature 1990,346(5):668-671.
[11] Hinck L,Nelson WJ,Papkoff J,et al.Wnt-1 modulates cell-cell adhesion in mammalian cells by satabilizing beta-eatenin binding to the cell adhesion protein cadherin〔J〕.J Cell Biol,1994,124(5):729-741.
[12] Nagar B,Overduin M,Ikura M,et al.Structural basis of calcium-induced E-cadherin rigidification and dimerization 〔J〕.Nature,1996,380(6572):360-364.
[13] Jawhari A,Jordan S,Poole S,et al.Abnormal immunoreactivity of the E-cadherin-catenin complex in gastric carcinoma:relationship with patient survival〔J〕.Gastroecterology,1997,112(1):46-54.
[14] Bukholm IK,Nesland JM,Brresen-Dale AL.Re-expression of E-cadherin,α-and β-catenin,but not of γ-catenin,in metastatic tissue from breast cancer patients 〔J〕.J Pathol,2000,190(1):15-19.
[15] Brabletz T,Jung A,Hermann K,et al.Activation of beta-catenin-Tcf signaling in colon cancer by mutations in beta-catenin or APC〔J〕.Science,1997,275(5307):1787-1790.
[16] 刘 津,池口正英,闫庆辉,等.钙粘蛋白-链蛋白复合体在进展期胃癌转移淋巴结的再表达及其临床意义〔J〕.中华实验外科杂志,2004,21(5):535-537.
[17] He TC.Identification of c-myc as a target of the APC pathway 〔J〕.Science,1998,281(5382):1509-1512.
[18] Albert S,Galdwein J,Erkins ND,et al.Rapid DNA binding by unclear factor kappa B in hepatocytes at the start of liver regeneration〔J〕.Annu Rev Immunol,1995,6(4):417,427.
[19] Guttridge DC,Albanese C,Reuther JY,et al.NF-Κb controls cell growth and differentiation through transcriptional of Cyclin D〔J〕.Mol Cell Biol,1999,19(8):5785-5799.
[20] 李恒平,童仕伦,张 倩.β-连环蛋白和核转录因子-κB在胃癌中表达的意义〔J〕.武汉大学学报,2005,26(2):243-246.
