Celecoxib对放射所致DNA损伤修复与凋亡的影响
2014-09-13雷宏伟姜永梅佟恩娟李国权
雷宏伟 龙 成 姜永梅 佟恩娟 滕 云 李国权
环氧化酶(cyclooxygenase,COX)是花生四烯酸生物合成前列腺素(prostaglandin,PG)的限速酶,其亚型COX-2在多数恶性肿瘤中呈过度表达并与肿瘤预后密切相关[1-2]。已有研究表明COX-2的过度表达与放疗抵抗正相关。选择性COX-2抑制剂不仅具有抗肿瘤活性[3],还有放疗增敏效应[4],但其放射增敏机制还未明确。本实验采用人肺腺癌A549细胞株,观察选择性COX-2抑制剂celecoxib对放射引起凋亡和DNA损伤修复的影响,进一步探讨celecoxib的放疗增敏机制。
1 材料与方法
1.1 材料与仪器
人肺腺癌A549细胞系购自本院中心实验室。Celecoxib购自大连美仑生物技术公司。Cell Counting Kit-8(CCK-8)试剂盒购自日本同仁化学研究所。引物序列、DNA Maeker及RT-PCR试剂盒购自TaKaRa宝生物工程有限公司。医用直线加速器(美国Varian公司);FACSCalibur 流式细胞仪(美国BD公司);ΜVP(CA91786)凝胶成像分析系统(美国GENE公司);核酸蛋白定量仪(德国Eppendorf公司)。
1.2 实验方法
1.2.1 细胞培养及处理 将A549细胞置于RPMI 1640培养基,37℃、5% CO2培养箱中培养,0.25%胰酶消化、分离、传代。将细胞分为对照组(给相同体积的DMSO)、药物组(celecoxib)、照射组(6MV X射线6 Gy)、联合组〔celecoxib+6 GyX射线(药物作用24 h后)〕,离心收集对数生长期A549细胞,分别种植于96孔板和6孔板中,细胞密度分别为6000细胞/孔和2.5×105细胞/孔。照射方法:医用直线加速器,剂量率200 cGy /min,源皮距100 cm。
1.2.2 CCK-8法检测celecoxib的增殖抑制作用、IC50值及确定放疗增敏剂量 取对数生长期的A549细胞按每孔6×103个细胞接种于96孔培养板(100 μl/每孔)。加入不同浓度的celecoxib培养液100 μl,设置5个浓度梯度(10~160 μmol/L),培养24 h、48 h、72 h后,每孔加入CCK-8液10 μL,继续培养1 h,酶标仪在550 nm处测定各孔吸光度值(A),实验重复3次。细胞对照组是A549细胞及培养液,空白对照组为等体积包含DMSO的培养液。公式为:①肿瘤细胞存活率(%)=〔(加药组A值-空白对照组A值)/(细胞对照组A值-空白对照组A值)〕×100%;②肿瘤细胞抑制率(%)=1-肿瘤细胞存活率(%)。
1.2.3 半定量RT-PCR 取对数生长期的A549细胞根据实验分组进行处理,celecoxib作用48 h后收获细胞,按说明书完成RNA提取纯化、cDNA的合成及PCR扩增。DNA-PKcs上游引物5'-ATCTCTTAAAGCGGGCCTTCG-3',下游引物5'-AGGCATCAACTCA GGGACTGG-3',退火温度58℃,扩增产物239bp。Ku80上游引物5'-TATGCTCCCACCGAGGCACAGTTGA-3',下游引物5'-ACTGCCTTCAGCCAGACTGGAGACG-3',退火温度56℃,扩增产物478 bp[5];GAPDH上游引物5'-GCACCGTCAAGGCTGAGAAC-3',下游引物5'-ATGGTGGTGAAGACG CCAGT-3',退火温度56℃,扩增产物416 bp。PCR产物在1.5%琼脂糖凝胶中电泳分离,紫外灯下观察拍照。应用quantity one电泳图片分析软件分析,目的基因和GAPDH的灰度比值表示mRNA相对表达量。
1.2.4 Western blot实验 取对数生长期的A549细胞根据实验分组进行处理,celecoxib作用48 h后收获细胞,4℃PBS 液洗3遍,细胞裂解液裂解细胞提取总蛋白,用6%、12%的分离胶做SDS-PAGE,转移至NC膜上,用5%脱脂奶TBST室温封闭1 h,加入一抗4℃孵育过夜,TBST洗涤3次(每次10 min),室温下辣根过氧化物酶二抗孵育1.5 h,TBST洗涤3次(每次10 min),ECL曝光试剂盒曝光显影。扫描Western Blot蛋白条带,应用ImageMasterTM 2D Platinum软件分析灰度。目的蛋白与GAPDH的灰度比值表示蛋白相对表达量。
1.2.5 流式细胞仪检测凋亡率 取对数生长期的A549细胞分别根据实验分组进行相应处理,celecoxib作用48 h后收获细胞,胰酶消化,加1640培养液,取105个细胞,固定染色,应用流式细胞仪检测。
1.3 统计学分析
所有实验均重复3次,采用t检验和方差分析分析组间和组内数据,数据分析应用SPSS 17.0软件。
2 结果
2.1 Celecoxib对A549细胞增殖抑制作用及IC50值
不同浓度的celecoxib作用于A549细胞,对细胞增殖均有抑制作用,随celecoxib浓度及作用时间的逐渐增加,细胞抑制率逐渐增高(P<0.01),见表1。Celecoxib作用A549细胞48 h的IC01值为18.44 μmol/L,IC50值为58.74 μmol/L。取IC01值,即18.44 μmol/L作为后续实验的放疗增敏剂量。
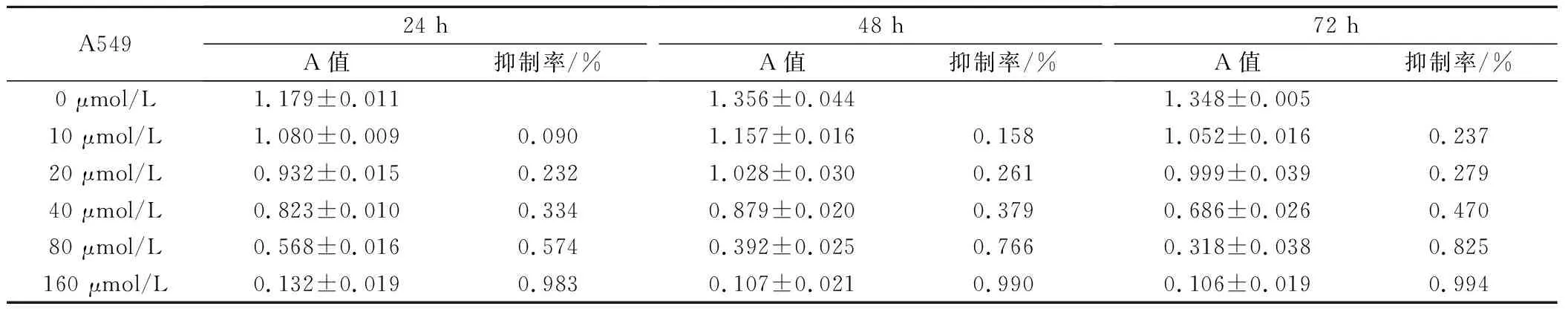
表1 Celecoxib对A549细胞增殖抑制作用
2.2 Celecoxib联合照射对A549细胞DNA-PKcs和Ku80mRNA表达的影响
DNA-PKcs mRNA表达:对照组(1.411±0.044),药物组(1.222±0.165),照射组(1.632±0.055),联合组(0.588±0.05)。与对照组相比,照射组表达量升高(P<0.05),药物组表达量较对照组下降(P<0.05),联合组表达量较其余3组均明显下降(P均﹤0.01)。Ku80mRNA表达:对照组(0.611±0.046),药物组(0.553±0.012),照射组(0.662±0.018),联合组(0.301±0.016)。与对照组相比,照射组表达量升高(P<0.05),药物组表达量较对照组下降(P<0.05),联合组表达量较其余3组均明显下降,差异有统计学意义(P<0.01)。结果提示放射可诱导DNA-PKcs和Ku80在mRNA水平表达增强,而celecoxib可显著抑制放射诱导的DNA-PKcs和Ku80RNA表达。
2.3 Celecoxib联合照射对A549细胞DNA-PKcs和Ku80蛋白的影响
DNA-PKcs蛋白表达:对照组(1.570±0.436),药物组(1.492±0.045),照射组(1.858±0.021),联合组(1.195±0.025)。与对照组相比,照射组表达量升高(P<0.01),药物组表达量较对照组下降(P<0.05),联合组表达量较其余3组均明显下降,差异有统计学意义(P<0.01),见图1。Ku80蛋白表达:对照组(1.504±0.020),药物组(1.454±0.018),照射组(1.996±0.016),联合组(1.240±0.0314)。与对照组相比,照射组表达量升高(P<0.01),药物组表达量较对照组下降(P<0.05),联合组表达量较其余3组均明显下降,差异有统计学意义(P<0.01),见图1。结果提示放射可诱导DNA-PKcs和Ku80在蛋白表达水平增高,而celecoxib可抑制放射诱导的DNA-PKcs、Ku80蛋白和RNA表达。

1、2、3、4分别代表对照组、药物组、照射组、联合组
2.4 Celecoxib联合照射对A549细胞凋亡的影响
对照组、药物组、照射组、联合组凋亡率分别为(2.11±0.05)%、(4.72±0.09)%、(9.80±0.05)%、(11.95±0.04)%,照射组、药物组凋亡率高于对照组(P<0.01),联合组凋亡率明显高于其余3组,差异有统计学意义(P<0.01)。
3 讨论
研究证实应用COX-2抑制剂能有效减少患恶性肿瘤的风险并抑制肿瘤形成的进程[6]。Celecoxib是选择性COX-2的抑制剂,已在多项实验中表现肿瘤细胞增殖抑制作用。本实验研究显示celecoxib对A549细胞具有增殖抑制作用,且随药物剂量、作用时间的增加而升高。
DNA双链断裂(DNA double strand breaks,DSBs)是电离辐射引起细胞死亡的主要原因之一,在哺乳类细胞中,非同源末端结合重组(DNA nonhomologous end-joining,NHEJ)是DSBs损伤修复中最重要的一种方式,DNA-PKcs、Ku70、Ku80等因子参与NHEJ修复。DNA-PK由DNA-PKcs和Ku组成,在辐射诱导的NHEJ修复中起到核心作用,其功能的丧失可导致细胞DSBs损伤修复能力的降低,使细胞对电离辐射的敏感性增高。已有研究提示放射线可引起胶质母细胞DNA-PKcs蛋白的升高[7],而DNA-PK的高表达是放疗抵抗的可能机制之一,因此DNA-PK是放射增敏的潜在新靶点。有研究应用siRNA的方法敲除Ku80的基因,发现Ku80表达阴性的宫颈癌细胞对电离辐射的敏感性增高[8]。Ku80低表达的非小细胞肺癌患者预后及治疗效果明显好于Ku80高表达者[9]。Ku70低表达的肿瘤细胞对放射线更敏感,因此可以通过Ku70蛋白的表达水平来预测放疗疗效和局部控制率[10]。本实验研究发现照射组DNA-PKcs、Ku80的mRNA、蛋白表达均高于对照组,而联合组DNA-PKcs、Ku80的mRNA、蛋白表达均比其它各组降低,提示celecoxib联合照射可降低DNA-PKcs、Ku80的表达,故COX-2可能是影响DNA损伤修复因子的上游调节因子之一,celecoxib可通过抑制放射诱导的DNA损伤修复蛋白表达从而起到放疗增敏作用。
放射线导致的不能被修复的DNA损伤激活凋亡相关基因,诱导细胞凋亡。DNA-PK是感受DNA损伤的分子探测器,它的高表达可抑制细胞凋亡[11]。利用siRNA方法抑制DNA-PK的转录,或者利用抑制剂直接抑制其蛋白表达,均可以减少DNA损伤修复和诱导凋亡[12-13]。本实验结果显示,celecoxib联合照射抑制DNA-PKcs表达的同时,促进了细胞的凋亡。进一步证明,DNA-PKcs对细胞凋亡的作用。
综上所述,选择性COX-2抑制剂celecoxib对肺腺癌A549细胞具有放射增敏的作用,其作用可能通过抑制DNA-PKcs及ku80的表达,减少DNA损伤修复及促进放射诱导的凋亡的途径实现。但深入的分子机制还有待进一步研究。
[1] Ke HL,Tu HP,Lin HH,et al.Cyclooxygenase-2 (COX-2) up-regulation is a prognostic marker for poor clinical outcome of upper tract urothelial cancer〔J〕.Anticancer Res,2012,32(9):4111-4116.
[2] Mestre F,Gutierrez A,Ramos R,et al.Expression of COX-2 on Reed-Sternberg cells is an independent unfavorable prognostic factor in Hodgkin lymphoma treated with ABVD〔J〕.Blood,2012 ,119(25):6072-6079.
[3] 双金权,吴 婷,庄则豪,等.NS398对SGC7901胃癌细胞生长及CD44V6、MMP-9基因表达的影响〔J〕.实用癌症杂志,2013,28(1):15-19.
[4] Ma HI,Chiou SH,Hueng DY,et al.Celecoxib and radioresistant glioblastoma-derived CD133+ cells:improvement in radiotherapeutic effects〔J〕.J Neurosurg,2011,114(3):651-662.
[5] 徐慧婷,于世英,夏 曙,等.选择性COX-2抑制剂对放射所致DNA损伤修复的影响〔J〕.肿瘤防治研究,2008,35(8):538-542.
[6] Schetter AJ,Heegaard NH,Harris CC.Inflammation and c-
ancer: interweaving microRNA,free radical,cytokine and p53 pathways〔J〕.Carcinogenesis,2010,31 (1): 37-49.
[7] Mi J,Dziegielewski J,Bolesta E.Activation of DNA-PK by ionizing radiation is mediated by protein phosphatase 6〔J〕.PLoS One,2009,4(2):e4395.
[8] 庄 亮,于世英,黄晓园,等.RNAi抑制Ku80表达后促进宫颈癌SiHa细胞的放射敏感性〔J〕.中国癌症杂志,2007,17(5):385-389.
[9] 蔡 云,罗庆丰,高 玟,等.Ku80蛋白在非小细胞肺癌中表达的临床意义〔J〕.实用癌症杂志,2010,25(6):599-600.
[10] Lee SW,Cho KJ,Park JH,et al.Expressions of Ku70 and DNA-PKcs prognostic indicators of local control in nasopharyngeal carcinoma〔J〕.Int J Radiat Oncol Biol Phys,2005,62(5):1451-1457.
[11] Gurley KE,Moser R,Gu Y,et al.DNA-PK suppresses a p53-independent apoptotic response to DNA damage〔J〕.EMBO Rep,2009,10(1):87-93.
[12] Lu D,Huang J,Basu A,et al.Protein kinase C activates protein kinase B/Akt via DNA-PK to protect against tumor necrosis factor-alpha-induced cell death〔J〕.J Biol Chem,2006,281(32): 22799-22807.
[13] Tichy A,Novotna E,Durisova K,et al.Radiosensitization of human leukaemic molt-4 cells by DNA-dependent protein kinase inhibitor,NU7026〔J〕.Acta Medica (Hradec Kralove),2012,55(2):66-73.
