基于双荧光素酶报告基因系统建立miR-140生物传感器
2014-09-13高原邹阳于影林金德张春丽温传俊沈干
高原,邹阳,于影,林金德,张春丽,温传俊,沈干
(1.南京医科大学附属友谊整形外科医院 科教办,江苏 南京 210029; 2.南京师范大学生命科学学院 分子细胞生物学研究所,江苏 南京 210023; 3.南京医科大学第二附属医院 整形外科,江苏 南京 210003)
成熟的microRNAs(miRNAs)是一类高度保守的内源性非编码小分子RNA(约22 nt),通过完全或部分互补结合靶mRNAs的3′端非翻译区(3′UTR)负调控靶基因表达[1-2]。
miRNAs具有组织特异性及发育时序性[3],与靶基因之间是多对多的关系,形成复杂的调控网络。miRNAs的异常表达常常与疾病的发生发展有着密切联系,例如肿瘤[4]、关节炎[1]和心血管疾病[5]等,因此关于miRNAs的检测技术和方法对研究其作用机制以及相关疾病的诊断治疗具有重要意义。迄今为止,检测miRNA表达水平的方法已得到迅速发展,主要包括Northern blot[6-7]、微阵列芯片[8]、实时荧光定量PCR[9]等方法,总体上可将其归为探针杂交技术和样本扩增技术[10]。然而相比这些方法不能检测miRNA活性的缺点,荧光素酶报告基因表达系统是一种能够检测miRNA活性的生物传感器。本研究旨在利用双荧光素酶报告基因构建miR-140生物传感器,并进行初步应用研究。
1 材料与方法
1.1 主要材料
SD大鼠由南京青龙山实验动物中心提供;psiCHECK-2载体为本课题组实验室保存;引物由上海生工生物工程公司合成;反转录试剂盒、实时定量PCR试剂盒、T4 DNA连接酶、限制性内切酶XhoⅠ、NotⅠ购自TaKaRa公司;microRNA由上海吉玛制药技术有限公司合成(miR-140 mimics为内源性成熟miR-140的模拟物);胎牛血清、α-MEM购自Gibco公司;DMEM购自Wisent公司;转染试剂GenEscortTMI购自Wisegen公司;双荧光素酶报告基因检测试剂盒购自Promega公司。
1.2 miR-140 sensor的构建
本实验采用含双荧光素酶报告基因的psiCHECK-2为载体。针对miR-140成熟体序列设计含4个拷贝反义序列的寡聚核苷酸(表1),画线部分分别为4个拷贝的反义序列和miR-140成熟体序列,于95 ℃ 3 min自然冷却至室温,磷酸化后与XhoⅠ、NotⅠ双酶切的psiCHECK-2载体连接,16 ℃过夜。取5 μl转化至E.coliDH5α感受态。挑取克隆提质粒,测序鉴定。
表1miR-140的靶序列
Tab1miR-140targetsequence

序列名称寡聚核苷酸序列正义链5'-TCGAGCTACCATAGGGTAAAACCACTGCTACCATAGGGTAAAACCACTGCTACCATAGGGTAAAACCACTGCTACCATAGGGTAAAACCACTGC-3'反义链5'-GGCCGCAGTGGTTTTACCCTATGGTAGCAGTGGTTTTACCCTATGGTAGCAGTGGTTTTACCCTATGGTAGCAGTGGTTTTACCCTATGGTAGC-3'
1.3 rat MSCs的分离、纯化培养
选取健康4周龄的SD雄性大鼠,清洁级,体质量在80~100 g,将其脱臼处死后置于体积分数75%酒精浸泡约5 min并在无菌条件下分离出大鼠的股骨和胫骨。用注射器吸取10%胎牛血清的α-MEM培养基将骨髓冲出,制成单细胞悬液,37 ℃、体积分数5% CO2培养。48 h更换培养基,每3 d换液1次。
1.4 rat MSCs成软骨诱导
将rat MSCs接种于6孔板,24 h后更换成软骨诱导培养基,同时设对照组,培养7 d后提取RNA。诱导培养基:DMEM高糖培养液(含L-谷氨酰胺和丙酮酸钠),1% FBS,1%抗生素,10 ng·ml-1TGF-β1,1% ITS,40 μg·ml-1脯氨酸,100 nmol·L-1地塞米松,50 μg·ml-1维生素C。对照培养基:DMEM高糖培养液(含L-谷氨酰胺和丙酮酸钠),1% FBS,1%抗生素。
1.5 RNA的提取与实时荧光定量PCR(RT-qPCR)
参照Trizol reagent说明书(Invitrogen)提取RNA;采用50 ℃特异性反转录miR-140;RT-qPCR以RNU6-1为内参,采用SYBR Green I嵌合荧光法,退火温度为65 ℃,用2-ΔΔCt定量法分析数据结果。引物序列见表2。
表2RT-qPCR的引物序列
Tab2RT-qPCRprimersequences
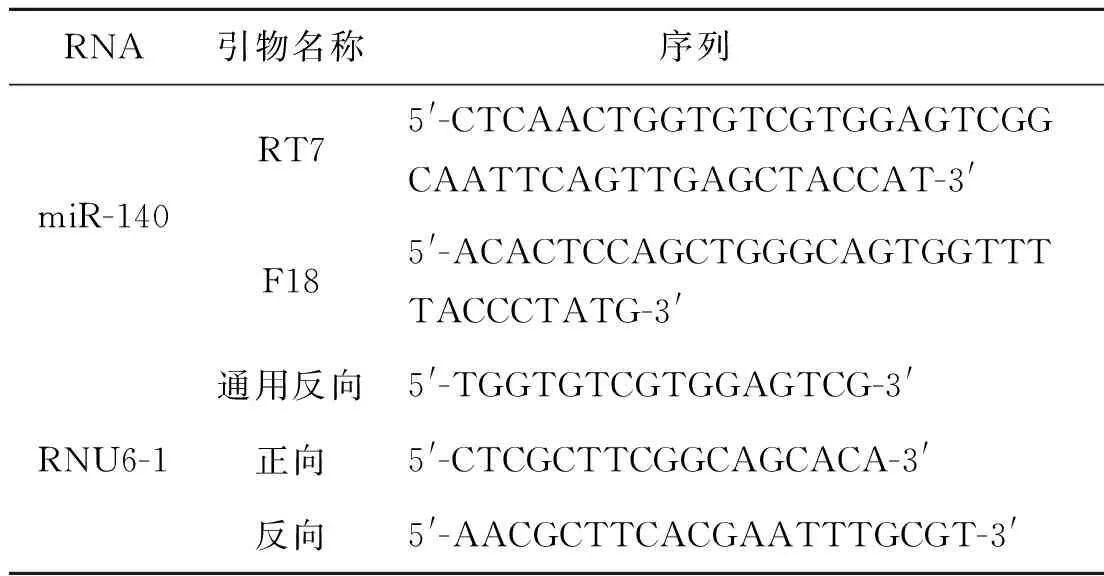
RNA引物名称序列miR-140RT75'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTACCAT-3'F185'-ACACTCCAGCTGGGCAGTGGTTTTACCCTATG-3'通用反向5'-TGGTGTCGTGGAGTCG-3'RNU6-1正向5'-CTCGCTTCGGCAGCACA-3'反向5'-AACGCTTCACGAATTTGCGT-3'
1.6 细胞转染及荧光素酶活性分析
转染前24 h,将细胞接种于24孔板,miR-140 sensor(0.5 μg)和miR-140 mimics(20 nmol·L-1、50 nmol·L-1)共转染HEK-293T细胞,设对照组,转染48 h后进行荧光素酶活性检测;miR-140 sensor(0.5 μg)转染rat MSCs,24 h后更换成软骨诱导培养基培养7 d,设对照组,每组3个复孔,进行荧光素酶活性检测。荧光素酶活性检测采用双荧光素酶报告基因试剂盒和荧光化学发光微孔板检测仪,所得数值为海肾与萤火虫荧光素酶活性的比值。
2 结 果
2.1 miR-140 sensor的设计与构建
根据miRBase数据库(http://www.mirbase.org/)获得的miR-140成熟序列设计4个拷贝反义序列,将其插入psiCHECK-2上的多克隆位点,经转染至细胞内,可转录出融合基因的mRNA,能够结合细胞内表达的miR-140,同时荧光信号降低,萤火虫荧光素酶的酶活作为内参(图1)。
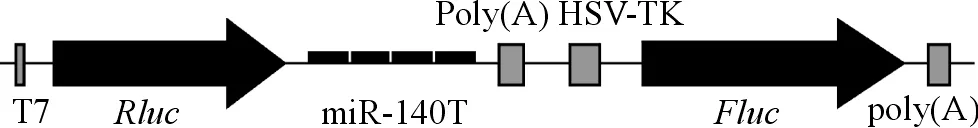
T7:T7 RNA聚合酶启动子;Rluc:海肾荧光素酶基因;miR-140T:miR-140靶结合位点;poly(A):多聚腺苷酸;HSV-TK:HSV-TK启动子;Fluc:萤火虫荧光素酶基因
图1miR-140sensor的结构示意图
T7:T7 RNA polymerase promoter;Rluc:Renilla luciferase gene;miR-140T:miR-140 target sequence;poly(A):polyadenylic acid;HSV-TK:HSV-TK promoter;Fluc:Firefly luciferase gene
Fig1SchematicmapofmiR-140sensor
2.2 miR-140 sensor的功能验证
将miR-140 sensor与20 nmol·L-1、50 nmol·L-1的miR-140 mimics共转染HEK-293T细胞,结果显示,miR-140 mimics能降低49%(P=0.001 4)、65%(P=0.001 9)的荧光活性,差异有统计学意义,表明miR-140 sensor可通过结合miR-140抑制海肾荧光素酶的荧光活性反映miR-140活性(图2)。
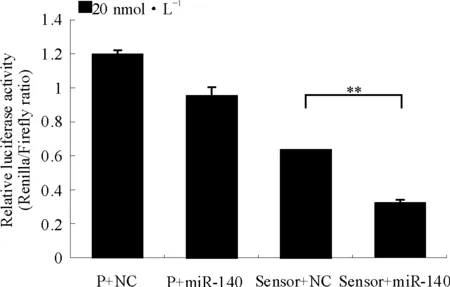
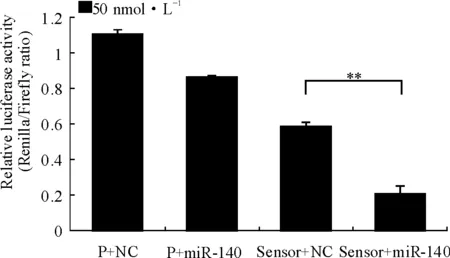
P:psiCHECK-2;miR-140:miR-140 mimics;NC:短片段双链RNA阴性对照;Sensor:miR-140 sensor
图2miR-140sensor的功能分析
P:psiCHECK-2;miR-140:miR-140 mimics;NC:Negative Control;Sensor:miR-140 sensor
Fig2FunctionalanalysisofmiR-140sensor
2.3 miR-140 sensor在成软骨诱导分化中测定miR-140活性
miR-140已被证实在成软骨诱导分化中表达水平上升,因而将rat MSCs成软骨诱导7 d后,根据RT-qPCR法检测结果显示(图3a),诱导组的miR-140表达水平显著上调(P=0.000 7),与文献报道一致。为进一步验证miR-140 sensor的功能,将其转染rat MSCs,24 h后成软骨诱导7 d(图3b),诱导组miR-140 sensor的荧光素酶活性降低43%(P=0.014 1),提示miR-140活性升高。
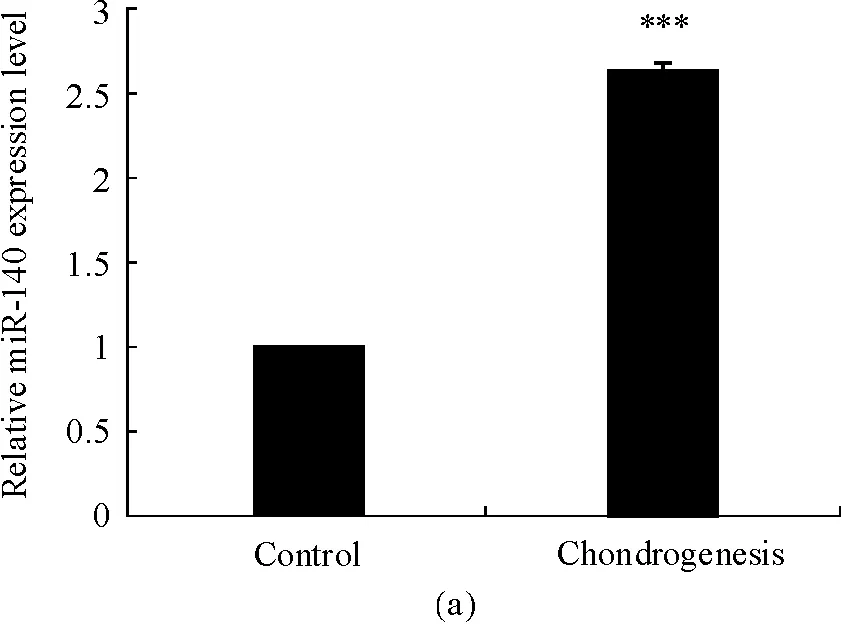
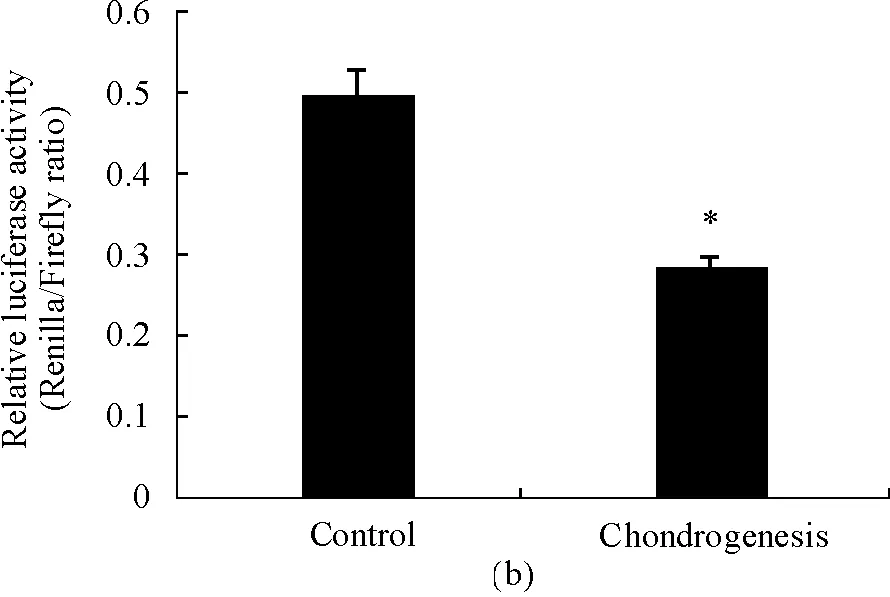
(a) RT-qPCR法检测rat MSCs成软骨诱导中miR-140的表达水平;(b) Luciferase分析rat MSCs成软骨诱导中miR-140 sensor的荧光素酶活性
图3miR-140sensor在成软骨诱导中的应用
(a) Relative miR-140 expression level by RT-qPCR analysis in chondrogenesis of rat MSCs;(b) Relative luciferase activity of miR-140 sensor by luciferase analysis in chondrogenesis of rat MSCs
Fig3ApplicationofmiR-140sensorinchondrogenesis
3 讨 论
miRNAs通过转录后水平调控基因表达,在细胞生长、分化、凋亡等生理病理过程中发挥重要作用[11-13]。其中,miR-140被认为参与骨关节炎的发病过程并作为潜在的治疗靶点而受到广泛关注。骨关节炎是较为常见的慢性关节疾病,与年龄密切相关[14]。miR-140对软骨的发育和内环境稳态起着重要的调节作用,若其功能缺失则可产生类似骨关节炎的现象。其在人类软骨形成中表达增加并且丰富存在于软骨组织,然而在关节炎患者的关节软骨中,miR-140的表达水平显著降低[15-16]。
RT-qPCR法作为常用的miRNAs检测方法具有高灵敏度、特异性好,但是操作繁琐、费时费力、模板质量要求高且只能检测miRNAs的表达水平,不能反映miRNAs在转录后水平调控基因表达的活性。然而将miRNAs的反义重复序列插入荧光素酶报告基因的3′UTR构建成miRNAs传感器,可通过报告基因的荧光活性来反映miRNAs的活性。普洛麦格公司研发了一种将萤火虫荧光素酶和海肾荧光素酶组合的双报告基因载体psiCHECK-2,海肾荧光素酶的3′UTR含有多克隆位点可插入靶基因序列,萤火虫荧光素酶作为内对照使测量结果正态化,检测方法简便、快速、灵敏。
本研究将miR-140的反义重复序列插入psiCHECK-2载体构建miR-140 sensor,并进行验证以及应用于在rat MSCs成软骨诱导中反映miR-140的活性变化,结果与RT-qPCR法检测的miR-140表达水平相一致,证明miR-140 sensor是一种可进行miR-140活性分析的生物传感器。
[1] NAKASA T,NAGATA Y,YAMASAKI K,et al.A mini-review:microRNA in arthritis[J].Physiol Genomics,2011,43(10):566-570.
[2] CHI S W,HANNON G J,DARNELL R B.An alternative mode of microRNA target recognition[J].Nat Struct Mol Biol,2012,19(3):321-327.
[3] KROL J,LOEDIGE I,FILIPOWICZ W.The widespread regulation of microRNA biogenesis,function and decay[J].Nat Rev Genet,2010,11(9):597-610.
[4] IORIO M V,CROCE C M.MicroRNA dysregulation in cancer:diagnostics,monitoring and therapeutics.A comprehensive review[J].EMBO Mol Med,2012,4(3):143-159.
[5] 毛安琼,姚怡,段晓霞,等.MicroRNA与心血管疾病[J].医学综述,2012,18(6):801-804.
[6] PALL G S,HAMILTON A J.Improved northern blot method for enhanced detection of small RNA[J].Nat Protoc,2008,3(6):1077-1084.
[7] KIM S W,LI Z,MOORE P S,et al.A sensitive non-radioactive northern blot method to detect small RNAs[J].Nucleic Acids Res,2010,38(7):e98.
[8] ZHAO B,JIN L,WEI J,et al.A simple and fast method for profiling microRNA expression from low-input total RNA by microarray[J].IUBMB Life,2012,64(7):612-616.
[9] BENES V,CASTOLDI M.Expression profiling of microRNA using real-time quantitative PCR,how to use it and what is available[J].Methods,2010,50(4):244-249.
[10] 景花,宋沁馨,周国华.MicroRNA定量检测方法的研究进展[J].遗传,2010,32(1):31-40.
[11] CHENG A M,BYROM M W,SHELTON J,et al.Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis[J].Nucleic Acids Res,2005,33(4):1290-1297.
[12] HUANG J,ZHAO L,XING L,et al.MicroRNA-204 regulates Runx2 protein expression and mesenchymal progenitor cell differentiation[J].Stem Cells,2010,28(2):357-364.
[13] GAROFALO M,CONDORELLI G L,CROCE C M,et al.MicroRNAs as regulators of death receptors signaling[J].Cell Death Differ,2009,17(2):200-208.
[14] 吴春彪,陆军,王宸.晚期糖基化终末产物在骨关节炎中的研究进展[J].现代医学,2012,40(3):356-360.
[15] MIYAKI S,NAKASA T,OTSUKI S,et al.MicroRNA-140 is expressed in differentiated human articular chondrocytes and modulates interleukin-1 responses[J].Arthritis Rheum,2009,60(9):2723-2730.
[16] MIYAKI S,SATO T,INOUE A,et al.MicroRNA-140 plays dual roles in both cartilage development and homeostasis[J].Genes Dev,2010,24(11):1173-1185.
