15-脱氧前列素2抑制MG63细胞活性并诱导其凋亡的机制
2014-09-13全碧波张善锋李月白李晓坤李啸然
全碧波 张善锋 李月白 李晓坤 李啸然 李 洁
(郑州大学基础医学院生物化学与分子生物学教研室,河南 郑州 450001)
骨肉瘤是骨组织最常见的原发性恶性肿瘤,约占所有骨肿瘤的20%。典型的恶性骨肉瘤具有显著地局部侵袭性和早期迁徙能力〔1〕,由于其转移病症较难诊断,通常该病患死亡率较高。过氧化物酶体增殖因子活化受体(PPAR)γ的激动剂能诱导多种肿瘤细胞凋亡或分化,其作为人类癌症的化学预防剂的潜在用途是目前研究的热点〔2〕。本研究分析PPARγ激动剂15-脱氧前列素2(15d-PGJ2)对人骨肉瘤MG63细胞增殖和凋亡的影响,探讨其抗肿瘤的作用机制。
1 材料和方法
1.1材料 人骨肉瘤细胞株MG63(北京协和细胞资源中心);15d-PGJ2(美国Cayman公司);胎牛血清(PAA公司);胰蛋白酶(美国Gibco公司);MTT、DMSO(美国Sigma公司); RPMI 1640培养液(北京索莱宝科技有限公司);DEPC(加拿大Fermentas公司);AnnexinV-FITC试剂盒(南京凯基公司);PCR扩增试剂盒 (加拿大Fermentas公司);SP法免疫组化染色试剂盒(北京中杉金桥);其余试剂均为国产分析纯。
1.2细胞培养 常规细胞复苏、换液和传代,倒置相差显微镜观察骨肉瘤MG63细胞的生长情况及形态学特征,取生长状态良好的骨肉瘤细胞描记细胞生长曲线。
1.3实验分组 以人骨肉瘤MG63细胞为作用对象,分为:对照组,不添加任何药物;15d-PGJ2组,根据实验加入其终浓度分别为0.1、1、5、10、20、50 μmol/L的15d-PGJ2。
1.4MTT法检测细胞增殖活力 取对数生长期MG63细胞,以3×104/ml细胞浓度,接种96孔培养板,每孔200 μl,细胞贴壁后弃去培养液,加入不同浓度的15d-PGJ2,对照组不加药,每组设6个复孔,空白对照组加入等量溶剂。分别孵育24 h、48 h、72 h及96 h,每孔加入MTT液20 μl(5 g/L),4 h后弃去上清液,并加入DMSO 150 μl,终止反应。用酶联免疫检测仪在490 nm波长处测吸光度(A值),并以空白对照孔的A值调零。生长抑制率(E)=(1-实验组A值/对照组A值)×100%。重复3次。
1.5流式细胞仪检测细胞周期 取对数生长期细胞,制成单细胞悬液,以2×105/ml的浓度接种于75 cm2培养瓶中于37℃、5%CO2饱和湿度条件下培养,次日贴壁后加入终浓度分别为0.1、1、5、10、50 μmol/L的15d-PGJ2。培养48 h和72 h,收集2×106个细胞,70%冰乙醇固定,4 ℃冰箱过夜,次日检测并对样本进行细胞周期分析。
1.6AnnexinV/PI双染色检测细胞凋亡 将20 μmol/L 15d-PGJ2干预48 h的细胞制成单细胞悬液,计数取1×106个细胞置离心管内,2 000 r/min离心5 min,弃上清,加入1 ml PBS缓冲液,重复上述操作。再加入500 μl的上样缓冲液,轻轻震荡使细胞悬浮,依次加入10 μl AnnexinV-FITC,5 μl碘化丙啶(PI)轻轻混匀,避光室温反应15 min。随即进行流式细胞仪检测。
1.7逆转录聚合酶链式反应(RT-PCR)检测药物干48 h PPARγ mRNA的表达 利用TRIzol法提取总RNA,严格按照RT-PCR试剂盒说明操作,分别以不同引物扩增PPARγ和内参照β-actin。各引物序列如下:β-actin上游,5'-AAG GGC CAT CCA CAG TCT TC-3';下游,5'-AGA AGG CTG GGG CTC ATT G-3',扩增片段为176 bp;PPARγ上游,5'-CAG GAG CAG AGC AAA GA-3';下游,5'-GGA CTC AGG GTG GTT CA-3',扩增片段为474 bp。PCR扩增条件为:95 ℃预变性3 min;95℃ 30 s、58℃ 30 s、72℃ 30 s,35次循环;72 ℃延伸10 min。取RT-PCR产物进行1.5%琼脂糖凝胶电泳,以待测基因与相应内参照条带面积灰度值比值作为mRNA相对表达量。
1.8免疫细胞化学检测相关凋亡蛋白的表达 采用过氧化物酶标记的链霉卵白素(SP法)染色试剂盒,工作浓度为1∶200,按试剂盒说明进行操作。
1.9统计学方法 采用统计学软件SPSS15.0进行方差分析和t检验,组间两两比较用Student-Newan-Keuls检验。
2 结 果
2.1生长曲线描记 培养过程中,骨肉瘤MG63细胞生长较为迅速,传代后短期内处于潜伏适应期,随后便进入对数生长期,细胞数目显著增多,达到平台期后,生长稳定,细胞分裂增殖速度逐渐变慢,最后直至衰老,细胞数目明显减少。
2.2不同时间浓度的15d-PGJ2干预MG63细胞增殖的结果 同一浓度的15d-PGJ2对MG63细胞的生长抑制作用24 h与48 h比较有差异(P<0.01),48 h、72 h及96 h时间范围内随着时间的延长其抑制率并无差异(P>0.05)。在各个时间点,任两个浓度组两两比较的均有差异(P<0.05),相同时间点的抑制率从0.1 μmol/L至50 μmol/L随着药物浓度的递增而增加。其中在50 μmol/L浓度的抑制率几乎达到100%(表1)。15d-PGJ2药物对MG63的半数抑制率IC50为3.599 μmol/L。

表1 各浓度15d-PGJ2在不同时间对人骨肉瘤MG63细胞增殖的抑制率
2.315d-PGJ2干预人骨肉瘤MG63细胞周期的结果 ①不同浓度水平的各细胞周期分布差异有统计学意义(P=0.000)。在48 h和72 h时间点,G0/G1期、S期和G2/M期的细胞比例在5 μmol/L和20 μmol/L 15d-PGJ2两个浓度组间均有差异(P<0.05);在两个时间点均显示为用药组G0/G1期细胞比例明显高于对照组,S和G2/M期细胞比例明显低于对照组,且随药物浓度的增加,G0/G1期比例有上升的趋势;即药物可使细胞周期G0/G1期阻滞。②不同时间点无差异(P>0.05)。见表2。
2.4AnnexinV/PI双染色检测细胞凋亡的结果 5 μmol/L 和20 μmol/L 15d-PGJ干预48 h,凋亡率分别为18.32%和32.08%,与对照组凋亡率(1.15%)比较差异显著(P<0.05)。
2.5RT-PCR检测药物干预48 h PPARγ mRNA表达的结果 对照组和20 μmol/L 15d-PGJ2浓度组电泳条带与相应的内参β-actin灰度值的比值分别为0.94±0.23和2.06±0.35,有统计学意义(P<0.05)(图1)。
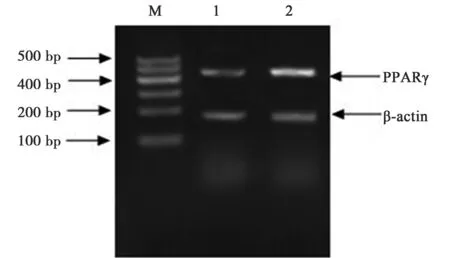
1:对照组;2:15d-PGJ2处理组;M:Marker
2.6免疫细胞化学技术检测药物干预后相关凋亡基因蛋白表达的结果 20 μmol/L 15d-PGJ2干预MG-63细胞48 h,加药组caspase-3和Bax蛋白表达的阳性率(分别为126.46±3.83和135.36±6.72)明显增高于对照组(86.46±3.73和97.08±3.84)(P<0.05);而加药组P53和bcl-2蛋白表达阳性率(分别为135.06±2.73,126.17±3.54)明显低于对照组(163.29±4.67和181.34±5.76)(P<0.05)。
表2 各浓度15d-PGJ2作用48 h和72 h时人骨肉瘤MG63的细胞周期分布
3 讨 论
PPARs是配体激活的转录因子,靶基因的转录激活依赖于配体与受体的结合〔3〕。其中15d-PGJ2是PPARγ的内源性天然配体,与该受体具有特异的亲和作用。近期研究表明,PPARγ在乳癌、前列腺癌、肺癌等多种肿瘤细胞中都有表达,并且配体激活的PPARγ有抑制细胞增殖,诱发凋亡信号,诱导分化以及抗血管生成的作用〔4~6〕。本实验采用结果表明,15d-PGJ2可使MG63细胞阻滞于G1期,抑制细胞DNA的合成,使S期细胞减少,阻止细胞进入M期,经有丝分裂而产生的子代细胞数减少,这与细胞增殖实验的结果一致。本实验结果显示,一定范围浓度的15d-PGJ2可诱导MG-63细胞凋亡,且具有明显药物浓度依赖性。本研究发现,15d-PGJ2可使PPARγ mRNA表达量明显升高,同时凋亡相关基因caspase-3和Bax表达上调,由对照组不同程度的阴性或弱阳性变为阳性表达,而P53和bcl-2基因的表达下调,由对照组阳性表达转为弱阳性或阴性表达。由此推测15d-PGJ2诱导骨肉瘤细胞凋亡可能与激活其受体PPARγ,诱导bcl-2/Bax比例的变化以及促进caspase-3的表达而促进肿瘤细胞凋亡的途径有关。野生型P53可能通过上调Bax的表达诱导bcl-2/Bax比例的变化诱导细胞凋亡。综上所述PPARγ的激动剂15d-PGJ2能够通过抑制MG-63细胞的生长与增殖,通过细胞周期滞止与促凋亡进而达到抗肿瘤作用。人骨肉瘤MG-63细胞中PPARγ的高表达可能为骨肉瘤的预防与治疗提供新的治疗靶点。
4 参考文献
1Petta E,Sotiropoulou-Bonikou G,Kourelis K,etal.Differential expression and cross-talk of peroxisome proliferator-activated receptor γ and retinoid-X receptor α in urothelial carcinomas of the bladder〔J〕. BUON,2010;15(4):740-5.
2Reka AK,Kurapati H,Narala VR,etal.Peroxisome proliferator-activated receptor-{gamma} activation inhibits tumor metastasis by antagonizing Smad3-mediated epithelial-mesenchymal transition〔J〕. Mol Cancer Ther,2010;9(12):3221-32.
3Spies CM,Burmester GR,Buttgereit F. Analyses of similarities and differences in glucocorticoid therapy between rheumatoid arthritis and ankylosing spondylitis-a systematic comparison〔J〕.Clin Exp Rheumatol,2009;27:152-8.
4Venkatachalam G,Kumar AP,Yue LS,etal.Computational identification and experimental validation of PPRE motifs in NHE1 and MnSOD genes of human〔J〕. BMC Genomics,2009;10(Suppl 3):S5.
5Mannelli M,Cantini G,Poli G,etal.Role of the PPAR-γ system in normal and tumoral pituitary corticotropic cells and adrenal cells〔J〕. Neuroendocrinology,2010;92(Suppl 1):23-7.
6Caria P,Vanni R.Cytogenetic and molecular events in adenoma and well-differentiated thyroid follicular-cell neoplasia.Dipartimento di Scienze e Tecnologie Biomediche〔J〕. Cancer Genet Cytogenet,2010;203(1):21-9.
