肝细胞癌中磷脂酰肌醇蛋白聚糖3、热休克蛋白和谷氨酰胺合成酶的表达及其临床意义
2014-09-13周新木陈丽荣
周新木 陈丽荣
(浙江大学医学院附属第二医院病理科, 浙江 杭州 321000)
由于肝细胞癌易转移及复发,预后差,如何能在肝细胞癌尚未出现转移前及早预测、诊断,并及时采取有效措施就成为能否进一步提高肝细胞癌治疗效果的关键。磷脂酰肌醇蛋白聚糖3(GPC3)属于硫酸类肝素糖蛋白聚糖家族中的一员,是通过糖基磷脂酰肌醇结合于细胞表面。在细胞的生长、分化、迁移中起着很重要的作用〔1〕。热休克蛋白(HSP)70是热休克蛋白家族中一员,主要调节细胞周期及凋亡,并在肿瘤的发生中起作用〔2,3〕。谷氨酰胺合成酶(GS)作为Wnt信号通路的靶基因,伴随β-catenin的异常激活而导致许多人类疾病的发生〔4〕。本研究运用组织芯片技术,通过免疫组织化学Envision法检测肝细胞癌中GPC3、HSP70 和 GS的表达,分析其与临床病理特征之间的关系,探讨它们在肝细胞癌的发生发展、浸润转移和预后中的作用。
1 材料与方法
1.1临床材料 2001年1月至2010年12月在浙江大学医学院附属第二医院和浙江省丽水市中心医院手术切除肝细胞癌标本182例,全部患者术前均未进行放、化疗和免疫治疗。92例癌旁肝组织选自距肝细胞癌边缘5 cm以上的癌旁肝组织。182例中男143例,女39例;年龄38~87(平均61)岁;肿瘤最大径<5 cm 125例,肿瘤最大径≥5 cm 57例;高分化(Edmonson分级1~2)81例,低分化(Edmonson分级3~4)101例;有脉管内瘤栓55例,无脉管内瘤栓127例;TNM分期Ⅰ和Ⅱ期117例,Ⅲ和Ⅳ期65例;肝外转移29例(肺15例,椎体10例,肋骨2例,肾上腺1例,脑1例),肝内转移12例,无转移141例;术后复发75例,无复发107例。
1.2小组织芯片制作 复习组织切片,在相应的蜡块上选定有代表性的区域并做标记,用自制组织芯片制作工具在一新的空白受体蜡块上穿孔(直径1.8 mm),再用相同内径的空心管从选取的供体蜡块中穿取组织,准确放入空白蜡块的小孔内,按序操作,直至将所有组织标本种植于空白蜡块中。每例取肿瘤及瘤旁组织各1处。通过切片、捞片制作组织芯片。
1.3方法 采用免疫组织化学技术EnVision法, 组织芯片4 μm厚连续切片,常规脱蜡水化后,采用高压锅进行抗原修复。鼠抗人GPC3单克隆抗体(clone 1G12)即用型试剂,购自福州迈新公司;鼠抗人HSP70单克隆抗体(clone W27)工作浓度1∶50,购自北京中杉公司;鼠抗人GS单克隆抗体(clone GS-6)工作浓度1∶450,购自美国Chemicon International Inc.公司。抗原经pH6.0的柠檬酸盐缓冲液高压锅煮沸修复处理,然后进行免疫组织化学染色过程。最后镜下控制DAB 显色,苏木素复染和中性树胶封固。每次染色均用pH7.2~7.4 PBS溶液代替一抗作阴性对照,用已知的阳性切片作阳性对照。
1.4结果判定 GPC3和GS阳性表达定位于细胞质, HSP70阳性表达定位于细胞质和细胞核。采用二级计分法,首先按染色强度评分: 无色为0分, 淡黄色为1分,棕黄色为2分, 棕褐色为3分; 然后按阳性细胞率评分: 肿瘤细胞内无阳性染色者为0分,阳性细胞率<10%为0分, 10%~25%为1分, >25%~50%为2分,>50%~75%为3分, >75%为4分。将二者相加得综合免疫组化评分:≤3分为阴性,>3分阳性。
1.5统计学分析 应用SPSS16.0软件进行χ2检验。
2 结 果
2.1组织芯片质量 组织芯片排列整齐,共取材182例,实际有效182例,有效率100%。
2.2肝细胞癌和癌旁肝组织GPC3、HSP70与GS蛋白的表达比较 GPC3在肝细胞癌和癌旁肝组织中主要表达于细胞质,与癌旁肝组织(0.6%)比较,肝细胞癌高表达,阳性表达率为 79.1%,差异显著(χ2=130.005,P<0.05)。HSP70在肝细胞癌和癌旁肝组织中主要表达于细胞质和细胞核,与癌旁肝组织(0.6%)比较,肝细胞癌高表达,阳性表达率为 79.7%,差异显著(χ2=132.172,P<0.05)。GS在肝细胞癌和癌旁肝组织中主要表达于细胞质,与癌旁肝组织(4.3%)比较,肝细胞癌高表达,阳性表达率为 77.5%,差异显著(χ2=128.235,P<0.05)。见图1。
2.3GPC3、HSP70和GS的表达与肝细胞癌临床病理特征的关系 GPC3在不同的分化程度、有无脉管内瘤栓、TNM分期和有无转移的肝细胞癌患者比较中差异显著(P<0.05);HSP70和GS在TNM分期、有无转移和有无术后复发的肝细胞癌患者比较中差异显著(P<0.05)。见表1。
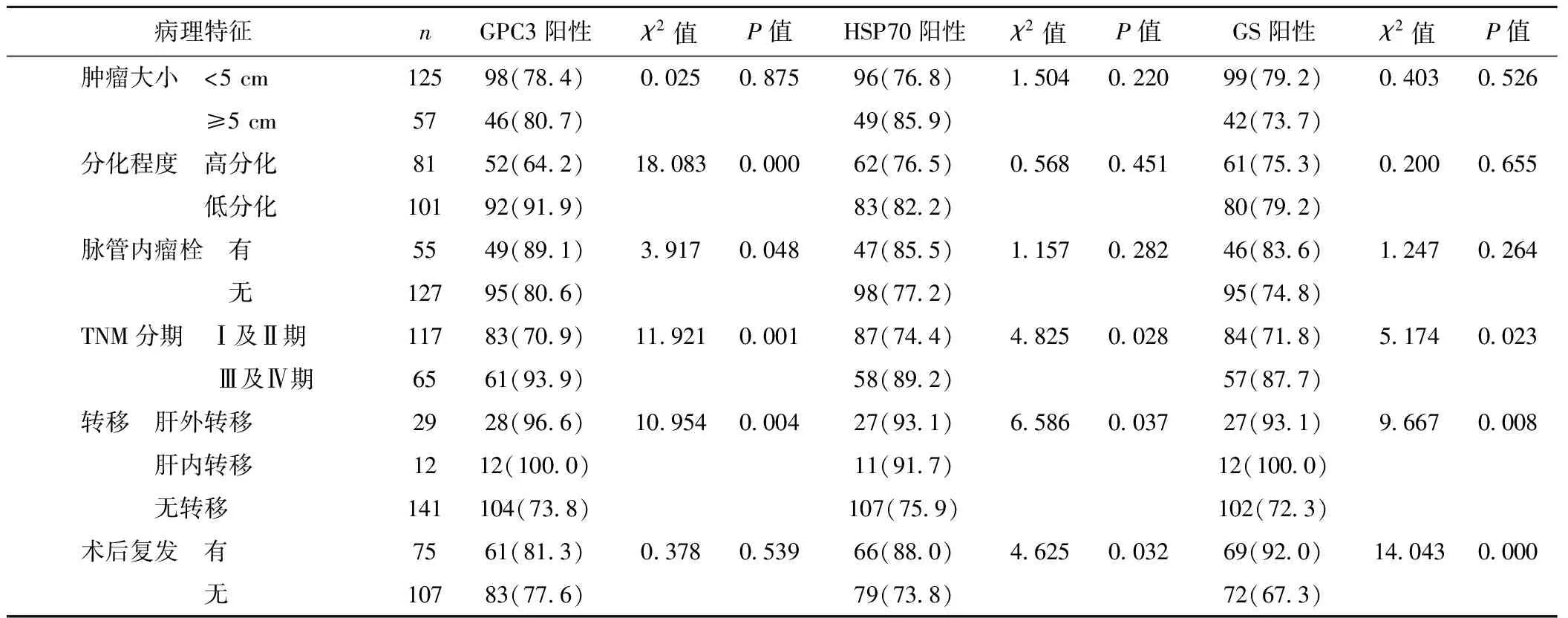
表1 肝细胞癌不同临床特征中 GPC3、HSP70和GS蛋白表达比较〔n(%)〕
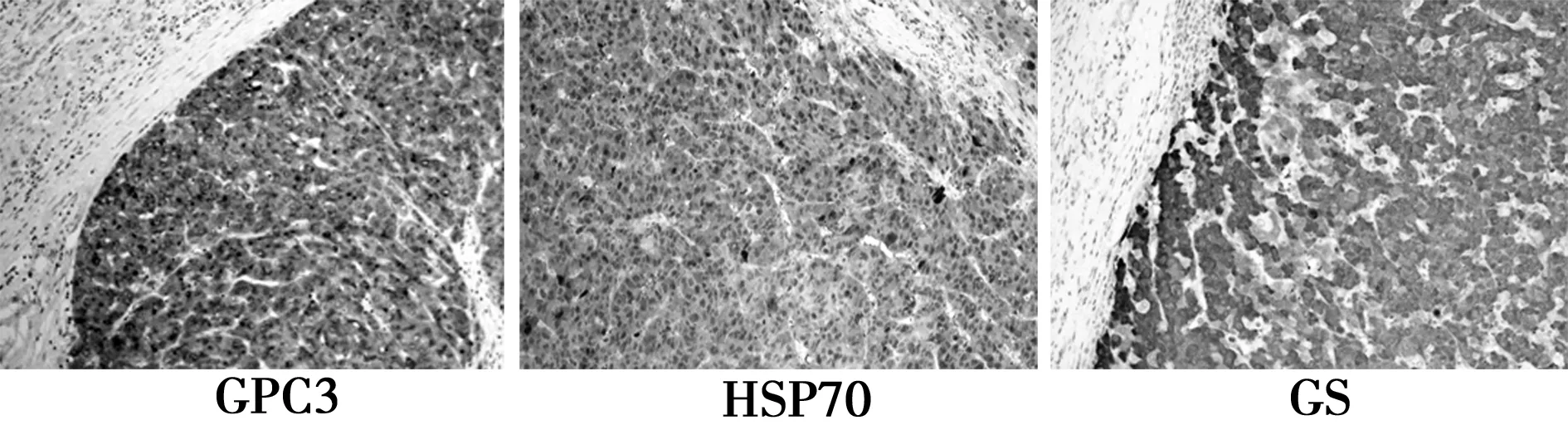
图1 肝癌组织GPC3、HSP70及GS表达(Envision,×100)
3 讨 论
GPC3属于硫酸类肝素糖蛋白聚糖家族中的一员,是通过糖基磷脂酰肌醇结合于细胞表面。在细胞的生长、分化、迁移中起着很重要的作用〔1〕。Libbrecht等〔5〕的实验结果显示,肝硬化或异型增生转化为肝癌,其特点为GPC3表达的明显增强,肝硬化组织中的小灶性病变如出现GPC3阳性则强烈提示为肝癌。本研究结果显示,GPC3阳性表达率为79.1%,与癌旁肝组织比较差异显著,并与文献报道一致〔6,7〕,提示GPC3在肝细胞癌发生和发展中起到重要作用。本研究结果还显示,GPC3的表达强度与肝细胞癌分化程度、脉管内瘤栓、TNM分期和转移有关,肿瘤细胞分化越差,临床分期越高,则GPC3蛋白表达程度越高,提示GPC3与恶性肿瘤细胞侵袭性密切相关,高表达可促进恶性肿瘤细胞转移,这可能与GPC3可抑制成纤维细胞生长因子介导的肝癌细胞增殖,同时降低肝癌细胞与Ⅰ型胶原、纤维连接蛋白之间的黏附力,增强细胞的迁移和侵袭能力有关〔8〕。
HSP70属于热休克蛋白家族中一员,主要调节细胞周期及凋亡,并在肿瘤的发生中起作用〔2,3〕。Tommaso等〔9〕报道HSP70在绝大多数肝细胞癌出现免疫组化阳性表达,包括早期肝细胞癌和高分化肝细胞癌,良性结节病变则阴性,可作为恶性肿瘤标记。本研究结果显示,HSP70阳性表达见于肝细胞癌的细胞质和细胞核中,阳性表达率为79.7%,与癌旁肝组织比较差异显著,结合HSP70功能,可能与HSP70抑制细胞凋亡,促进肿瘤进展有关。本研究结果提示HSP70表达增加与肝细胞癌发生、发展有关,并且是肝细胞癌发展和恶化的重要标志。其机制可能是HSP70的高表达介导癌基因与抑癌基因产物的构像成熟和跨膜转运,同时又介导错配蛋白的降解,协调肿瘤细胞的蛋白质快速代谢平衡,使肿瘤细胞得以无限增殖〔10~12〕。
GS作为Wnt信号通路的靶基因,伴随β-catenin的异常激活而导致许多人类疾病的发生〔4〕。有研究报道,GS可作为AFP低水平表达的早期原发性肝癌的新的标记物〔13,14〕。本研究结果显示,肝细胞癌GS表达水平高于癌旁肝组织,并且与TNM分期、转移和术后复发显著相关,临床分期越高,蛋白表达程度越高,与文献报道基本一致〔4,15〕。提示GS在肝细胞癌的发生和发展过程中起着关键作用,高表达可促进恶性肿瘤细胞转移,其机制可能是肝细胞癌中GS高表达,可以使肿瘤细胞不仅依赖宿主提供谷氨酰胺而自行合成,从而为肿瘤细胞合成核苷酸提供原料,有利于克服不利的生长环境,而不断增殖,进而增强了肿瘤的生存能力。
总之,GPC3、HSP70和GS在肝细胞癌的发生发展中起着不同程度的作用,联合检测GPC3、HSP70和GS可能有助于判断肝细胞癌的恶性程度、转移潜能及预后分析。
4 参考文献
1Farooq M,Hwang SY,Park MK,etal.Blocking endogenous glypican-3 expression releases Hep3B from G1 arrest 〔J〕.Mol Cells,2003;15(3):356-60.
2张江兰,张晓丽,侯 勇,等. 膀胱移行细胞癌患者癌组织HSP27和HSP70mRNA的表达及临床意义〔J〕.中国老年学杂志,2011;31(7): 1108-10.
3Tommaso LD,Destro A,Seok JY,etal. The application of markers (HSP70 GPC3 and GS)in liver biopsies is useful for detection of hepatocellular carcinoma〔J〕.J Hepatol,2009;50(4):746-54.
4Osada T ,Sakamoto M, Nagawa H ,etal.Acquisition of glutamine syntheatase expression in human hepatocarcinogenesis : relation to disease recurrence and possible regulation by ubiquitin-dependent proteolysis〔J〕. Cancer,1999;85(4): 819-31.
5Libbrecht L,Severi T,Cassiman D,etal.Glypican-3 expression distinguishes small hepatocellular carcinomas from cirrhosis, dysplastic nodules and focal nodular hyperplasia-like nodules〔J〕.Am J Surg Pathol,2006;30(11):1405-11.
6杜经丽 ,韦立新,王玉兰. 磷脂酰肌醇蛋白聚糖3等抗体在肝细胞肝癌中表达及其鉴别诊断意义〔J〕. 中华病理学杂志,2011;40(1):11-6.
7叶玉清,王凤华,黄香婷,等. 磷脂酰肌醇蛋白聚糖-3的表达在肝细胞癌诊断中意义〔J〕. 中华病理学杂志,2011;40(9):626-9.
8Kwack MH, Choi BY, Sung YK. Celluar changes resulting from forced expression of glypican-3 in hepatocellular carcinoma cells 〔J〕.Mol Cells, 2006;21(2): 224-8.
9Tommaso LD, Franchi G, Park YN,etal. Diagnostic value of HSP70, glypican-3 , and glutamine synthetase in hepatocellular nodules in cirrhosis〔J〕. Hepatology, 2007; 45(3):725-34.
10Silverstein AM, Grammatikakis N,Cochran BH,etal. P50(cdc37)binds directly to the catalytic domain of Raf as well as to a site on hsp90 that is topologically adjacent to the tetratricopeptide repeat bingding site〔J〕. J Biol Chem, 1998; 273 (32):20090-5.
11De la Rosa EJ, Veqa-Nunez E, Morales AV,etal. Modulation of the chaperone heat shock cognate 70 by embryonic (pro) insulin correlates with prevention of apoptosis〔J〕. Proc Natl Acad Sci USA, 1998;95(17): 9950-5.
12Buzzard KA, Giaccia AJ, Killender M,etal. Heat shock protein 72 modulates pathways of stress-induced apotosis〔J〕.J Biol Chem,1998;273(27):17147-53.
13Long J ,Lang ZW, Wang HG ,etal. Glutamine synthetase as an early marker for hepatocelluar carcinoma based on proteomic analysis of resected small hepatocelluar carcinomas 〔J〕.Hepatobiliary Pancreat Dis Int, 2010;9(3):296-305.
14Sakamoto M. Early HCC: diagnosis and molecular markers 〔J〕.J Gastroenterol, 2009; 44(Suppl 19):108-11.
15Dal Bello B, Rosa L, Campanini N,etal. Glutamine synthetase immunostaining corrlelates with pathologic features of hepatocellular carcinoma and better survival after radiofrequency thermal ablation〔J〕. Clin Cancer Res, 2010;16(7):2157-66.
