Aβ25~35对大鼠海马神经元及小胶质细胞的影响
2014-09-13王爱霞董雅洁狄婷婷申兴斌王瑞婷
王爱霞 董雅洁 狄婷婷 申兴斌 王瑞婷
(承德医学院,河北 承德 067000)
阿尔茨海默病(AD)患者脑内的老年斑由β淀粉样蛋白(Aβ)异常沉积形成〔1〕,继而诱发广泛的炎症反应,近几年的研究显示炎症反应在AD中的作用越来越受到关注。小胶质细胞(MG)是中枢神经系统的免疫效应细胞,在机体固有免疫和多种神经退行性疾病的炎症反应中发挥重要作用,MG在AD发生中的作用是目前AD研究的热点之一〔2〕。有研究报道Aβ斑块沉积与神经元损伤和MG的功能密切相关,但注射Aβ后不同时间点Aβ25~35对大鼠海马神经元及MG的影响未见报道。本研究分析Aβ对大鼠海马神经元的影响及与MG变化的关系。
1 材料与方法
1.1动物 雄性Wistar大鼠40只,10~12周龄,体质量(260±20)g,SPF级,批号:0289310,由北京华阜康生物科技有限公司提供,生产许可证号:scxk京2009-0004。实验动物在SPF实验室〔No.SYXK (冀) 2009-0022〕饲养,自然光线,自由食水。
1.2试剂 Aβ25~35(Lot:111M4775V),由Sigma公司提供,Aβ25~351 mg溶于500 μl无菌生理盐水(2 g/L),-20℃保存,临用前置于37℃孵育3~5 d成凝聚态,cd11b抗体(Lot:Y-07D10A),即用型SABC试剂盒(Lot:08A22C)及DAB显色试剂盒(Lot:08A04A22)由武汉博士德生物工程有限公司提供;Aβ25~35抗体(Lot:980287W)由北京博奥森生物技术有限公司提供。
1.3仪器 江湾Ⅰ型C脑立体定位仪,上海第二军医大学;Morris大鼠水迷宫,中国医学科学院药物研究所。
1.4实验分组及处理 实验分为正常对照组和模型组(4个时间点),每组8只,适应性饲养1 w。第8天正常对照组双侧海马各注射无菌生理盐水5 μl,模型组双侧海马CA1区各注射凝聚态Aβ25~355 μl(10 μg)。模型组按照注射Aβ25~35后不同时间2、7、15、21 d处死分为四组。对照组及15 d、21 d模型组三组在注射Aβ 7 d后进行水迷宫实验。
1.5制作AD动物模型方法 适应性饲养1 w后,第8天用4%水合氯醛(10 ml/kg,ip)麻醉大鼠,麻醉成功后固定于脑立体定位仪上,调节固定平面使门齿比内耳连线中点低2 mm,清洁皮肤做正中竖切口,剥开皮下筋膜暴露顶骨,在两侧冠状缝后钻出小孔,保持硬脑膜的完整。海马区定位坐标:前囟后AP -3.5 mm,中线外侧ML ±2.0 mm,前囟水平下DV 2.7 mm。双侧用微量注射器分别注入5 μl Aβ25~35凝聚肽10 min内注完,注射后留针5 min。正常对照组注射同体积生理盐水。
1.6Morris水迷宫行为学实验 Morris水迷宫由圆形水池、自动摄像机和电脑操作系统三部分组成。圆形水池直径120 cm,高60 cm,将水池等分为4个象限,目标象限的中央放置一直径为10 cm的圆形有机玻璃平台。水池注水至水面高于平台1.5 cm,维持水温(21±1)℃,倒入黑色墨汁一瓶,搅匀,确保大鼠不会看见平台;实验期间迷宫周围参照物不变,自动摄像机同步记录大鼠运动轨迹。于注射Aβ 7 d后开始实验,第1~2天为训练,第3~5天数据作为学习、记忆成绩,第6天撤去平台,观察大鼠2 min内穿越平台区域的次数。
1.7标本制备 动物麻醉后,经左心室快速灌注250 ml的生理盐水,然后灌注含4%多聚甲醛的PBS液250 ml进行固定,1 h后取脑,左右半脑各在海马注射部位沿冠状切面切开,对组织块进行修剪,4%多聚甲醛固定过夜,PBS液洗去多聚甲醛,梯度酒精脱水,二甲苯透明,浸蜡,将两块组织的切面朝下包埋,行冠状切片,片厚5 μm,切片取含海马部位,以备染色。
1.8脑组织硫堇染色和神经元计数 二甲苯脱蜡,梯度酒精水合,蒸馏水冲洗,0.2%硫堇染色,37℃水浴10~15 min(防过染)。取出切片冷水冲洗后梯度酒精脱水,二甲苯透明,中性树胶封片后光学显微镜观察。每组选取3个标本,光镜下每个标本选海马CA1区神经元损伤最严重的连续3张切片,选取9个不重复视野在400倍视野下计数CA1区损伤段的神经元数。
1.9Aβ及CD11b免疫组化检测 石蜡切片常规脱蜡至水,3%H2O2在37℃恒温箱孵育30 min以灭活内源性酶,PBS洗3次,微波抗原修复(低火4 min,中低火4 min),冷却30 min,PBS洗3次,5%BSA封闭30 min。选取的切片加1∶100 CD11b抗体检测MG,另选取的切片加1∶100 Aβ25~35抗体检测Aβ沉积部位,4℃过夜。第2天37℃孵育45 min,PBS洗3次,生物素化山羊抗兔IgG 37℃孵育45 min,PBS洗3次,SABC 37℃孵育45 min,PBS洗3次,DAB显色,光镜下观察阳性显色为棕黄色,用蒸馏水冲洗10 min终止反应。苏木素轻度复染,脱水、透明、封片后光学显微镜进行观察。
1.10免疫组化结果观察 每组选取3只大鼠海马标本,光镜下每个标本选海马CA1区神经元损伤最严重的连续3张切片,共选取9个不重复视野在400倍视野下采用Image-Pro Plus 6.0图像分析系统,测量每组切片的平均光密度值(IOD),用于定量分析免疫组化阳性反应程度。
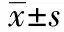
2 结 果
2.1Aβ对大鼠水迷宫实验的影响 与对照组相比,模型组15 d和21 d大鼠寻找平台的平均潜伏期明显延长(P<0.05),穿越平台次数明显减少(P<0.05)。表明海马注射Aβ25~35能影响大鼠的空间探索和学习记忆能力。见表1。
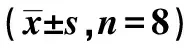
表1 各组大鼠寻找平台的平均潜伏期和各组大鼠穿越平台的次数
2.2Aβ对大鼠海马神经元和胶质细胞的影响 对照组大鼠海马CA1区细胞带完整,排列整齐有序,神经元形态正常,胞核不着色,胞质尼氏体着色深,未见神经元缺失和胶质细胞增生。模型组2 d大鼠海马CA1区较对照组大鼠神经元明显减少,细胞排列紊乱、肿胀、着色浅;模型组7 d大鼠海马CA1区较对照组大鼠神经元明显减少,排列紊乱、肿胀,尼氏体溶解;模型组15 d较对照组神经元明显减少,排列紊乱,胞体缩小,细胞核固缩,尼氏体消失,胶质细胞增生明显;模型组21 d神经元排列紊乱分散,但神经元结构有改善趋势。从注射Aβ 2~7 d、15 d神经元损伤逐渐加重,胶质细胞增多,至21 d,神经元损伤较15 d有缓和现象,胶质细胞减少。见图1,表2。
2.3海马CA1区Aβ25~35表达水平的比较 镜下可见Aβ阳性表达为棕黄色颗粒物,分布在神经细胞外和小胶质细胞质。各组Aβ阳性表达变化:对照组Aβ阳性表达极低;2 d组Aβ免疫组化着色局部明显加重,阳性表达较对照组显著增多(P<0.05);与2 d组相比,7 d组Aβ免疫组化着色均匀,阳性表达相比差异无统计学意义(P>0.05);与2 d组相比,15 d组Aβ免疫组化着色较浅,阳性表达显著减少(P<0.05);与2 d组相比,21 d组Aβ阳性表达显著减少(P<0.05)。Aβ免疫组化显示模型组大鼠Aβ沉积量在2~7 d稳定并达最高值,之后呈下降趋势。见图2,表2。
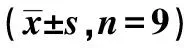
表2 各组大鼠海马CA1区神经元数、Aβ25~35及CD11b表达水平的比较
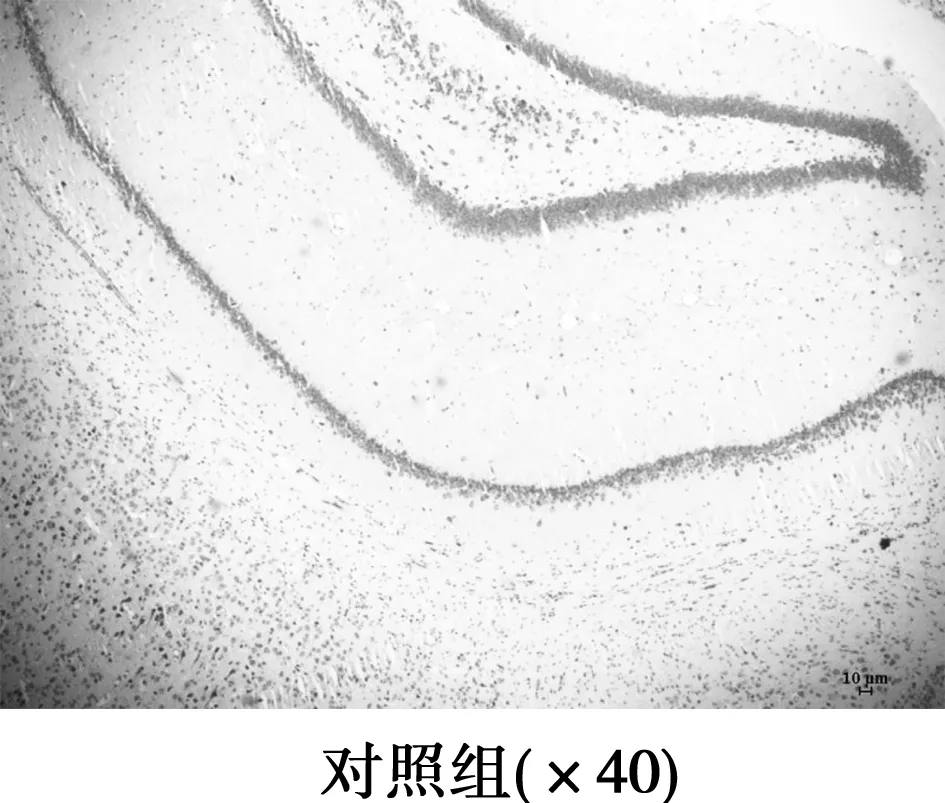


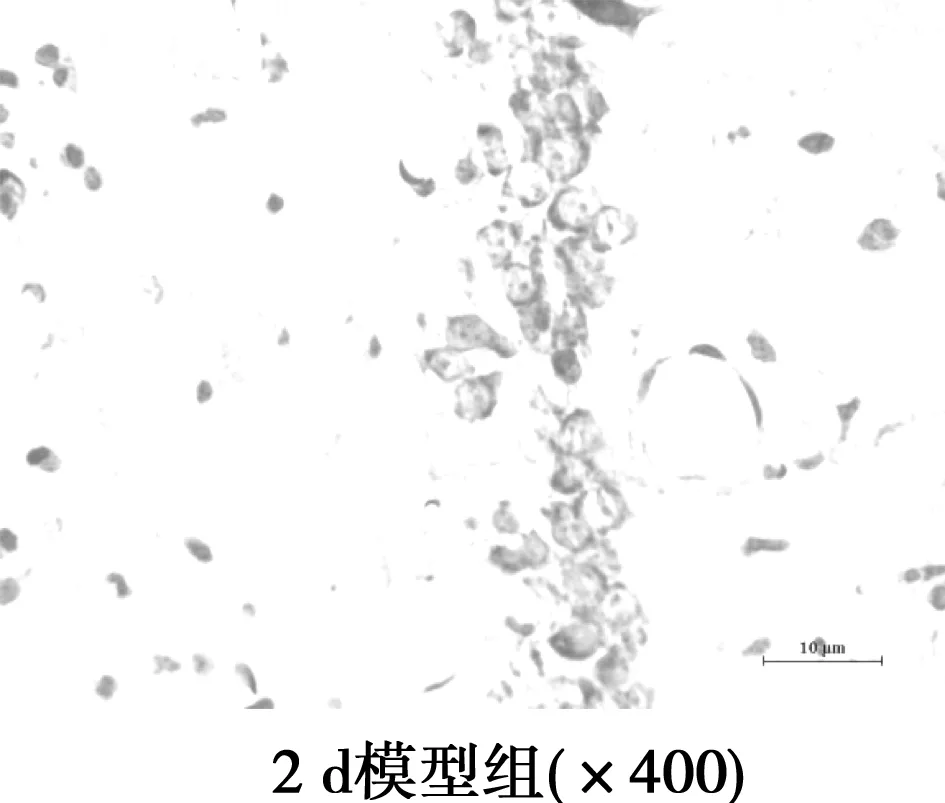



图1 海马硫堇染色
2.4海马CA1区MG的变化 CD11b为MG的特异性表面标志物,主要表达在活化的MG胞质。免疫组化显示MG胞质呈棕黄色,包绕在神经元周围。对照组CD11b阳性表达率极低,MG呈杆状;2 d和7 d组CD11b阳性率高,但形态相互差别大,2 d组MG形态有的呈分支状,突起粗短,有的胞体呈椭圆,而7 d组MG胞体呈椭圆,阿米巴样,聚集在神经元周围,吞噬清除变性的神经元及细胞碎片;15 d组CD11b阳性表达减弱,MG胞体呈圆形或延长,伸出一个或多个突起,聚集在神经细胞周围;21 d组CD11b阳性率低,MG的胞体呈椭圆,无突起,分布散落。与对照组相比,模型组4个时间点MG的形态和活化量都有显著差异(P<0.05),模型组2 d和7 dMG活化量无显著差异(P>0.05),但其后MG活化量随时间延长呈下降趋势。MG分布部位与Aβ沉积部位相似。见图3,表2。
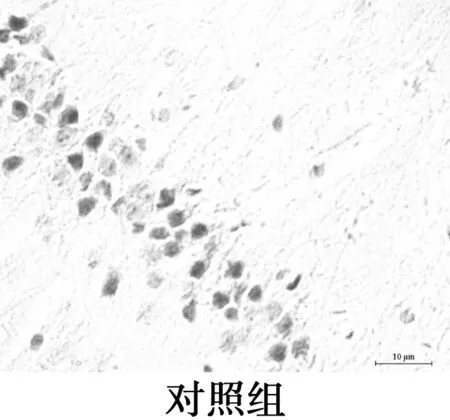
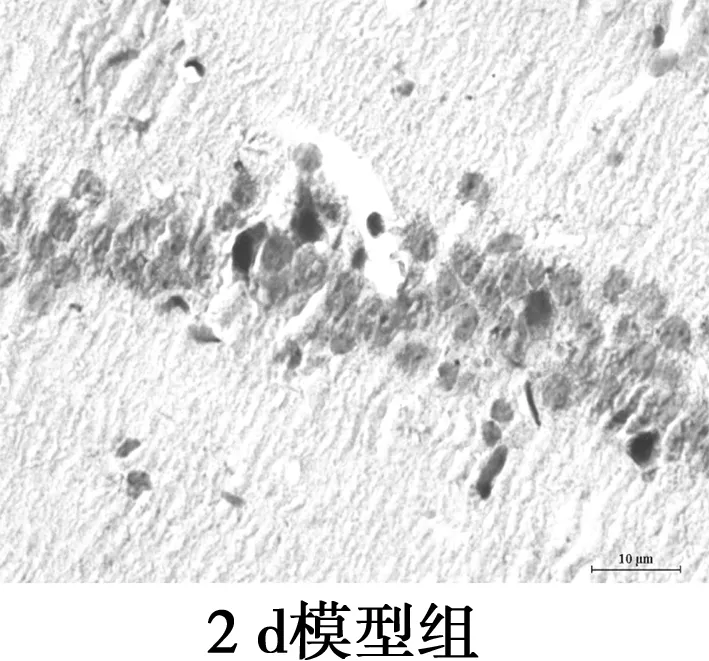
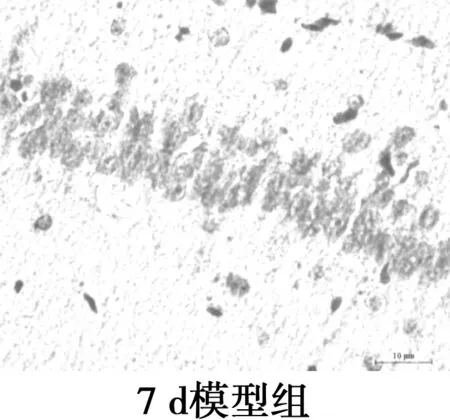
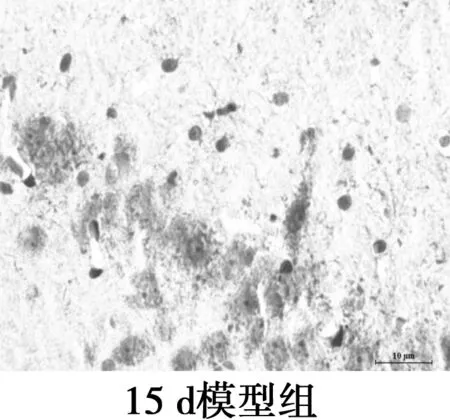
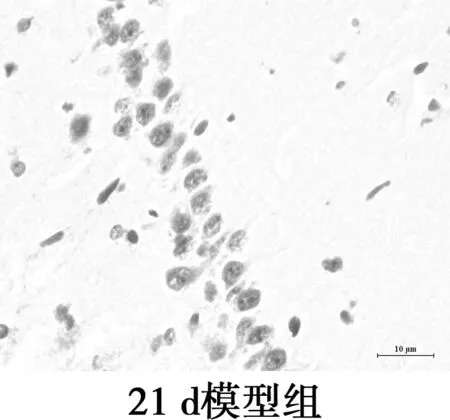
图2海马Aβ免疫组化染色(×400)
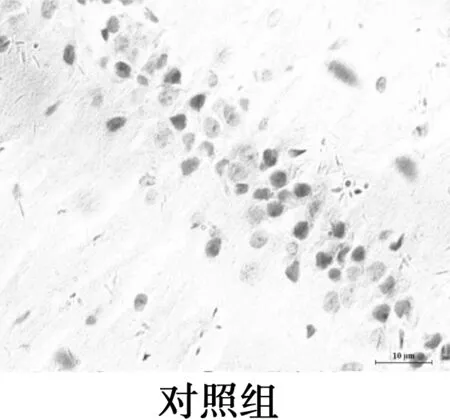
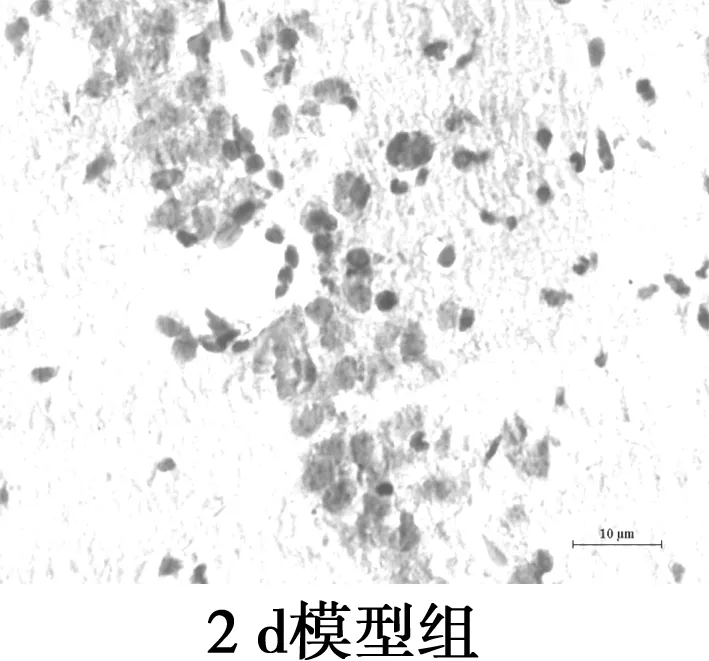
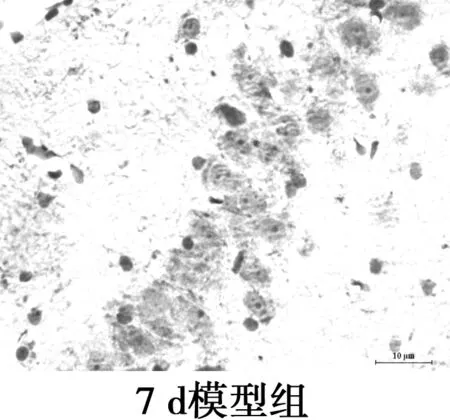
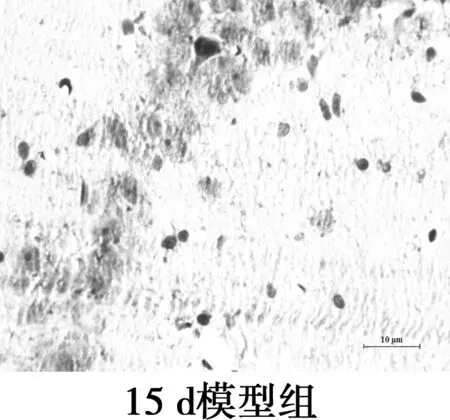
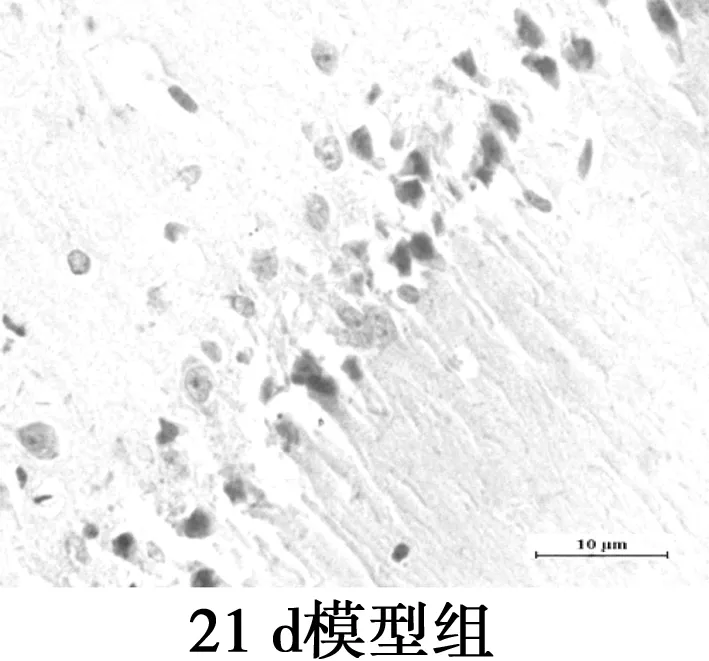
图3海马CD11b免疫组化染色(×400)
3 讨 论
Aβ在海马和大脑皮质的细胞外沉积形成老年斑〔3〕,是AD的主要病理特征之一。目前很多学者认可β淀粉样蛋白级联学说〔4〕,认为Aβ在脑内产生和清除的动态平衡失调,聚集态Aβ累积诱发的氧化应激〔5〕、细胞凋亡〔6〕、炎症反应〔7〕、细胞内钙稳态失调〔8〕等促使AD发生发展。Aβ由39~43个氨基酸组成,证实引起毒性主要部位在第25~35氨基酸之间(Aβ25~35)〔9,10〕,因此本实验采用大鼠双侧海马注射凝聚态Aβ25~35建立AD大鼠模型。结果发现注射Aβ后4个时间点大鼠海马CA1区神经元有不同程度的损伤,15 d、21 d组大鼠学习记忆能力下降,证实凝聚态Aβ25~35对神经元的毒性作用〔11,12〕,Aβ可以引起神经元损伤。
Aβ神经毒性作用被认为是多因素导致AD的共同通路。注射Aβ后,从第2~15天,海马神经元损伤逐渐加重,从15~21 d趋于稳定和修复,推测一次注射一定量Aβ后通过某些途径引起神经元损伤,但随着Aβ被降解、清除,体内内环境趋于稳定、平衡,神经元损伤也趋于稳定和修复。结合Aβ、CD11b免疫组化染色发现Aβ沉积在神经元周围,活化的MG增多,Aβ沉积部位与MG分布部位相似,沉积量呈递减趋势,MG胞浆内有Aβ沉积,以上结果提示沉积在神经元周围的Aβ可募集并激活MG,MG可吞噬Aβ并降解Aβ。Aβ沉积在第2~7天稳定在高水平,之后呈递减趋势,MG活化在第7天达高峰,之后随着Aβ被吞噬、降解,活化的MG也呈减少趋势,Aβ沉积量与MG活化具有相关性,即Aβ沉积越多,被活化的MG越多,活化的MG清除Aβ,Aβ沉积减少,活化的MG减少。MG通过清除Aβ可以一定程度上减轻Aβ沉积引起的神经元损伤,但不能完全阻断Aβ已触发的级联式的反应所引起的损伤,如启动的神经元凋亡〔13〕。因此,尽管在第7天MG活化最多,神经元损伤仍在进行,到第15天最严重。Simard等〔14,15〕研究也发现MG可以吞噬Aβ,限制老年斑形成,分泌降解Aβ的蛋白水解酶,对神经元有保护作用。有研究证实转基因小鼠MG功能失调,结合Aβ的受体和降解Aβ酶的表达显著减少,导致Aβ沉积的量增加,Aβ斑块沉积和MG的功能密切相关〔16~18〕。Cramer等〔19〕认为Aβ的沉积量减少,MG吞噬功能增强,可促使神经功能改善。本实验发现在第21天,Aβ沉积量减至最少,神经元损伤趋于稳定和修复。
MG作为中枢常驻的免疫细胞,巨噬细胞在机体固有免疫和多种神经退行性疾病的炎症反应中具有重要作用〔20〕。有研究发现在AD病程中,MG被吸引到Aβ斑块周围,产生炎性细胞因子引起损伤〔21,22〕。Liu等〔23〕研究发现AD患者脑中激活的MG显著高于正常对照组,并伴有大量神经元凋亡,Weinstock等〔24〕研究发现胆碱酯酶抑制剂ladostigil 减轻衰老大鼠认知功能降低的作用与CD11b表达减少有关。本实验发现不同时间点AD模型大鼠海马CA1区活化的MG数量明显高于对照组,同时伴有神经元损伤,提示MG的激活与AD的病理进程有关。本课题前期研究发现模型15 d组大鼠血清中TNF-α、IL-1β含量较对照组增多,提示活化的MG可能分泌炎症因子,对神经元产生损伤。
活化的MG清除、吞噬Aβ保护神经元与其可能释放炎症因子引起神经元损伤的双相作用一致是AD研究的热点之一。本实验发现不同时间点活化的MG形态各异,可能不同形态的MG吞噬功能不尽相同。进一步探讨MG吞噬功能、损伤作用、不同剂量Aβ刺激下MG上相关受体、酶、因子的变化与神经元损伤的关系,从中寻找靶点增强或抑制表达,可为AD治疗提供新的思路。
4 参考文献
1Selkoe GJ.The cell biology of beta-amyloid precursor protein and presenilin in Alzheimer′s disease〔J〕.Trends Cell Biol,1998;8(11):447-53.
2Lee CY,Tse W,Smith JD.Apolipoprotein E promotes Aβ trafficking and degradation by modulating microglial cholesterol levels〔J〕.J Biol Chem,2012;287(3):2032-44.
3Armstrong RA.Plaques and tangles and the pathogenesis of Alzheimer ′s disease〔J〕.Folia Neuropathol,2006;44(1):1-11.
4Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer′s disease:progress and problems on the road to therapeutics〔J〕.Science,2002;297(5580):353-6.
5Reiter RJ.Oxidative damage in the central nervous system:protection by melatonin〔J〕.Prog Neurobiol,1998;56(3):359-84.
6Hugon J,Terro F,Esclaire F,etal.Markers of apoptosis and models of programmed cell death in Alzheimer′s disease〔J〕.J Neural Transm Suppl,2000;59:125-31.
7Takeuchi H,Jin S,Wang J,etal.Tumor necrosis factor-alpha induces neurotoxicity via glutamate release from hemichannels of activated microglia in an autocrine manner〔J〕.J Biol Chem,2006;281(30):21362-8.
8Rhee SK,Quist AP,Lal R,etal.Amyloid beta protein(1-42) forms calcium-permeable,Zn2+-sensitive channel〔J〕.J Biol Chem,1998;273(22):13379-82.
9Yankner BA,Duffy LK,Kirschner DA.Neurotrophic and neurotoxic effects of amyloid beta protein:reversal by tachykinin neuropeptides〔J〕.Science,1990;250(4978):279-82.
10Pan YF,Chen XR,Wu MN,etal.Arginine vasopressin prevents against amyloid beta(25-35) induced impairment of spatial learning and memory in rats〔J〕.Horm Behav,2010;57(4-5):448-54.
11Klyubin I,Walsh DM,Lemere CA,etal.Amyloid-β protein immunotherapy neutralizes Aβ oligomers that disrupt synaptic plasticity in vivo〔J〕.Nat med,2005;11(5):556-61.
12Cleary JP,Walsh DM,Hofmeister JJ,etal.Natural oligomers of the amyloid-β protein specifically disrupt cognitive function〔J〕.Nat Neurosci,2005;8(1):79-84.
13Wang RT,Shen XB,Xing EH,etal.Scutellaria baicalensis stem-leaf total flavonoid reduces neuronal apoptosis induced by amyloid beta-peptide(25-35)〔J〕.Neural Regeneration Res,2013;8(12):1081-90.
14Simard AR,Soulet D,Gowing G,etal.Bone marrow-derived microglia play a critical role in restricting senile plaque formation in Alzheimer′s disease〔J〕.Neuron,2006;49(4):489-502.
15Yan P,Hu X,Song H,etal.Matrix metalloproteinase-9 degrades amyloid-beta fibrils in vitro and compact plaques in situ〔J〕.J Biol Chem,2006;281(34):24566-74.
16Hickman SE,Allison EK,El Khoury J.Microglial dysfunction and defective beta-amyloid clearance pathways in aging Alzheimer′s disease mice〔J〕.J Neurosci,2008;28(33):8354-60.
17Krabbe G,Halle A,Matyash V,etal.Functional impairment of microglia coincides with Beta-amyloid deposition in mice with Alzheimer-like pathology〔J〕.PLoS One,2013;8(4):e60921.
18Bolmont T,Haiss F,Eicke D,etal.Dynamics of the microglial/amyloid interaction indicate a role in plaque maintenance〔J〕.J Neurosci,2008;28(16):4283-92.
19Cramer PE,Cirrito JR,Wesson DW,etal.ApoE-directed therapeutics rapidly clear beta-amyloid and reverse deficits in AD mouse models〔J〕.Science,2012;335(6075):1503-6.
20Tony Wyss-Coray,Joseph Rogers.Inflammation in Alzheimer disease-a brief review of the basic science and clinical literature〔J〕.Cold Spring Harb Perspect Med,2012;2(1):a006346.
21Rubio-Perez JM,Morillas-Ruiz JM.A review:inflammatory process in Alzheimer′s disease,role of cytokines〔J〕.Sci World J,2012;2012:Article ID:756357,15 pages..
22Vom Berg J,Prokop S,Miller KR,etal.Inhibition of IL-12/IL-23 signaling reduces Alzheimer′s disease-like pathology and cognitive decline〔J〕.Nat Med,2012;18(12):1812-9.
23Liu DG,He SR,Zhang W,etal.Relationship between apoptoisis of neurons and microglia activation in Alzheimer′s disease〔J〕.Chin J Pathol,2004;33(5):404-7.
24Weinstock M,Bejar C,Schorer-Apelbaum D,etal.Dose-dependent effects of ladostigil on microglial activation and cognition in aged rats〔J〕.J Neuroimmune Pharmacol,2013;8(1):345-55.
