按摩通过改善VEGF活性及血供促进兔骨骼肌损伤修复
2014-09-13唐成林陈晓琳唐念珍韦贵勇
谢 辉 唐成林 陈晓琳 唐念珍 韦贵勇
(重庆医科大学中医药学院中医药研究室,重庆 400016)
肌肉钝挫伤是肌肉损伤发生率最高的一种,常见于对抗性体育项目或意外事故〔1〕。对日常生活和继续参加体育运动均造成不利影响〔2〕。对于老年人来讲,跌扑损伤更易发生,影响正常体育活动,甚至影响正常生活。损伤造成机体部分细胞和组织丧失后,机体对所形成的缺损进行修补恢复的过程称为修复,修复后可完全或部分恢复原组织的结构和功能。本文观察骨骼肌挫伤愈合过程中形态和血管内皮生长因子(VEGF)的变化,探讨按摩在骨骼肌挫伤恢复过程中的作用及其应用价值。
1 材料与方法
1.1实验动物分组和制模 实验兔为纯种健康成年雄性新西兰大白兔42只,体重(2.0±0.5)kg,由重庆医科大学实验动物中心提供(医学动物合格证SCXK渝20120001),分笼饲养,适应性饲养7 d后被随机分为正常组(A 组,n=3)、按摩前损伤组(B组,即损伤后第3天,n=3)、损伤后第5天按摩组(C组,n=9)和自然恢复组(D组,n=9)、损伤后第10天按摩组(E组,n=9)和自然恢复组(F组,n=9)。
采用重物打击法制作兔股四头肌急性损伤模型〔3〕。用自制底面平滑的重力铅锤(锤长10 cm、重0.5 kg、直径2.5 cm;塑料导向管长100 cm,直径3.0 cm)进行重力打击,为保证每只实验兔所受撞击力度和损伤范围一致,由同一人执行每次的铅锤投放和导管固定。造模成功的标准:肉眼可见打击部位出现肿胀和淤血,同肌肉撞伤相似,无皮肤破裂及骨折。
1.2试剂和仪器 主要试剂:8%硫化钠脱毛剂,Ⅰ抗:VEGF 抗体(北京博奥森);Ⅱ抗:辣根过氧化物标记生物素(北京博奥森);BCA蛋白定量试剂盒250次(上海贝博)。
主要仪器:酶标仪(Biocell,中国);Chem Gel-DocXR凝胶成像分析系统(Bio-Rad);电泳仪(DYY-6C,中国北京六一仪器厂);AFY-10按摩器(天津京康瑞福科技发展有限公司);荷兰飞利浦公司产飞利浦iu22 高端彩超诊断仪(L12-5 高频探头,频率10 MHz)。
1.3方法
1.3.1按摩干预 造模后第4天开始按摩治疗〔4〕,对照组不进行。1次/d,15 min/次,按摩转速为2 600 r/min,直接在受损组织及临近部位按摩,直至处死取材。
1.3.2超声检查 经耳缘静脉注射3%戊巴比妥钠(25 mg/kg)对实验兔行全身麻醉,经8%硫化钠脱毛,在实验台上用胶布固定。造影剂于使用前注入3 ml双蒸水,迅速振摇至其完全溶解,于耳缘静脉注射,即刻对受损股四头肌用飞利浦iu22高端彩超诊断仪进行局部超声诊断,观察并记录回波图像。
1.3.3取材与预处理 将实验动物分别于损伤后第5、10天,空气栓塞法处死。快速切取造模处股四头肌,即刻对受损股四头肌用预冷PBS清洗,纵切取4块,将其中2块(1.5 cm×1.0 cm×0.5 cm)肌组织标本,于4%多聚甲醛固定液固定过夜,用于H&E染色(固定组织经脱水、透明、浸蜡、包埋、切片,苏木精和伊红染色)。另2块(约1.5 cm×1.0 cm×0.3 cm)标本立即置液氮冷冻,于-80℃低温冰箱保存备用,用于Western印迹检测。
1.3.4Western印迹检测兔骨骼肌中VEGF表达 取股四头肌样本加入适量组织细胞裂解液,电动匀浆器搅碎,冰浴30 min裂解,12 000 r/min离心5 min后取上清,测定蛋白浓度。40 μg蛋白经10% SDS-PAGE 电泳,电转膜仪转移至NC膜,丽春红染色,有条带则继续下一步实验。5%脱脂牛奶封闭,PBST 漂洗3次;加入Ⅰ抗,4 ℃孵育过夜,取出Ⅰ抗,PBST漂洗3次,10 min/次;加入辣根过氧化物标记的Ⅱ抗,摇床轻摇1 h,TBST室温脱色摇床上洗3次,每次10 min;将膜置入发光盘中,加入发光试剂( ECL)进行化学发光反应,Alpha软件处理系统分析获取目标蛋白、内对照蛋白的灰度密度值,目的条带和内参照条带的灰度比值评价各组VEGF的变化。
1.4统计学分析 采用SPSS17.0软件,组间比较采用单因素方差分析,同组两时间点比较采用独立样本t检验。
2 结 果
2.1按摩对形态学的影响 光镜下观察,正常组肌纤维排列整齐,且大小一致(图1A)。损伤后第3天组,肌纤维大量断裂、崩解,部分萎缩,肌纤维明显萎缩、扭曲、坏死,间隙明显增大,炎症反应明显(图1B)。损伤后第5天两组肌纤维萎缩、坏死均明显减轻,自然恢复组与按摩组相比炎症反应仍较明显,且肌纤维间隙较大、排列紊乱,可见明显结缔组织填充,而按摩组新生的肌纤维明显较对照组多,且排列紧密(图1C,1D)。损伤后第10天,按摩组肌纤维排列相比对照组更紧密整齐,肌纤维间见少量结缔组织填充,同正常组逐渐较接近,而损伤后第10天自然恢复组肌纤维排列仍较紊乱,结缔组织同肌纤维交织,颜色呈苍白色,肌纤维之间仍有结缔组织填充(图1E,1F)。
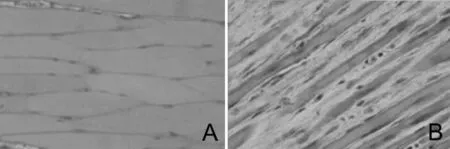

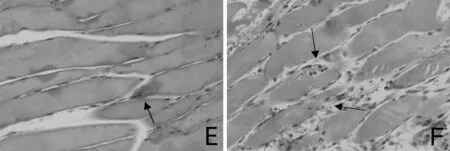
A:正常组;B:伤后第3天组;C:伤后第5天按摩组;D:伤后第5天自然恢复组;E:伤后第10天按摩组;F:伤后第10天自然恢复组;下图同
2.2按摩对损伤局部血供的影响 正常组(2A)肌肉血供良好;制模后第3天组(2B)可见大范围的坏死组织,且内部无血液供应,无血管生成;制模后第5天按摩组(2C)显示坏死范围较自然恢复组(2D)减小,有部分微泡可见于坏死组织内部,表明坏死组织内部血管部分生成,其周围微泡密度和亮度均较自然恢复组(2D)高。制模后第10天自然恢复组(2F)可见血液供应仍不佳,坏死范围也明显减少,但与按摩组(2E)仍有较大差别,此时按摩组(2E)只有微小的坏死组织,血液供应情况很好,与正常组织逐渐接近。


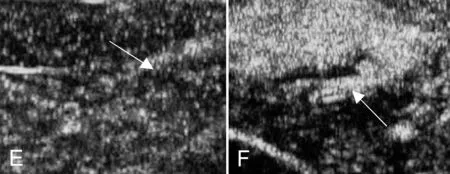
图2 超声微泡显示结果
2.3按摩对VEGF表达量的影响 VEGF在正常组织中几乎不表达,损伤后修复过程中各组与正常组(0.06)比较表达均显著增多(P<0.01)。损伤后第3天组VEGF相对表达量(0.78)明显高于正常组(P<0.01),经过按摩干预后,损伤后第5天,按摩组VEGF表达水平(0.80)较自然恢复组(0.63)偏高(P<0.01);同样,损伤后第10天,VEGF在自然恢复组(0.20)表达水平明显低于按摩组(0.27)(P<0.01)。见图3。

图3 各组VEGF表达
3 讨 论
血液循环系统在组织损伤修复过程中的作用是不可替代的。血管形成主要包括血管发生,血管生成和动脉生成3个过程〔5〕。骨骼肌损伤后,会造成局部缺血缺氧,在低氧和炎症的刺激下巨噬细胞、T细胞、星形胶质细胞、周细胞、平滑肌细胞均能分泌VEGF〔6,7〕。VEGF及其受体是血管生成中最好的特色信号路径〔8〕。我们前期的研究显示,按摩可以改善血液“浓、粘、凝、聚”的状态,加快血液流动,改善血液黏稠度,利于损伤区域充足血供,并减轻局部坏死,为组织细胞提供更多的血氧,有利于局部内环境的改善,减少了组织细胞的变性、坏死〔9〕。
VEGF是一种具有肝素结合活性的生长因子,作用于血管内皮细胞,在许多正常组织组织中广泛存在,如脑、皮肤、肺、肾、心肌、骨骼肌和小肠等许多组织都有不同程度的表达,是具有高度特异的血管内皮细胞有丝分裂素。在我们的实验中也可观察到,正常组织中VEGF表达很少,损伤后其表达量迅速增加。VEGF的作用很多:①促进内皮细胞的增殖,是目前已知的作用最强的促血管生成因子。有研究表示,VEGF的表达与组织中微血管的密度及新生血管的数量密切相关〔10〕,可明显促进拉伤处内皮细胞的增殖,在体内诱导血管形成,加快血管内皮的愈合〔11〕。②对血流动力学的影响。也有研究显示,静脉滴注VEGF可增加心率及心输出量,降低血管外周阻力,对心肌收缩力无明显的影响〔12〕。③抗血栓,还可促进血管内细胞的愈合,使内膜内皮化,间接地抗血栓形成〔13〕。
本文结果显示,按摩组同自然恢复组相比,新生的肌纤维明显较对照组多且排列紧密。在超声检查中,经按摩干预后,损伤部位的血液供应有了明显改善,有新生血管生成,微泡密度和亮度均增高,坏死范围也明显减少。炎症趋化因子可以促进VEGF的分泌〔15〕,进而作用于血管内皮细胞、刺激毛细血管网的增殖,增加氧的输送〔16〕。VEGF也可通过p38MAPK 通路诱导表达,引起人脐静脉内皮细胞的迁移〔17〕。对于这一机制仍需进一步探索和研究。
推拿手法能达筋骨节窍之血气凝滞,甚至还能调节情志之苦欲,因而能够通过筋骨节窍实现移精变气。推拿具有适应面广泛、手法操作较简单、安全性高的特点;对神经系统、消化系统及循环系统有治疗、调节、健体的功能;对运动系统有提高人体运动能力、消除运动疲劳的作用;对运动损伤的康复具有促进血液循环,改善供血,加速损伤组织修复、镇痛、缓解痉挛肌群、关节归顺的功能;更对老年人有缩短疗程、减轻痛苦、节省时间、节约开支的价值。
4 参考文献
1Kasemkijwattana C,Menetrey J,Day CS,etal.Biological intervention in muscle healing and regeneration〔J〕.Sports Med Arthrosc Rev,1998;6(2):95-102.
2Rouwkema J,Rivron NC,van Blitterswijk CA.Vascularization in tissue engineering〔J〕.Trends Biotechnol,2008;26(8):434-41.
3刘仁建,唐成林,邹 敏,等.按摩抑制兔钝挫伤骨骼肌瘢痕形成的机制研究〔J〕.中华物理医学与康复杂志,2012;34(10):742-6.
4石茜明,王学礼,按摩对肌肉损伤修复作用的形态学研究〔J〕.中国运动医学杂志,1991;10(4):201-5.
5Carmehet P.Manipulating angiogenesis in medicine〔J〕.J Intern Med,2004;255(5):538-61.
6McClung JM,McCord TJ,Keum S,etal.Skeletal muscle-specific genetic determinants contribute to the differential strain-dependent effects of hindlimb ischemia in mice〔J〕.Am J Pathol,2012;180(5):2156-69.
7Qasi Y,Maddula S,Ambati BK.Mediators of ocular angiogenesis〔J〕.J Genet,2009;88(4):495-515.
8刘林奇,鲁 峰,高建华.血管内皮生长因子参与血管形成的机制研究进展〔J〕.中华实验外科杂志,2012;29(4):770-2.
9郜 婕,唐成林,邹 敏,等.穴位按摩对受损骨骼肌血管内皮生长因子表达、微泡超声造影及血液流变的影响〔J〕.中华物理医学与康复杂志,2013;35(2):91-6.
10Maeda K,Chung YS,Ogawa Y,etal.Prognostic value of vascular endothelial growth factor expression in gastric carcinoma〔J〕.Cancer,1996;77(5):858-63.
11Asabara T,Bauters C,Plastore C,etal.Local delivery of vascular endothelial growth factor accelerates reendothelialization and attenuates intimal hyperplasia in balloon-injured rat carotid artery〔J〕.Circulation,1995;91:2793-801.
12祁 明,郑亚宁.血管内皮生长因子的研究进展〔J〕.青海师范大学学报,2010;26(4):61-6.
13周 泉.血管内皮生长因子的生物学特性及临床研究进展〔J〕.实用心脑肺血管病杂志,2001;9(1):51-4.
14彭 芳,陈 明.抗血管生成和肿瘤血管正常化的研究进展〔J〕.中国肺癌杂志,2009;12(7):799-804.
15Pugh CW,Rateliffe PJ.Regulation of angiogenesis by hypoxia:role of the HIF system〔J〕.Nat Med,2003;9:677-84.
16Yu J,Bian D,Mahanivong C,etal.p38 mitogen-activated protein kinase regulation of endothelial cell migration depends on urokinase plasminogen activator expression〔J〕.J Biol Chem,2004;279(48):50446-54.
