人肾上腺皮质癌裸鼠皮下移植瘤模型的建立
2014-09-12徐文清吴义高胡卫列
徐文清 肖 戈 吴义高 黄 福 王 尉 胡卫列
肾上腺皮质癌(adrenocortical carcinoma)是发生于肾上腺皮质的1种恶性程度高、预后差的恶性肿瘤[1]。临床较为少见,发病率为1/200万人,初次就诊即有40%发现远处转移,5年生存率为低于30%[2],因此临床上很获取新鲜的肾上腺皮质癌标本,同时观察其发生及发展过程也存在困难。因此构建肾上腺皮质癌动物模型显的极为重要。本研究应用人肾上腺皮质癌细胞株SW-13细胞接种裸鼠,建立了人肾上腺皮质癌裸鼠移植瘤模型。
1 材料与方法
1.1 材料
人肾上腺皮质癌细胞株SW-13购于中科院上海细胞所。胎牛血清、0.25%胰酶消化液购于Hyclone公司,L-15细胞培养液购于杭州吉诺公司。实验用的20只BALB/C裸鼠由南方医科大学动物实验中心提供,雌雄不限,鼠龄4~6周,体重20~25 g。饲养条件为SPF(specific-pathogen free)级。笼具、垫料、食料及饮用水均经灭菌处理,按标准方式给予裸鼠自由活动及进食。
1.2 细胞培养
SW-13细胞培养于含10%胎牛血清的L-15细胞培养液中,在37℃,5%CO2条件下培养,1~2天换液1次,当细胞生长处于对数期时,用0.25%胰酶消化计数,台盼蓝测定细胞活力达90%以上。PBS洗3次,制成单细胞悬液,调整细胞浓度为3×107/ml备用。
1.3 细胞接种
将调整好的细胞浓度为3×107/ ml的SW-13细胞共5 ml,以1 ml注射器抽取细胞悬液,每只裸鼠接种0.2 ml,即接种细胞数量为6×106个,接种部位为裸鼠左侧腋下,每次注射后均匀抽取0.2 ml PBS再次注射以保证肿瘤细胞全部注入裸鼠皮下,接种前碘伏消毒皮肤,共接种20只裸鼠。
1.4 移植瘤观察
接种5天后逐日观察接种部位,以了解肿瘤生长潜伏期和生长速度,同时大体观察移植瘤的形态、体积、颜色以及与周围组织的关系,移植瘤成瘤潜伏期为接种日至长出肉眼可见肿瘤的时间(d)。成瘤后每4天1次测量肿瘤的长径(a)及短径(b),按公式V=1/6(πab2)计算肿瘤体积,共观察10周,绘制肿瘤生长曲线图。成瘤百分率(%)=接种成功只数/接种总数×100%。
1.5 组织病理学检查
接种后第10周处死裸鼠,手术剥离肿瘤,先对肿瘤行大体观察,然后用10%福尔马林液固定,石蜡包埋切片HE染色,并于显微镜下观察。
2 结果
2.1 SW-13细胞培养结果
SW-13细胞培养于含10%胎牛血清的L-15细胞培养液中,培养3天后于倒置相差显微镜下观察,可见SW-13细胞呈贴壁生长,主要呈多角形或不规则形。
2.2 移植瘤生长特性
裸鼠在接种SW-13细胞后生长情况良好。平均接种(18±1.2)d后,19只裸鼠在接种部位均可见肿瘤硬块,据此推算平均成瘤潜伏期为18 d,成瘤百分率为95%(19/20),此后肿瘤生长速度加快,肿瘤体积倍增时间约(10±1.8)d,平均于接种后(60±1.5)d,肿瘤最大径达20 mm,此后肿瘤生长速度减慢(图1)。移植瘤外观上凸出于皮面,多为椭圆形,表面多呈结节状,质地偏韧,移动度可,皮肤无破溃及红肿。手术摘除后,19例肿瘤包膜均完整,未见向肌肉侵袭生长现象,切面呈鱼肉样,中间可见部分坏死灶。
2.3 移植瘤病理学特征
HE染色结果显示,肿瘤呈弥漫性分布,细胞核大小不一,核分裂指数≥5 / 50 HP,并可见不典型核分裂,根据weiss标准可初步诊断为肾上腺皮质癌。
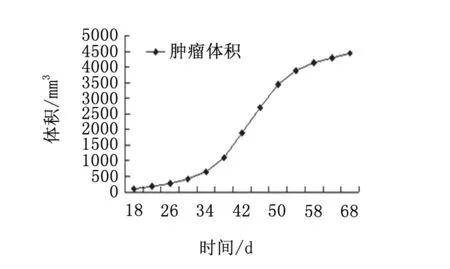
图1 肿瘤生长曲线
3 讨论
在实验研究中,动物实验研究是从基础实验研究向临床实验研究的一个重要过渡,而建立动物模型是动物实验研究的基础。本研究采用人肾上腺皮质癌细胞株SW-13细胞成功建立了人肾上腺皮质癌裸鼠移植瘤模型,并对移植瘤部分生长特性进行观察,并对其进行病理学鉴定,该模型为研究肾上腺皮质癌的发病机制及诊治方法提供了实验平台。
建立动物肿瘤模型方法包括肿瘤细胞接种法、肿瘤组织块接种法以及药物诱导等不同方法。肿瘤细胞接种法是采用肿瘤细胞悬液注入动物体内从而建立肿瘤模型的方法,该方法具有操作简单、时间短、无需特殊处理等优点,且移植成功率较高,应用较为广泛。本研究采用肿瘤细胞接种法,移植成功率为95%(19/20),其中1只裸鼠未能成瘤考虑于操作不当致肿瘤细胞未能注入裸鼠皮下有关,接种成功率与国内外报道的相似[3-4]。
不同的肿瘤模型建立方法,肿瘤生长特性也不相同。本次采用SW-13细胞悬液移植,平均成瘤潜伏期为18 d,移植瘤大小及形状较为均匀,特别适用与对肿瘤体积均一性要求高的实验。从肿瘤生长曲线可见,接种后48~60 d肿瘤生长最为迅速,而此前及此后肿瘤生长速度均相对缓慢,肿瘤生长特征与Pinto研究相近[5],提示裸鼠移植瘤实验最佳实验试剂为接种后48~60 d。
移植瘤能否保持肿瘤原有特征是移植瘤模型建立成功的关键[6]。有研究显示裸鼠肺癌移植模型在生长过程中生物学特征不稳定,出现原有标志物丢失或产生新的标志物。通过组织病理学验证,本研究所建立的移植瘤病理学特征与肾上腺皮质腺癌的特征极为相似,提示该模型可用于肾上腺皮质癌的实验研究。
总之,本研究建立的人肾上腺皮质癌皮下移植瘤模型具有操作简单、观察方便、成功率高的优点,可应用于肾上腺皮质癌的实验研究。
[1] Grunenwald S,Caron P.Adrenocortical carcinomas:therapeutic advances in 2011〔J〕.Ann Endocrinol (Paris),2011,(Suppl ):S8-S14.
[2] Lafemina J,Brennan MF.Adrenocortical carcinoma:past,present,and future〔J〕.J Surg Oncol,2012,106(5):586-594.
[3] Hantel C,Beuschlein F.Mouse models of adrenal tumorigenesis〔J〕.Best Pract Res Clin Endocrinol Metab,2010,24(6):865-875.
[4] 沈圆兵,陈余清,王效静,等.HIF-1α基因沉默对人肺腺癌细胞A549裸鼠移植瘤生长及survivin表达的影响〔J〕.实用癌症杂志,2011,26(2):111-114.
[5] Pinto E M,Morton C,Rodriguez-Galindo C,et al.Establishment and characterization of the first pediatric adrenocortical carcinoma xenograft model identifies topotecan as a potential chemotherapeutic agent〔J〕.Clin Cancer Res,2013,19(7):1740-1747.
[6] 涂少华,沈江帆,张 隆,等.人前列腺癌裸鼠皮下移植瘤模型的建立〔J〕.标记免疫分析与临床,2012,19(5):291-293.
