两种术式对进展期胃上部癌术后辅助化疗耐受性的影响
2014-09-12田君姚学权陈彻曹勤洪吴晓宇孙正陈志伟刘福坤
田君,姚学权,陈彻,曹勤洪,吴晓宇,孙正,陈志伟,刘福坤
(1.南京中医药大学 第一临床医学院,江苏 南京 210046; 2.南京中医药大学附属江苏省中医院 肿瘤外科,江苏 南京 210029)
胃上部癌指胃上1/3 部位的癌,胃癌的基本手术原则是切除肿瘤原发灶及清扫区域淋巴结、重建消化道,以恢复其消化、吸收功能。胃上部癌根治性切除以近端胃切除、全胃切除等为主要切除术式。近端胃切除这一术式的合理性一直存在争议,术后反流性食管炎、吻合口狭窄等并发症[1- 3]发病率较高,且短期内机体无法适应,因近端胃切除术后并发症导致的严重消化道反应常影响辅助化疗耐受性。上述两种术式是否影响辅助化疗完成率,目前相关报道较少。本研究对比了全胃切除和近端胃切除两种手术方式对术后化疗耐受的影响,发现近端胃切除组完成率明显低于其全胃切除组,且不良反应较多,病人远期营养状况差,具体报道如下。
1 资料和方法
1.1 一般资料
选择我院2008年1月至2013年1月收治的胃上部癌患者142例,其中男103例,女39例,平均年龄57岁。术前活检病理腺癌115例,印戒细胞癌22例,其它病理类型5例;术前临床分期Ⅱ 期65例,Ⅲ 期77例。接受全胃切除术者57例,近端胃切除术者85例,两组性别、年龄、胃癌组织学类型比较差异无统计学意义(P>0.05),具有可比性,详见表1。
1.2 治疗方法
所有病例无明显手术禁忌证,经术前准备,由同一专业小组行胃癌根治术。根据术前分期及术中探查情况选用不同手术方式,全胃切除术后采用食管空肠Roux- en- Y吻合术,近端胃切除术后采用食管残胃吻合术。术后2~3周开始行静脉化疗,根据病人具体情况选用化疗方案,主要有TP(紫杉醇175 mg·m-2,静脉滴注3 h,d1; 奥沙利铂85 mg·m-2,静脉滴注,d1)、ECF(表柔比星60 mg·m-2,静脉滴注,d1;5- FU 600 mg·m-2,持续静脉泵输注120 h;奥沙利铂85 mg·m-2,静脉滴注,d1)及S- 1口服(单纯替吉奥胶囊口服,80 mg·m-2,每日分早饭后和晚饭后2 次服用,d1 ~ 28,休息14 d,为1周期),化疗疗程为6个周期,化疗期间如出现严重不良反应或监测TM(肿瘤标志物,Tumor Marker)6项指标升高者酌情更改化疗方案,严重不良反应者酌情予对症治疗。
表1两组病例的一般资料例
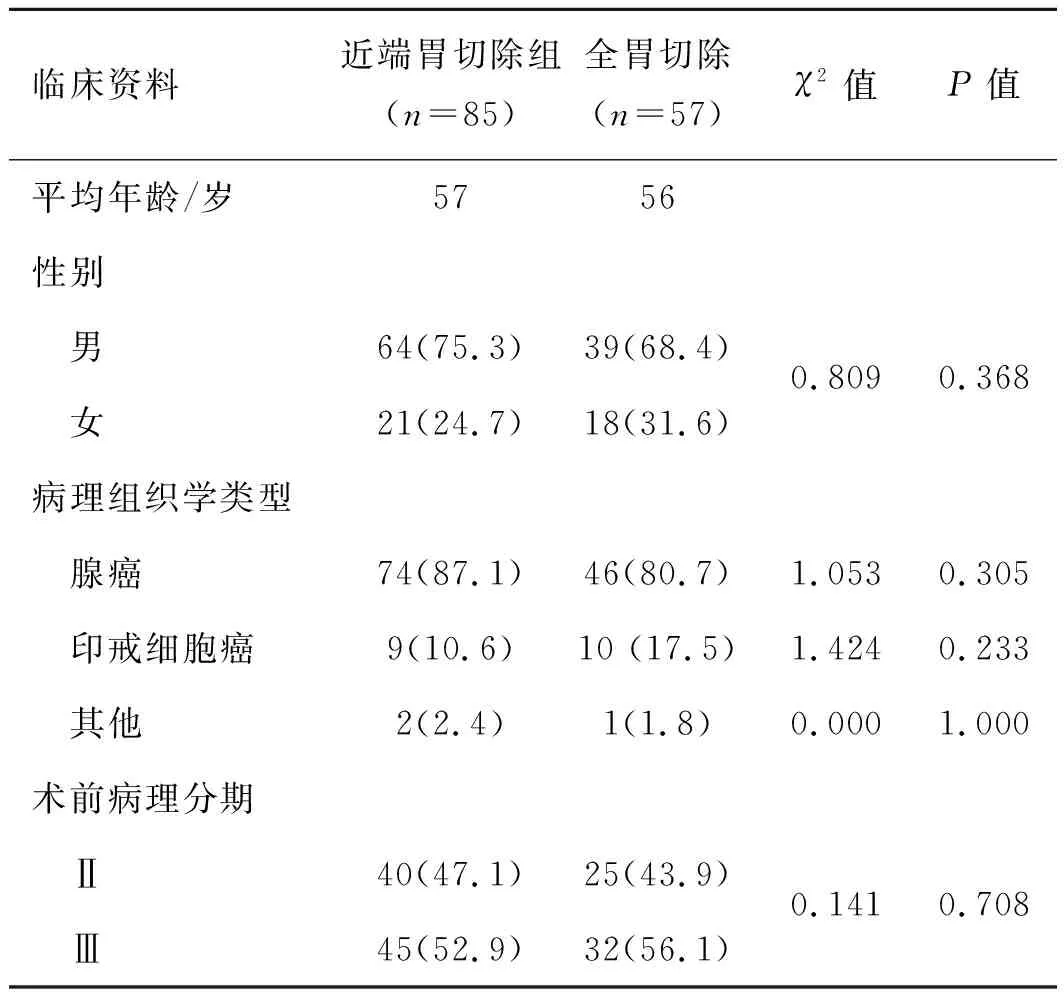
Tab 1 Patients characteristics case
注:括号内为百分率
1.3 观察指标
所有病例术后预期化疗6个疗程,本研究主要观察指标有6个疗程化疗的完成率及化疗过程中严重血液毒性及消化道不良反应的发生率(严重程度以导致化疗终止为准)。详细统计两组未完成化疗病例的主要原因,对比其发生率的差异,对有严重消化道反应的病例,予胃镜检查统计反流性食管炎及吻合口病变的发生率。
1.4 统计学处理
应用SPSS 17.0统计学软件进行数据处理,分类资料的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 辅助化疗完成情况
所有病例术后2~3周开始行辅助化疗,详细统计患者术后6次化疗的完成率。结果显示:共有49例患者完成6次化疗,总体完成率35.5%;全胃切除组完成6次化疗的患者为31例,完成率为54.4%;近端胃切除组有18例完成6次化疗,完成率为21.2%,近端胃切除组的化疗完成率明显低于全胃切除组(χ2=16.651,P<0.05),差异有统计学意义。
2.2 辅助化疗毒性反应
化疗期间全胃切除组严重不良反应发生率为17.5%,近端胃切除组发生率为48.2%,近端胃切除组消化道不良反应的发生率明显高于全胃切除组,差异具有统计学意义(P<0.05);而血液学毒性发生率两组无明显差异(P>0.05)。在近端胃切除组中,消化道反应的发生率亦明显高于血液学毒性的发生率(P<0.05),可见导致近端胃切除术组辅助化疗的耐受性差的主要病因为消化道反应。见表2。
表2不良反应发生情况例
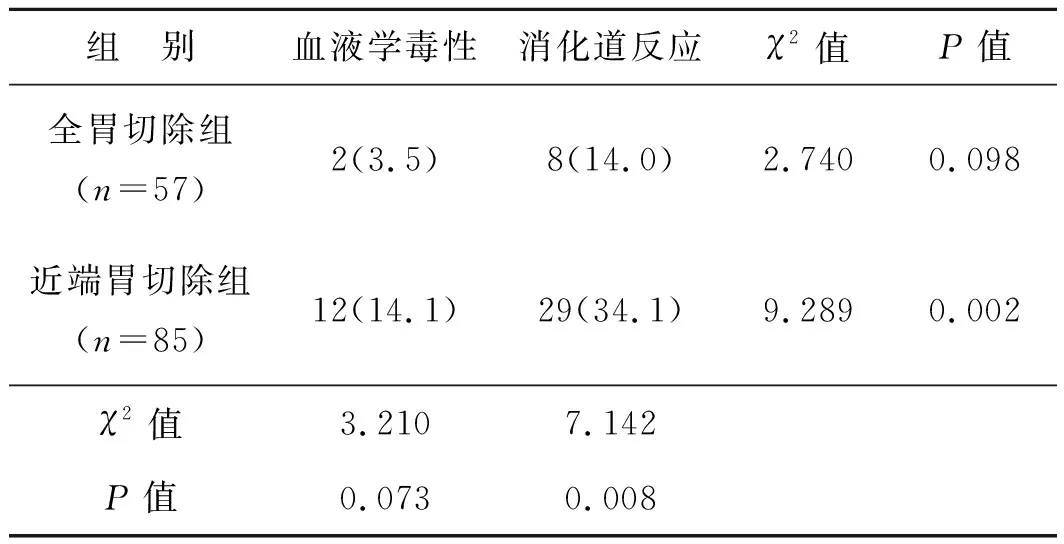
Tab 2 Incidence of adverse reactions case
注:括号内为百分率
导致化疗终止的主要病因中,血液学毒性占17.2%,消化道反应占36.6%,其中近端胃切除组血液学毒性和消化道反应所占的比率分别为17.9%和43.3%。近端胃切除组消化道反应及营养不良发生率明显高于全胃切除组(P<0.05),近端胃切除组消化道反应尤以呕吐反应明显,高于全胃切除组(P<0.05),见表3。可见消化道不良反应的发生率与手术方式有一定的相关性。
2.3 术后内镜检查结果
化疗期间我们对术后消化道反应严重的37例患者进行了内镜检查(约2~3个月),采用1978年Savary- Miller分级,内镜下诊断为反流性食管炎的发生率近端胃切除组为100%,明显高于全胃切除组,尤其是Ⅲ级反流性食管炎的发生率差异最明显。另外我们观察到,近端胃切除组的吻合口溃疡的发生率比全胃切除组明显升高,差异有统计学意义(P<0.05),见表4。以上结果说明近端胃切除术后患者存在明显反流,吻合口病变发生率高,导致严重的恶心呕吐等消化道反应,且营养状况较差,严重影响对辅助化疗的耐受,另外,临床亦可见近端胃切除组的患者因严重的消化道反应对同病房其他组的患者产生了负面的心理影响,导致对化疗的恐惧心理,甚至中断治疗。
表3化疗终止的主要原因例
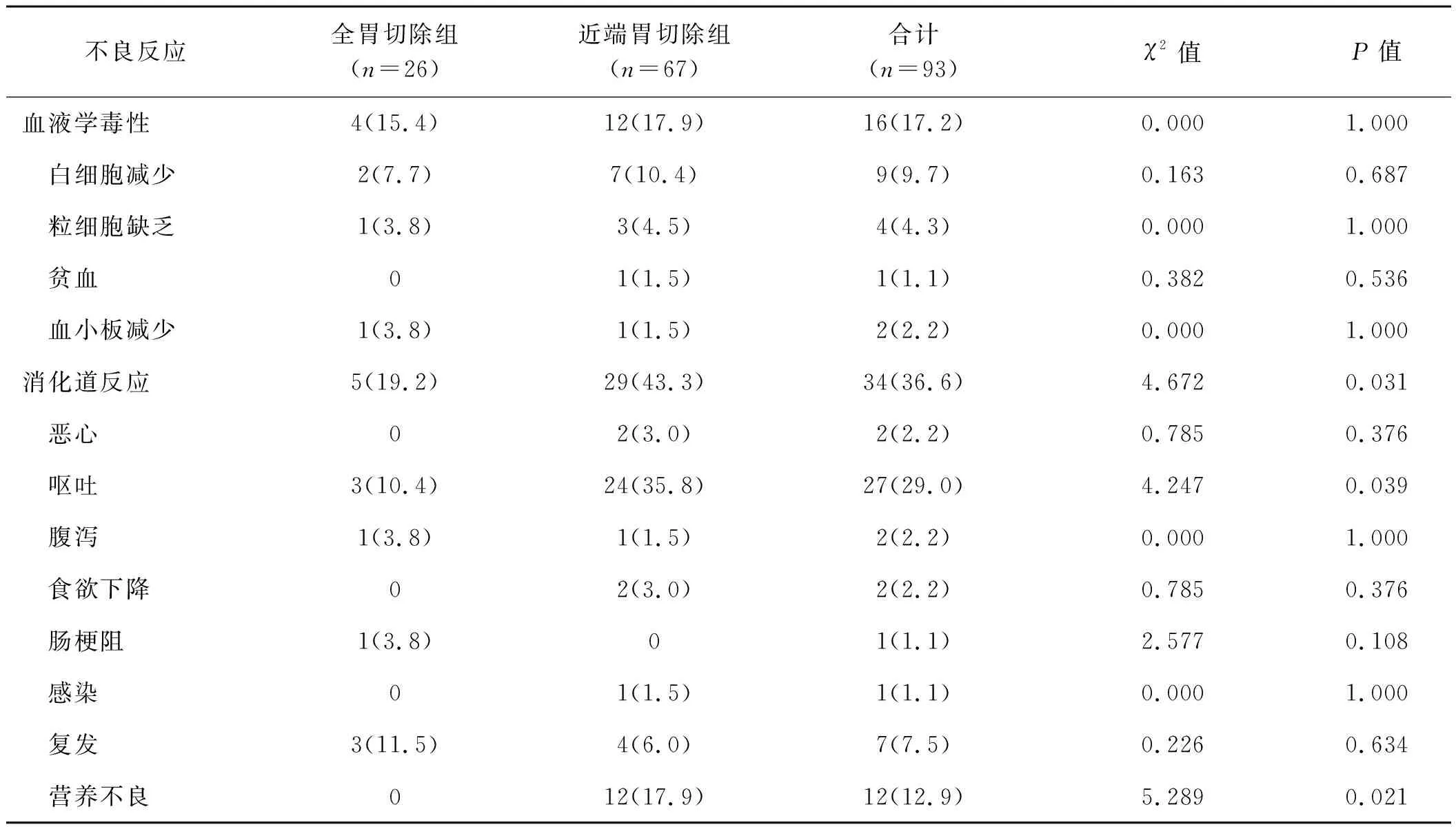
Tab 3 The major cause for termination of chemotherapy case
注:括号内为百分率
表4内镜评价例
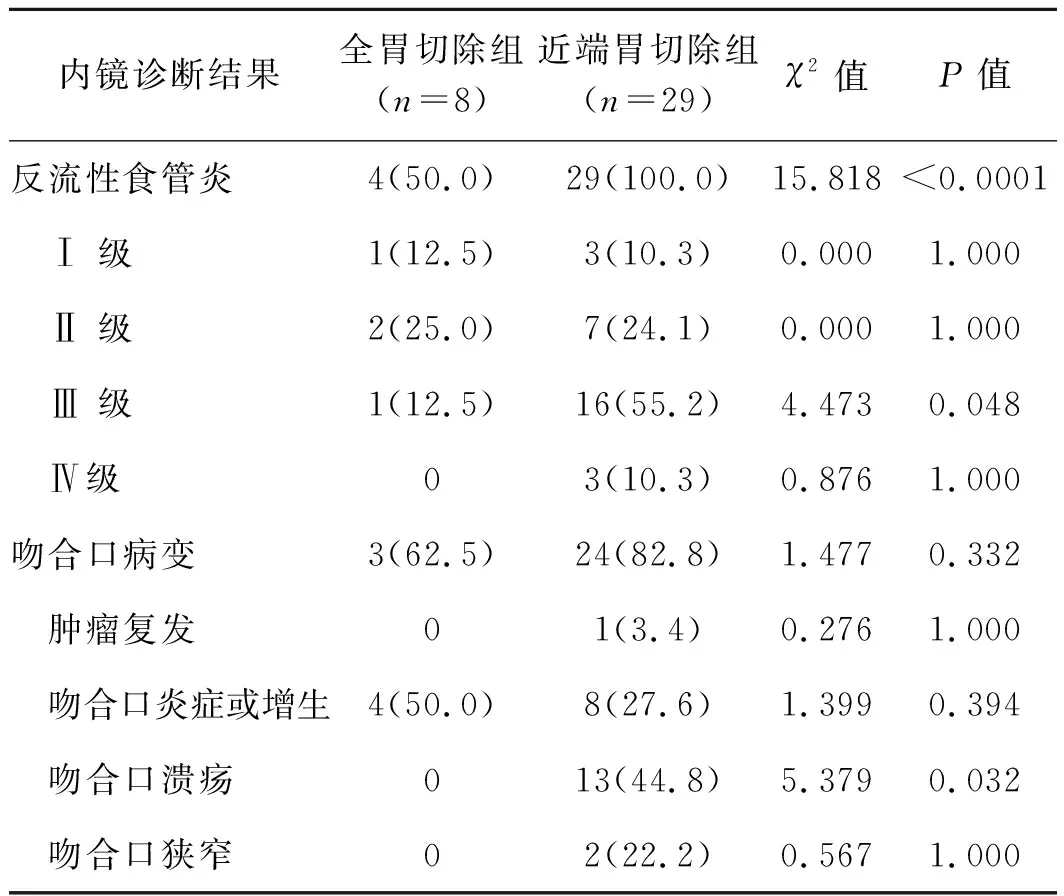
Tab 4 Endoscopic evaluationcase
注:括号内为百分率
3 讨 论
根治性手术是可切除胃癌的首选治疗方法[4],但有研究[5]认为,因为胃的多种淋巴引流途径使得术中淋巴结清扫术实施难度较大,导致胃癌术后有较高的局部复发率和转移率。日本手术切除胃癌患者 5 年生存率可达70.0%,这可能与日本早期胃癌的检出率高有关,另一方面则是对于进展期胃癌的规范化治疗,其中就包括胃癌术后的规范化疗。有研究报道术后化疗的胃癌病人有显著的生存优势[6],日本两项随访时间分别为3年和5年的临床试验[7- 8]亦证明,术后化疗较单纯手术可改善总生存率和无复发生存率。因此,术后化疗是胃癌的有效性治疗方案。
本研究回顾性分析了两种常见胃上部癌切除手术方法对术后辅助化疗耐受性的影响,近端胃切除的病例术后辅助化疗的完成率明显低于全胃切除组,严重消化道不良反应的发生率亦高,且高于血液学毒性。在导致化疗终止的病因中,消化道反应尤为突出,严重的呕吐反应给患者身心均带来了负面的影响,尤其是脱水及电解质的紊乱,导致化疗的不耐受。
我们在研究中观察到,近端胃切除组的患者存在营养不良的比率较高,甚至有相当一部分的患者化疗期间因严重的呕吐、恶心等反应,根本无法进食,需要静脉或肠内营养支持,而严重的营养不良对机体耐受化疗的毒副反应具有负面作用,因此,近端胃切除术后早期的营养状况不佳亦可导致化疗的不耐受。
另外,对于严重消化道不良反应的病例,我们进行了内镜检查,可明显观察到近端胃切除组病例术后反流性食管炎的发生率尤其Ⅲ级反流性食管炎的发生率明显高于全胃切除组,其吻合口溃疡发生率较高,所以,我们认为,近端胃切除这一术式既然因严重的不良反应而影响辅助化疗的完成率,且患者术后的生活质量降低,营养状况相对较差,进而影响生存及预后,那么这一术式的合理性应该得到质疑,胃上部癌的切除方式需要重新审视。
近端胃切除后食管胃吻合术简单、耗时短,是符合生理的近端胃切除消化道重建方式,术后发生吻合口漏的概率相对较小[9],所以这一术式临床应用广泛,但其缺点是术后反流性食管炎发生率较高。其主要原因有:(1) 手术切除了食管下端及胃食管结合部贲门,失去了生理抗反流功能;(2) 部分胃小弯及胃窦部的保留,致使胃泌酸功能未完全丧失[10];(3) 手术使残留胃腔减小以及幽门变形导致排空异常;(4) 切断迷走神经导致胃顺应性下降等,造成胃液反流入食管,破坏了食管胃吻合部的黏膜[11]。本研究发现,术后的严重反流及排空异常引起的消化道反应,严重干扰了辅助化疗的进行。
Katsoulis等[12]报道了8例近端胃切除后食管残胃吻合术的病例,随访6个月内均有不同程度的食管反流症状; Kim等[13]报道近端胃切除食管残胃吻合术后反流性食管炎发生率为48.8%(21/43)。为防止反流性食管炎的发生,近端胃切除术后的吻合方式有了很多改进,Zhang等[14]研究表明食管前壁与胃的端侧吻合联合幽门成形术能加快残胃排空速度,减轻术后胃潴留以及腹胀、恶心和呕吐症状,且术后Spitzer生活质量总体评分显著高于一般食管胃吻合术。Tokunaga等[15]的回顾性研究发现,空肠间置术较食管胃吻合术反流性食管炎的发生率低(P=0.001)。Sakuramoto等[16]报道26例近端胃切除加胃底部分折叠及胃固定术,术后随访1年,反流性食管炎的发病率为23.1%(6/26)。Matsui等[17]报道了6例近端胃切除后管状胃成形术,结果1例在术后6个月发生Ⅰ度反流性食管炎, 术后随访 25 个月内未见胃潴留、吻合口狭窄、吻合口漏等并发症发生,但这些改良的手术方式因手术复杂、难度大或因吻合口增多容易发生吻合口漏等术后并发症,临床并未得到推广应用。
胃上部癌的手术切除方式目前仍无统一的标准[18],Harrison等[19]认为,对于胃上部癌只要切缘距肿瘤有足够的距离,选用全胃或近端胃切除在患者的 5 年生存率、复发率和复发时间方面差异无统计学意义,但Parachriston等[20]认为无论那种手术方式,必需要完整地切除肿瘤,尽量避免有癌残留,这其中包括淋巴结清扫方面要彻底等。与袁晓东[21]的全胃切除术对于进展期远端胃癌具有更好的淋巴结优势的研究结果相类似,有研究显示近端胃切除术与全胃切除术相比切缘较近,清除淋巴结较少,且近端胃切除的术后并发症发生率高且对术后体质量减轻(营养状态)无益,因此认为近端胃切除术对上1/3胃癌来说,并不是更好的选择[22]。Wen 等[23]的一项 Meta 分析表明,近端胃切除术后复发风险较全胃切除后高,且术后吻合口狭窄及反酸率也明显增高,而两种手术方式术后 5 年生存率差异无统计学意义,推荐行全胃切除术。Bogoevski等[24]的研究发现,全胃切除术淋巴结清扫数量明显多于近端胃切除,5 年总体存活率分别为67.7%、57.8% 。Namikawa等[25]的研究表明全胃切除术后 1 年生活质量较近端胃切除术好,但营养指标无差异,且术后3 年及5 年后生活质量相似。
但以上这些研究的病例术后均未行化疗,不仅仅从术后并发症及生活质量的角度出发,考虑到辅助化疗的重要性,手术方式的长远影响应该得到重视。近端胃切除术因为生理结构的特殊改变,相比全胃切除术导致的术后反流情况明显增多,Mann 等[26]的研究也表明近端胃切除术后胆汁、碱性肠液长期反流并浸泡胃黏膜,使胃黏膜发生炎症、萎缩甚至肠腺化生等。而全胃切除后两吻合口距离较远且局段空肠的分泌量较少,反流性食管炎发生率相应减少,所以能够改善患者的生存质量并提高生存率,而吴星宇等[27]调查发现,胃上部癌的发病率正逐年上升,因此,这一类病例的手术方式值得进一步研究探讨。
总之,我们认为胃上部癌行全胃切除术清扫范围更大,不增加手术并发症,且术后反流性食管炎及吻合口炎发生较少,患者生活质量较高,最为重要的是,全胃切除术后辅助化疗的耐受相对较好,化疗完成率高,这对提高局部进展期胃上部癌的治愈率,降低术后复发率具有至关重要的意义。
[1] KATAI H,SANO T,FUKAGAWA T,et al.Prospective study of proximal gastrectomy for early gastric cancer in the upper third of the stomach[J].Br J Surg,2003,90(7):850- 853.
[2] YOO C H,SOHN B H,HAN W K,et al.Proximal gastrectomy reconstructed by jejunal pouch interposition for upper third gastric cancer:prospective randomized study[J].World J Surg,2005,29(12):1592- 1599.
[3] HOYA Y,MITSUMORI N,YANAGA K.The advantages and disadvantages of a Roux- en- Y reconstruction after a distal gastrectomy for gastric cancer[J].Surg Today,2009,39(8):647- 651.
[4] SAKURAMOTO S,SASAKO M,YAMAGUCHI T,et al.Adjuvant chemotherapy for gastric cancer with S- 1,an oral fluoropyrimidine[J].N Engl J Med,2007,357(18):1810- 1820.
[5] SASAKO M,SAKURAMOTO S,KATAI H,et al.Five- year outcomes of a randomized phase Ⅲ trialcomparing adjuvant chemotherapy with S- 1 versus surgery alone in stage Ⅱ or Ⅲ gastric cancer[J].J Clin Oncol,2011,29(33):4387- 4393.
[6] ZHANG J,CHEN R X,ZHANG J,et al.Efficacy and safety of neoadjuvantchemotherapy with modified FOLFOX7 regimen on the treatment of advanced gastric cancer[J].Chin Med J(Engl),2012,125(12):2144- 2150.
[7] VASILESCU C,POPA M,TUDOR S,et al.Robotic surgery of locally advanced gastric cancer- an initial experience[J].Acta Chir Belg,2012,112(3):209- 212.
[8] GASTRIC(Global Advanced/Adjuvant Stomach Tumor Research International Collaboration) Group,PAOLETTI X,OBA K,et al.Benefit of adjuvant chemotherapy for resectable gastric cancer:a meta- analysis[J].J Am Med Assoc,2010,303(17):1729- 1737.
[9] AN J Y,YOUN H G,CHOI M G,et al.The difficult choice between total and proximal gastrectomy in proximal early gastric cancer[J].Am J Surg,2008,196(4):587- 591.
[10] OTT K,LORDICK F,BLANK S,et al.Gastric cancer:surgery in 2011[J].Langenbecks Arch Surg,2011,396(6):743- 758.
[11] LUNDELL L,MIETTINEN P,MYRVOLD H E,et al.Seven- year follow up of a randomized clinical trial comparing proton- pump inhibition with surgical therapy for reflux oesophagitis[J].Br J Surg,2007,94(2):198- 203.
[12] KATSOULIS I E,ROBOTIS J F,KOURAKLIS G,et al.What is difference between proximal and total gastrectomy regarding postoperative bile reflux into the oesophagus?[J].Dig Surg,2006,23(5- 6):325- 330.
[13] KIM J H,PARK S S,KIM J,et al.Surgical outcomes for gastric cancer in the upper third of the stomach[J].Word J Surg,2006,30(10):1870- 1876.
[14] ZHANG H,SUN Z,XU H M,et al.Improved quality of life in patients with gastric cancer after esophagogastrostomy reconstruction[J].World J Gastroenterol,2009,15(25):3183- 3190.
[15] TOKUNAGA M,OHYAMA S,HIKI N,et al.Endoscopic evaluation of reflux esophagitis after proximal gastrectomy:comparison between esophagogastric anastomosis and jejunal interposition[J].World J Surg,2008,32(7):1473- 1477.
[16] SAKURAMOTO S,YAMASHITA K,KIKUCHI S,et al.Clinical experience of laparoscopy- assisted proximal gastrectomy with Toupet- like partial fundoplication in early gastric cancer for preventing reflux esophagitis[J].J Am Coll Surg,2009,209(3):344- 351.
[17] MATSUI H,IGARASHI N,ITANO O,et al.Laparoscopic function- preserving surgery for early gastric cancer in the upper third of the stomach:vagus- sparing proximal gastrectomy with side- to- side esophagogastric- tube anastomosis[J].Tokai J Exp Clin Med,2007,32(4):109- 114.
[18] TAKIGUCHI S,MASUZAWA T,HIRAO M,et al.Pattern of surgical treatment for early gastric cancers in upper third of the stomach[J].Hepatogastroenterology,2011,58(110- 111):1823- 1827.
[19] HARRISON L E,KARPEH M S,BRENNAN M F,et al.Total gastrectomy is not necessary for proximal gastric cancer[J].Surgery,1998,123(2):127- 130.
[20] PARACHRISTOU D N,FORTNER J G.Adenocarcinoma of the gastric cardia,the choice of gastrectom[J].Ann Surg,1980,192(1):58- 64.
[21] 袁晓东.进展期胃远侧癌的淋巴结转移和手术治疗[J].东南大学学报:医学版,2001,20(4):269- 270.
[22] JI Y A,HO G Y,MIN G C.The difficult choice between total and proximal gastrectomy in proximal early gastric cancer[J].Am J Surg,2008,196(4):587- 591.
[23] WEN L,CHEN X Z,WU B,et al.Total vs.Proximal gastrectomy for proximal gastric cancer.A systematic review and Meta- Analysis[J].Hepatogastroenterology,2012,59(114):633- 640.
[24] BOGOEVSKI D,BOCKHORN M,KOENIG A,et al.How radical should surgery be for early esophageal cancer[J].World J Surg,2011,35(6):1311- 1320.
[25] NAMIKAWA T,OKI T,KITAGAWA H,et al.Impact of jejunal pouch interposition reconstruction after proximal gastrectomy for early gastric cancer on quality of life:short- and long- termconsequences[J].Am J Surg,2012,204(2):203- 209.
[26] MANN N S,RACHUT E.Carcinoma of gastric stump cansing afferent loop obstruction and acute pancreatitis[J].Hepatogastroenterology,2004,51(55):184- 185.
[27] 吴星宇,席时富.胃癌病理学的变化及其与外科治疗的关系[J].现代医学,2004,32(6):399- 400.
