VEGF-C在宫颈癌细胞的表达及其与细胞黏附和侵袭的关系
2014-09-12田小飞韩志红刘爱兰
田小飞,韩志红,王 静,刘爱兰
(陕西省肿瘤医院妇科,陕西 西安 710061)
血管内皮生长因子-C (vascular endothelial growth growth factor-C,VEGF-C)是新近发现的特异性淋巴管生长因子,与肿瘤的淋巴转移相关。VEGF-C对肿瘤淋巴转移的机制,是否也与肿瘤细胞的黏附、侵袭等转移相关生物学行为的影响有关,目前相关研究报道很少。宫颈癌是妇科最常见的恶性肿瘤,其发病率在我国妇科恶性肿瘤中居首位。淋巴转移是宫颈癌的重要转移途径,也是影响患者预后的重要因素。对宫颈癌淋巴转移机制的研究,为靶向性阻断宫颈癌淋巴转移的可行性提供实验依据。
1 材料和方法
1.1 材料
Matrigel(Collaborative Research公司),ECM胶E1270(Sigma公司),纤维粘连蛋白FN(Roche公司),反义VEGF-C寡核苷酸链:5’-CCCAGCCTTCCAGCTCCTTG-3’,两端各3个碱基进行硫代修饰,目标核苷酸232~251,在5’端标记FITC,随机链序列为:5’-CAGCTCCTGTCCAGCCTCTC-3’,两端各3个碱基进行硫代修饰;阳离子脂质体LipofectamineTM2000(Invitrogen公司,系尹如铁副教授惠赠);Transwell小室(3428型,孔径8um,Corning-Costar公司),VEGF-C及内参照GAPDH的引物均由华西医院眼科实验室协助设计,其氨基酸序列及其产物长度如下(见表1)。
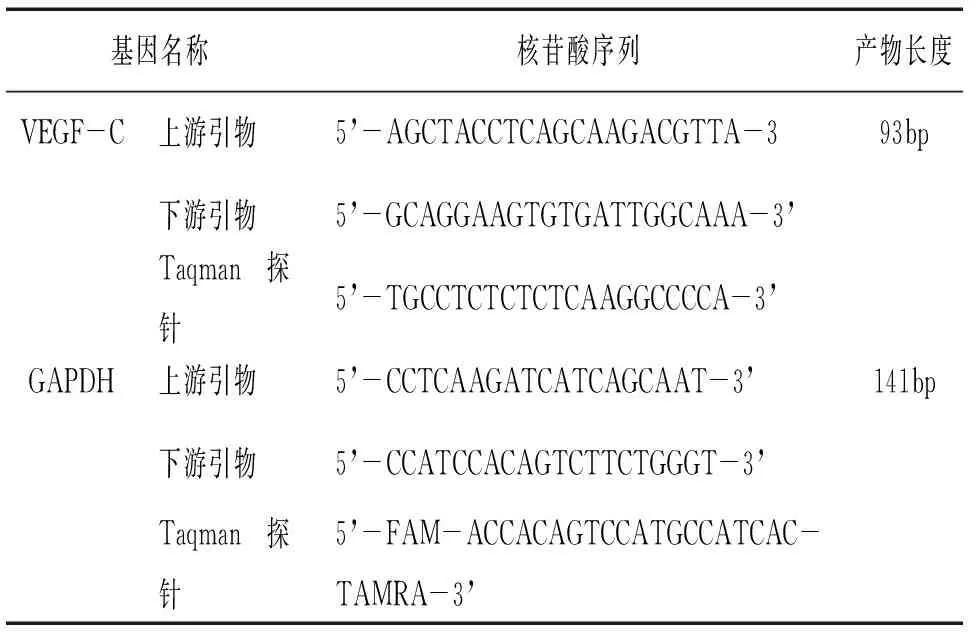
表1 引物核苷酸序列及长度
2 方法
2.1 应用脂质体介导VEGF-C反义寡核苷酸转染HeLa细胞
人宫颈癌HeLa细胞培养采用高糖DMEM细胞培养基,含有10%的小牛血清,常规培养。将处于对数生长期HeLa细胞,将反义寡核苷酸链、正义链按终浓度为600 nmol/L分别用不含血清和抗生素的高糖DMEM培养基稀释,将LipofectamineTM2000和寡核苷酸比例为2.5∶1比例混合,避光静置20 min后转染细胞,同时以未转染细胞作为对照组。首次转染以5’端标记FAM的反义寡核苷酸链进行转染,转染6 h后加入完全培养基,在荧光显微镜下观察转染效果,通过细胞内荧光多少初步判断转染是否成功。
2.2 肿瘤细胞对细胞外基质的黏附实验
包被基底膜:配制以下3种溶液:10 g/L BSA;50 mg/L Matrigel 1∶2稀释液;10 mg/L FN。水化基底膜:吸取培养板中的残余液体,每孔加入50 ul含10 g/L BSA的无血清高糖DMEM培养液,孵育30 min后接种细胞:调整细胞密度为1×105/ ml,分别将100 ul细胞悬液,接种到包被了BSA、Matrigel和FN的96孔板,每组平行6个样本。MTT比色法检测:测定各组细胞的光吸收值(OD值),计算细胞黏附率。黏附率=(OD值实验组-OD值BSA组)/OD值BSA组×100%
2.3 细胞体外侵袭力测定(按操作说明书进行)
小鼠成纤维细胞系NIH3T3采用RPMI-1640培养液培养,待长势良好时换无血清培养液培养24 h后,收集上清液备用。200 ul/孔细胞外基质包被Transwell小室底部。6孔板中加入培养基水化基底膜30 min。吸弃培养液,加入1∶1条件培养液和完全培养液2.5 ml于下室。接种转染细胞2×105/孔于上室,培养24 h、48 h,每组设三个复孔。取出小室,用棉签擦去上室中的细胞,酒精固定、苏木素染色、伊红再染色,梯度酒精脱水,取下膜,中性树胶固定封片。在400倍光镜下随机取5个视野计数穿膜细胞数,取其平均值代表侵袭力的值。
2.4 统计学处理
所有资料均用SPSS10.0软件包进行处理,采用t检验和方差分析进行统计学分析,检验水准定0.05,若P<0.05,认为差异具有统计学意义。
3 结果
3.1 VEGF-C在宫颈癌HeLa细胞中的表达
实验中采用阳离子脂质体转染宫颈癌Hela细胞,免疫组化学检测可见VEGF-G在细胞浆内表达,以浆内呈现棕黄色颗粒为阳性(图1)。荧光显微镜下显示VEGF-C转染效率>90%。

A VEGF-C在宫颈癌Hela细胞中的表达400× B FAM标记的反义寡核苷酸转染6 h后Hela细胞400×
3.2 反义寡核苷酸转染前后HeLa细胞黏附能力的变化
从图2可以看出,反义组的黏附率较对照组和正义组明显降低,统计学处理差异具有统计学意义(P<0.05)。而对照组和正义组间也存在差异,但没有统计学意义(P>0.05)。各组细胞对两种细胞外基质的黏附能力也不同,经方差分析,两种基质的黏附能力间存在的差异,具有统计学意义(P<0.05)。
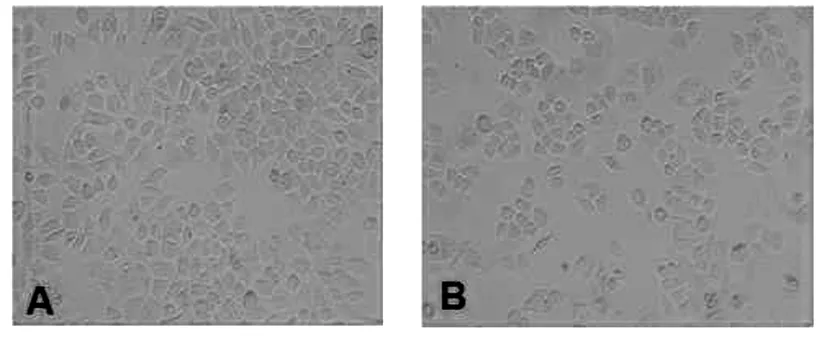
A Hela细胞粘附实验 B 反义寡核苷酸转冻后Hela细胞粘附实验

C 转染后各组细胞粘附率
3.3 寡核苷酸转染前后HeLa细胞侵袭能力的影响
Transwell侵袭小室的多孔滤膜经过HE染色,可以看到细胞质呈粉红色,细胞核呈蓝紫色,穿过微孔滤膜的细胞形态没有变化。三组细胞的侵袭能力,通过计数穿过微孔滤膜的细胞数目来检测,具体见下(图3)。随着作用时间延长,穿过重组基底膜的细胞数是增加的。在各组细胞的比较中,经统计学处理,在各个时间点,反义组和对照组、正义组间的差异具有统计学意义(P<0.05),而对照组和正义间的差异没有统计学意义(P>0.05)(见表2)。

A 未转染Hela细胞穿膜48 h HE×400 B 反义寡核苷酸转染后Hela细胞穿膜48 h HE×400

表2 不同时间三组细胞的穿膜细胞数
3 讨论
3.1 VEGF-C在肿瘤细胞中的表达
1996年Joukou等[1]利用受体和色谱法,从人类的前列腺癌细胞株PC-3的cDNA文库中,克隆并分离出了VEGF家族的新成员VEGF-C。Ueda等[2]观察16种妇科肿瘤细胞(鳞癌 SKG-I、SKG-II、SKG-IIIa、SKG-IIIb、OMC-1、YUMPTO、QG-U等,腺癌 HOKUG、NUZ、OMC-4、CAC-1等)的VEGF-C的表达和侵袭活性的关系;本实验采用了免疫细胞化学法,直观观察到VEGF-C在宫颈癌HeLa细胞的强阳,宫颈癌HeLa细胞是腺癌细胞,有很强的侵袭和黏附能力。
3.2 VEGF-C反义寡核苷酸对细胞的黏附的影响
肿瘤细胞从母体脱离后,侵袭基底膜及细胞外基质,使肿瘤扩散和转移。已有研究证实了[3],肿瘤细胞运动能力的强弱与其侵袭能力呈现正相关。肿瘤细胞只有与细胞外基质成分粘连,才能实现肿瘤细胞的侵袭和转移,阻断肿瘤细胞与细胞外基质的黏附过程,可以影响肿瘤的转移。本实验中,检测各组细胞转染了VEGF-C反义寡核苷酸,对细胞外基质(FN)和Matrigel胶(富含层粘连蛋白LN)的黏附能力的改变,可以看到转染了VEGF-C反义寡核苷酸的HeLa细胞组的黏附率明显下降。这说明VEGF-C与细胞对周围基质的黏附能力有关。但具体调节机制还不清楚。曲明阳[4]等人将VEGF-C反义寡核苷酸转染入乳腺癌细胞MDA-MB-435,细胞的黏附和侵袭能力下降,同时也下调了MMP-2蛋白的表达。MMP-2是基质金属蛋白酶家族的重要成员,在多种人类肿瘤中表达,通过调控肿瘤细胞与基底膜的黏附及破坏由细胞间质、基底膜组成的细胞外基质屏障参与肿瘤的转移。
3.3 VEGF-C反义寡核苷酸对细胞的侵袭的影响
体外侵袭的研究方法,人工基底膜实验,现是国内外应用最广泛的体外侵袭模型。Transwell侵袭小室的多孔聚碳酸酯滤膜上的孔径是8ul,被基底膜ECM覆盖后,肿瘤细胞不能自由穿过。肿瘤细胞在由小鼠成纤维细胞NIH3T3,制备的条件培养液的趋化和诱导下,可以穿过多孔滤膜。通过观察穿过Transwell侵袭小室的多孔滤膜的细胞数目,了解细胞的侵袭能力。Stacker[5]等观察到肿瘤细胞穿过重组基底膜的能力与其体内侵袭能力,表现出较好的相关性,因而用来研究体外细胞的侵袭能力。本实验采用Transwell侵袭小室方法,将ECM胶铺在Transwell侵袭小室的多孔滤膜上,能形成与天然基底膜极为相似的基底膜结构。ECM胶,是从小鼠的Engelbreth Holm-Swarm(EHS)sarcoma 中提取的基质成分,含有LN、VI型胶原等。本实验采用小鼠成纤维细胞NIH3T3,起到趋化,计数穿过滤膜的细胞数,观察各组细胞的侵袭能力,转染了VEGF-C反义寡核苷酸组的侵袭力是明显受到抑制。
3.4 VEGF-C与肿瘤的转移机制的关系
肿瘤转移时受多因素影响和多基因调控,与肿瘤细胞自身的生物学特征、肿瘤细胞与周围间质间的相互作用有关。错综复杂的转移过程,可能涉及到多种基因的相互协调、多基因产物的相互作用。VEGF-C促进肿瘤淋巴转移的可能机制[6]:(1)肿瘤细胞分泌的VEGF-C与淋巴管内皮细胞VEGFR-3结合,VEGFR-3开始自身磷酸化,启动淋巴管内皮细胞的增殖,促进肿瘤周围毛细淋巴管的增生和扩张,而淋巴管的数量与淋巴结转移状况呈现正相关。增生的淋巴管没有完整的基底膜,内皮细胞间存在暂时裂隙,淋巴管的通透性增高,利于瘤细胞进入。增生的淋巴管为肿瘤的生长提供了营养,同时增加了瘤细胞与淋巴管的接触面积,使肿瘤细胞的侵袭和转移的机会增加。(2)肿瘤细胞分泌的VEGF-C与自身的VEGFR-3的结合,使肿瘤细胞特异性的黏附到淋巴管内皮细胞上,导致转移开始阶段的发生。(3)VEGF-C作为一种趋化因子,使肿瘤细胞以淋巴管为靶向转移,在一定程度上增加了肿瘤的特异器官的亲和性;而且VEGF-C改变了淋巴管内皮细胞的黏附特性,也改变细胞因子、趋化因子的表达,促进肿瘤细胞的转移播散。VEGF-C激活淋巴内皮,后者分泌某些细胞因子,对肿瘤细胞也产生趋化作用。(4)VEGF-C通过刺激内皮细胞产生一氧化氮NO,调节淋巴管的收缩。(5)VEGF-C作用下,淋巴内皮细胞局部释放旁分泌因子,影响肿瘤细胞的转移相关生物学特性黏附、迁移、侵袭等,从而促进转移。(6)分泌VEGF-C并转移到淋巴结的肿瘤细胞,由于能同时刺激淋巴管和血管内皮细胞的增殖,具有生长优势。
参考文献:
[1] Joukov V,Pajusola K,Kaipainen A,et al.A novel vascular endothelial growth factor,VEGF-C is a ligand for the Flt-4(VEGFR-3) and KDR(VEGFR-2) receptor tyrosine kinases [J].The EMBO Journal,1996,15(2):290-298.
[2]Ueda M,Terai Y,Yamashita Y,et al.Correlation between Vascular endothelial growth facter-C expression and invasion phenotype in cervical carcinomas[J].Int j cancer 2002,98(3):335-343.
[3]王文萍.实用肿瘤转移学[M].辽宁:科学技术出版社,2002.
[4]曲明阳,刑光明,冯秉安.VEGF-C反义寡核苷酸对乳腺癌细胞MDA-MB-435黏附、侵袭能力的影响[J].实用肿瘤杂志,2005,20(1):21-24.
[5]Stacker SA,Baldwin ME,Achen MG.The role of tumor lym phangiogenesis in metastatic spread[J].FASEB J,2002,16(9):922-934.
[6]Hsieh CY,Chen CA,Chou CH,et al.Overexpression of Her-2/NEU in epithelial ovarian carcinoma induce vascular endothelial growth factor c by activating NF-kappa B: implication for malignant ascites formation and tumor lymphangiogenesis[J].J Biomed Sci,2004,11(2):249-259.
