Notch通路对乙醛激活大鼠肝星状细胞株的增殖及转分化的影响
2014-09-12陈川宁陶忠桦
肖 斌 陈川宁 陶忠桦 李 洪
(泸州医学院新校区生物化学教研室及医学分子生物学实验室,四川 泸州 646000)
肝纤维化进展的中心环节是肝星状细胞(HSC)的激活、增殖与转分化〔1,2〕。酒精性肝损害是造成肝纤维化的主要病因之一〔3〕。激活HSC导致酒精性肝纤维化发生的关键分子是乙醛〔3~5〕。TGF-β1/Smad3信号通路是研究最为广泛、最为透彻的引起HSC增殖活化和肝纤维化的信号途径,Notch通路与肝纤维化的关系尚不明确。本文拟探讨Notch通路对乙醛激活大鼠HSC细胞株的增殖及转分化存在的影响。
1 材料与方法
1.1主要材料 肝星状细胞株HSC-T6,购自中南大学湘雅医学细胞中心;DMEM高糖型培养基(GIBCO公司);优级胎牛血清(Hyclone公司);MTT试剂泸州医学院中心实验室提供;40%乙醛购自天津石英钟厂;鼠Ⅰ型胶原蛋白(TIMP Ⅰ)、纤维黏连素(FN) ELISA试剂盒(美国ADL公司);ReverTra Ace组合型RT-PCR试剂盒(BioBRK公司);引物(上海生工);内参鼠 β-actin(北京三博远志);TRIzol、预染Marker、Taq PCR MasterMix(TianGen公司);内参α-Tubulin抗体(Beyotime公司);α-SMA多克隆抗体(ABZOOM公司);辣根过氧化物酶(HRP)标记山羊抗兔IgG(Cell Signaling);蛋白质Marker(BIO-RAD公司),化学发光试剂盒(ECL,Pierce公司)。
1.2方法
1.2.1细胞培养及分组 以10%胎牛血清DMEM培养基培养细胞,CO2培养箱(5% CO2)、37℃,1~2 d换液,2~3 d细胞传代,0.25%胰酶消化细胞5~10 min,Hank液终止反应。随机分为对照组和乙醛刺激组,每组又随机分为4组:空白组、TGF-β阻断组(SB-431542 10 μmol/L)、Notch阻断组(DAPT 200 nmol/L)和TGF+Notch阻断组(SB-431542 10 μmol/L + DAPT 200 nmol/L),每组至少三个样本。调整细胞计数为(1~2)×105后,各组细胞培养至融合度70%~80%时,0.4%胎牛血清DMEM培养基同步化处理细胞12 h后,更换完全培养基。对照组常规培养,刺激组在对应的抑制剂预处理1 h后给予乙醛刺激(终浓度200 μmol/L),每12 h补加一次,刺激24 h。24 h后(共培养时间72 h)收集各组细胞及培养上清液。
1.2.2MTT试验 调整细胞计数接种于96孔板内,分组培养。加入乙醛刺激后12、24 h各收集一次。每孔总体积为200 μl,每孔加MTT溶液20 μl,继续37℃孵育4 h后,吸弃孔内上清液。每孔加150 μl DMSO,孔板摇床低速振荡10 min,使结晶物充分融解。酶标仪双波长测定OD值,测定波长570 nm,参考波长630 nm,酶标仪所示OD值为OD570-OD630,以消除非特异性光吸收效应。重复3次,每次3复孔,取3次平均值。
1.2.3ELISA试验 收集分组细胞培养上清液,每组至少3复孔。取出酶标板,依照次序对应分别加入50 μl的标准品于空白微孔中;分别标记样品编号,加入50 μl样品于空白微孔中;在样品孔中加入10 μl的生物素标记液;在标准品孔和样品孔中加入50~100 μl的酶标记液;37℃孵育反应60 min;在孔板摇床上用洗涤液清洗5次,每次静置10~20 s;每孔加入底物(显色剂)A、B液各50 μl;37℃避光孵育反应15 min;每孔加入50 μl终止液,终止反应。于酶标仪上以波长450 nm测定各孔的OD值。实验重复3次,取3次实验的平均值。
1.2.4半定量逆转录-PCR(RT-PCR) ①提取总RNA:冰上收集细胞加入1 ml冰TRIzol匀浆,依次经氯仿、异丙醇等抽提总RNA。②RT反应体系20 μl:总RNA X μl (<1 μg),RNase free H2O(11-X)μl,5×RT 缓冲液4 μl,dNTP Mixture(每个 10 mmol/L)2 μl,Super-RI 0.5 μl,RT-Enhancer 0.5 μl,Oligo(dT)18 (50 pmol/μl) 1 μl,ReverTra Ace 1 μl。反应条件:30℃ 10 min,42℃30 min,99℃5min,4℃5 min。③PCR反应体系20 μl:RT产物2 μl,RNase free H2O 6 μl,2×Taq PCR Mastermix 10 μl, 上、下游引物(10 pmol/μl)各1 μl。反应条件:预变性94℃ 2 min,变性94℃ 30 s,退火58℃ 30 s,延伸72℃ 60 s,循环数30个,延伸72℃5 min。引物序列及扩增产物见表1。反应结束后,取5 μl PCR产物与上样缓冲液混匀,与PCR-Marker一起,在含1 mg/ml溴乙锭的3%琼脂糖凝胶中电泳,在紫外透射仪下观察结果,并用Quantity One分析软件拍照分析。

表1 引物序列及扩增产物长度
1.2.5Western 印迹检测效应蛋白α-SMA的表达 分组培养、收集细胞。冰上刮取细胞,加入预冷细胞裂解液,总量控制在300 μl,冰上振摇裂解30 min。4℃ 12 000 r/min离心30 min,取上清液。考马斯亮蓝G-250法测定蛋白质含量,并制备上样液。采用10%SDS-PAGE垂直平板电泳分离蛋白质,每孔蛋白上样量为50 μg,浓缩胶80 V,分离胶120 V,电泳2~3 h后停止,并电转至PVDF膜上。经Western封闭液(5% BSA配制)封闭后,与α-SMA抗体孵育过夜,HRP标记山羊抗兔IgG 37℃振摇孵育1 h。在红光源条件下将等量的化学发光A液和B液混合,润透PVDF膜后室温作用1 min,暗室中Kodak X-ray film 压片,放射自显影5 min。定影后所得免疫印迹图谱用Quantity One软件分析,用每个目的蛋白条带的灰度扫描值对比相应的内参α-Tubulin条带的灰度值,得到目的蛋白灰度的标化值。实验重复3次,取3次实验的平均值。
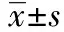
2 结 果
2.1MTT法检测细胞增殖 结果显示,阻断剂组间细胞活性基本一致,加入阻断剂细胞活性明显下调,双阻断组细胞活性下调明显;较对照组有明显上调。见表2。
2.2ELISA法检测TIMP-Ⅰ、FN 各阻断组二者明显下调,双阻断组下调更明显,单阻断组间含量基本一致。见表3。
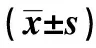
表2 mTT检测不同组别大鼠HSC-T6培养72 h后的MTT测定结果
2.3RT-PCR检测Notch通路节点分子RBP-JK、Hes1及Smad3 见图1,表4~表6。
RBP-JK结果显示,乙醛刺激组与对照组相应组间上调显著性不大(P>0.05);阻断组较空白组下调明显(P<0.05),双阻断较单阻断组下调更为明显(P<0.05);单阻断组间差异不大(P>0.05)。Hes1结果显示,乙醛刺激组较对照组显著上调(P<0.05);TGF-β和Notch通路阻断对乙醛刺激引起的Hes1上调均有明显的抑制作用(P<0.05),单阻断组间有差异性,以Notch单阻断下调为主(P<0.05);双阻断与单阻断组比较抑制作用更为明显(P<0.05)。

图1 不同阻断条件下RBP-JK、Hes1及Smad3的PCR 图谱
Smad3结果显示,乙醛刺激组较对照组Smad3有明显上调(P<0.05);TGF-β和Notch通路阻断明显下调乙醛刺激对Smad3转录水平(P<0.05);单阻断组间差异性不大(P>0.05),双阻断组较单阻断的Smad3下调更为明显(P<0.05)。
2.4Western 印迹方法检测效应蛋白α-SMA 乙醛刺激明显促进α-SMA上调表达量(P<0.05);TGF-β和Notch通路阻断明显抑制乙醛刺激对α-SMA的表达(P<0.05),双阻断组及Notch单阻断组抑制α-SMA蛋白表达更为明显(P<0.05)。见图2,表7。
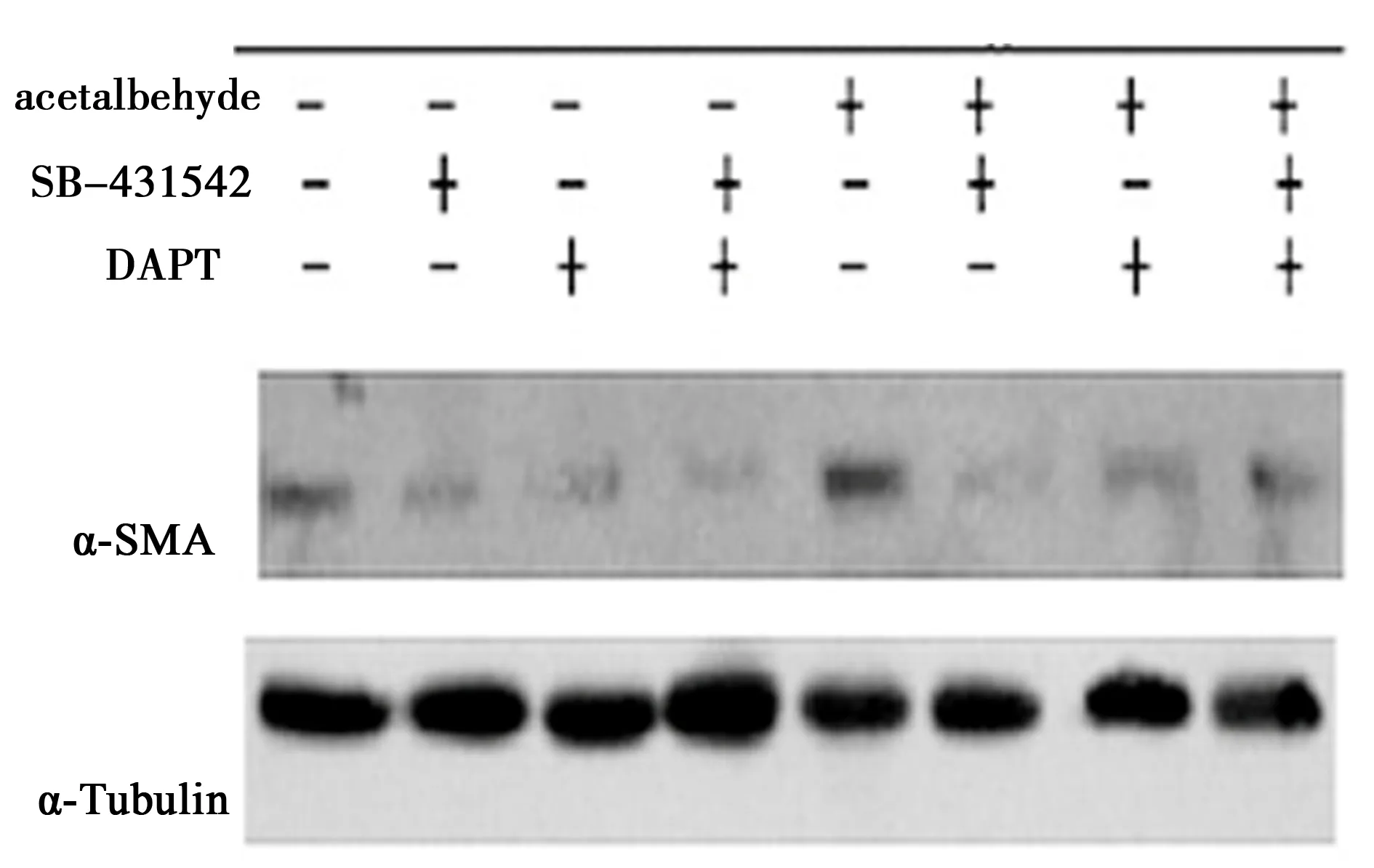
图2 不同阻断条件下α-SMA的Western印迹
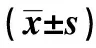
表3 不同组别大鼠HSC-T6培养72 h后的TIMP Ⅰ、FN测定结果
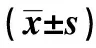
表4 不同阻断条件下RBP-JK的PCR 相对灰度值
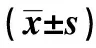
表5 不同阻断条件下Hes1的PCR相对灰度值
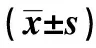
表6 不同阻断条件下Smad3的PCR 相对灰度值
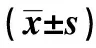
表7 不同阻断条件下α-SMA的Western印迹相对灰度值
3 讨 论
各种损伤刺激通过不同或相同的HSC信号通路介导了HSC的激活,并使其转化为肌成纤维细胞,合成大量细胞外基质成分(ECM)。胶原代谢的异常和ECM构成变化是肝纤维化形成的主要特征,现已证明HSC是主要的ECM 生成细胞,其激活和分泌活动增加是肝纤维化病理发生机制的重要环节〔6〕。
本文结果表明两种阻断剂作用的TGF通路与Notch通路介导的细胞信号转导途径均可抑制HSC增殖活性,而且两条通路间可能存在协同作用;发现TGF通路与Notch通路介导的细胞信号转导途径对ECM的表达均有调节作用,但是以TGF-β通路介导的细胞信号转导途径为主,也说明Notch通路介导的细胞信号转导途径对HSC增殖有着非常重要的作用。
在哺乳动物和人类Notch配体为Jaggedl〔7〕。Notch与Jagged1结合后,分三步酶切(S1、S2、S3位点三步裂解)后,释放Notch受体胞内区的活化形式(NICD)直接进入细胞核,通过其RAM结构域与DNA结合蛋白RBP-Jk/CBF-1相互作用,调节下游转录因子的表达水平〔8〕。
本实验表明,在TGF-β通路中的HSC活化后可加入拮抗剂阻止Hes1表达,TGF-β通路对Notch通路在Hes1的调节可能具有协同作用。Smad3-mRNA水平也出现同样的结果,提示Jagged1/Notch信号通路和由TGF-β/Smad3介导的转录因子Hes1转录阻遏存在着协调性〔9〕。
目前公认的肝纤维化形成机制是从HSC的瀑布样激活效应开始的。TGF-β激活HSC的信号转导经过丝氨酸/苏氨酸蛋白激酶受体及其下游效应分子,即Smads蛋白家族,启动胶原基因表达〔10〕。
HSC激活并转变成具有增生活性的、产生纤维的具有收缩特性的肌成纤维细胞,表达α-SMA合成大量细胞外基质ECM。因此,α-SMA被认为是HSC活化的标志〔11〕。阻断Notch通路对TGF-β通路活化导致α-SMA效应蛋白增加也有明显的下调作用,说明Notch通路对α-SMA具有调节作用;双阻断较TGF-β单阻断对α-SMA表达上调的抑制作用更明显,表明二种阻断剂具有协同作用,但作用机制尚不明确,有待进一步的后续实验阐明。
TGF-β1是致纤维化的关键因子,由于TGF-β及其胞内信号分子Smads作用广泛,单纯抑制引起严重后果,长期直接干预TGF-β及其下游分子Smads可出现严重不良反应〔12〕;另外,由于TGF-β对维持成纤维细胞表型没有显著作用〔13〕。因此,针对TGF-β及Smads治疗仅阻断纤维化起始及过程,不能逆转纤维化〔14〕。
4 参考文献
1Lata J.Chronic liver diseases as liver tumor precursors〔J〕.Dig Dis,2010;28(4-5):596-9.
2Kim KY,Rhim T,Choi I,etal.N-acetylcysteine induces cell cycle arrest in hepatic stellate cells through its reducing activity〔J〕.J Biol Chem,2001;276(44):40591-8.
3Ha MH,Wei L,Rao HY,etal.Effect of interferon-gamma on hepatic stellate cells stimulated by acetaldehyde〔J〕.Hepatogastroenterology,2008;55(84):1059-65.
4Zheng SM,Jiang MD,Zeng WZ,etal.Effects of extracellular signal-regulated kinase on rat cultured hepatic stellate cells stimulated by acetaldehyde〔J〕.J Dig Dis,2007;8(3):148-53.
5Tang W,Jiang MD,Li XA.Effects of sp600125 on acetaldehyde stimulated hepatic stellate cells〔J〕.Zhonghua Gan Zang Bing Za Zhi,2009;17(10):792-3.
6González-Puertos VY,Hernández-Pérez E,Nuäo-Lámbarri N,etal.Bcl-2 overexpression in hepatic stellate cell line CFSC-2G,induces a pro-fibrotic state〔J〕.J Gastroenterol Hepatol,2010;25(7):1306-14.
7Mayani H.Notch signaling:from stem cell expansion to improving cord blood transplantation〔J〕.Expert Rev Hematol,2010;3(4):401-4.
8Ehm O,Göritz C,Covic M,etal.RBPJkappa-dependent signaling is essential for long-term maintenance of neural stem cells in the adult hippocampus〔J〕.J Neurosci,2010;30(41):13794-807.
9Nyhan KC,Faherty N,Murray G,etal.Jagged/Notch signalling is required for a subset of TGF-β1 responses in human kidney epithelial cells〔J〕.Biochim Biophys Acta,2010;1803(12):1386-95.
10Sapitro J,Dunmire JJ,Scott SE,etal.Suppression of transforming growth factor-β effects in rabbit subconjunctival fibroblasts by activin receptor-like kinase 5 inhibitor〔J〕.Mol Vis,2010;16(16):1880-92.
11Jotzu C,Alt E,Welte G,etal.Adipose tissue-derived stem cells differentiate into carcinoma-associated fibroblast-like cells under the influence of tumor-derived factors〔J〕.Anal Cell Pathol,2010;33(2):61-79.
12Wahdan-Alaswad RS,Song K,Krebs TL,etal.Insulin-like growth factor I suppresses bone morphogenetic protein signaling in prostate cancer cells by activating mTOR signaling〔J〕.Cancer Res,2010;70(22):9106-17.
13Lee Y,Friedman SL.Fibrosis in the liver acute protection and chronic disease〔J〕.Prog Mol Biol Transl Sci,2010;97(1):151-200.
14Connolly MK,Bedrosian AS,Malhotra A,etal.In hepatic fibrosis,liver sinusoidal endothelial cells acquire enhanced immunogenicity〔J〕.J Immunol,2010;185(4):2200-8.
