虫草素对小鼠脑缺血再灌注损伤的神经保护作用及炎症调节
2014-09-12欧阳波余顺治
邓 昌 欧阳波 陶 然 余顺治 金 华
(昆明市官渡区人民医院急诊科,云南 昆明 650200)
脑缺血再灌注损伤的机制十分复杂,涉及一系列的病理生理变化,多种生物活性因子和细胞内多条信号转导途径参与其中,如自由基的产生、细胞内钙稳态的失衡、能量障碍、细胞炎症、凋亡基因的激活和自噬的发生等〔1〕。其中炎症反应在脑缺血再灌注损伤的发生发展中起着重要作用〔2〕。脑缺血再灌注发生时,中性粒细胞和胶质细胞等炎症细胞会被激活,白介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)、白介素10(IL-10)和转化生长因子β1(TGF-β1)等细胞因子参与其炎症应答过程〔3,4〕。许多实验研究发现,阻断脑缺血再灌注引发的炎症应答过程对脑组织具有保护作用〔2,5〕。因此,采取有效的干预措施阻断炎症应答过程,减轻神经细胞的损伤,是防治脑缺血再灌注损伤的一个重要策略。蛹虫草是一种虫草属真菌,作为我国传统中药材的主要成分之一,被广泛用于炎症性疾病和癌症的治疗〔6〕。虫草素是蛹虫草的主要活性成分,具有抗菌、抗炎症和清除活性氧自由基等作用〔7〕。研究发现,虫草素具有神经保护作用,但对其在脑缺血再灌注损伤中的作用及机制尚不清楚〔8〕。本研究旨在观察虫草素对小鼠脑缺血再灌注损伤后神经功能障碍及梗死灶体积的影响,探讨其可能的作用机制,为虫草素用于缺血性脑卒中的治疗提供实验依据。
1 材料与方法
1.1主要试剂 MCAO栓线购于北京沙东生物技术有限公司;虫草素和2,3,5-氯化三苯基四氮唑(TTC)购于美国Sigma公司;NF-κB p65和Lamin B抗体购于美国Santa Cruz公司。其余药品和试剂均为国产,分析纯。
1.2实验动物分组及给药 雄性C57BL/6小鼠96只,随机分为假手术组(Sham)、模型组(Model)和虫草素预处理组(Cor),其中Sham组有12只,Model和Cor组各有42只。各组根据不同时间点又分为缺血2 h(h)后再灌注0 h、6 h、12 h、24 h组。脑缺血再灌注损伤模型制作之前,Cor组小鼠经灌胃给予虫草素(10 mg/kg)7 d,每天一次。Model组小鼠接受生理盐水灌注,其余过程与Cor组相同,Sham组不进行脑缺血再灌注损伤,其余过程与Model组相同。
1.3动物模型的制作 本实验采用线栓法制备大脑中动脉阻塞模型,术中以肛温计监测体温,并用白炽灯加热维持肛温在36℃~37 ℃。根据Longa线栓法加以改进〔9〕。采用直径0.32的栓线,采用戊巴比妥钠(50 mg/kg)腹腔注射麻醉,钝性分离右侧颈总动脉、颈外动脉和颈内动脉后,结扎颈外动脉,在颈外动脉近分叉处剪一切口,从中把栓线送入大脑中动脉起始处,固定栓线,2 h后抽出栓线制备再灌注损伤模型。Sham组只分离右侧颈总动脉、颈外动脉和颈内动脉,不闭塞大脑中动脉。
1.4神经功能缺损评分 脑缺血再灌注24 h后,采用Longa评分法对各组小鼠进行行为学评分〔9〕。该评分法分为5个等级:0分,正常,无神经功能缺损;1分,不能完全伸展对侧前爪;2分,行走时,向对侧转圈,中度神经功能缺损;3分,行走时,向对侧倾倒,重度神经功能缺损;4分,不能自发行走,意识丧失。
1.5脑梗死体积的计算 小鼠脑缺血再灌注24 h后,断头、取脑,将脑组织置于-20℃中冷冻20 min后,置于脑切片模具内,从额极开始由前向后间隔1 mm冠状切取脑组织,置于37℃的2%氯化三苯四氮唑(TTC)溶液中染色30 min。脑切片排序、拍照并输入计算机,通过图像分析系统对切片梗死体积和全脑梗死体积计算,各样本以脑梗死体积/全脑体积比作为统计数据。
1.6脑组织IL-1β、TNF-α、IL-10和TGF-β1的检测 小鼠脑缺血再灌注0 h、6 h、12 h和24 h后,断头开颅取闹,分离缺血侧大脑皮层组织。将皮层组织用4℃生理盐水迅速制成1∶9匀浆液,3 000 r/min离心15 min,取上清液,采用ELISA法用于IL-1β、TNF-α、IL-10和TGF-β1含量的检测,操作过程严格按照试剂盒说明书(博士德生物工程有限公司,武汉)的要求进行。
1.7蛋白免疫印迹 小鼠脑缺血再灌注24 h后,断头开颅取闹,分离缺血侧大脑皮层组织。采用核蛋白与胞浆蛋白提取试剂盒(博士德生物工程有限公司,武汉)制备核蛋白提取液,用于NF-κB活性的检测。具体过程如下:BCA法行蛋白定量分析;配制10% SDS-PAGE进行电泳分离后,将蛋白质电转至PVDF膜中;用10 %的脱脂奶4 ℃封闭过夜。然后分别加入NF-κB p65 (1∶500)和Lamin B(1∶1 000)的一抗封闭1 h,TTBS洗膜3次,每次5 min,加入辣根过氧化物酶耦联的IgG抗体,于室温轻摇1 h杂交反应,TTBS洗膜6次,每次5 min;加入化学发光底物反应5 min后保鲜膜包裹,暗室内进行X线胶片曝光、显影和定影。
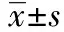
2 结 果
2.1虫草素改善脑缺血再灌注损伤所致的神经功能障碍与Sham组(0分)比较,脑缺血再灌注24 h后,Model组〔(3.3±0.5)分〕小鼠的神经功能缺损严重;而虫草素的预处理(Cor组)〔(1.6±0.4)分〕可以显著地改善脑缺血再灌注损伤所致的神经功能障碍。
2.2虫草素减少脑梗死灶体积 与Sham组相比,脑缺血再灌注24 h后,Model组(33%±4%)小鼠梗死灶体积显著地增加;而与Model组比较,虫草素的预处理(Cor组)(18%±2%)可以显著地缩小脑缺血再灌注所致的梗死灶体积。
2.3虫草素降低促炎症细胞因子的表达 如图1所示,Model组小鼠在脑缺血再灌注0和6 h后,缺血侧皮层组织中IL-1β和TNF-α的表达水平显著增加;在脑缺血再灌注12 h后,IL-1β和TNF-α的表达水平开始下降。而与Model组相比,虫草素的预处理(Cor组)可以显著减低缺血侧皮层组织中IL-1β和TNF-α的表达水平。
2.4虫草素增加抗炎症细胞因子的表达 如图1所示,Model组小鼠在脑缺血再灌注0、6、12和24 h后,缺血侧皮层组织中IL-10和 TGF-β1的表达水平显著增加,并都在6 h达到最高水平。而与Model组相比,虫草素的预处理(Cor组)可以显著增加缺血侧皮层组织中IL-10和 TGF-β1的表达水平。
2.5虫草素阻止NF-κB的活化 如图2所示,与Sham组相比,Model组小鼠脑缺血再灌注24 h后,NF-κB的活性增强。而虫草素的预处理(Cor组)可以抑制NF-κB的活性。

与Sham组比较:1)P<0.05;与Model组比较:2)P<0.05

图2 虫草素对缺血侧皮层组织细胞核内NF-κB水平的影响
3 讨 论
虫草素能抑制链球菌和炭疽杆菌等病菌的生长,具有抗癌活性,对内分泌系统和神经系统具有调节作用。虫草素的生物学功能主要依赖于其自身的抗氧化作用和抗炎症活性。虫草素的预处理可以减少血小板衍生生长因子所致氧自由基的产生〔10〕。虫草素能抑制IL-1β介导的炎症应答过程〔11〕。研究发现,虫草素可以保护沙鼠的海马神经元免受脑缺血损伤,但对其在小鼠脑缺血再灌注损伤中的作用及机制目前还不清楚〔8〕。在本实验中,虫草素能通过抵抗炎症反应改善小鼠脑缺血再灌注损伤所致的行为障碍,减少脑梗死体积。
炎症反应是脑缺血再灌注损伤的重要原因之一〔12〕。脑缺血时血液炎症细胞向脑内浸润,胶质细胞被激活,引发脑组织炎症反应的失控,加重脑缺血再灌注损伤〔2,13〕。细胞因子在脑缺血的炎症应答过程中扮演着十分重要的作用。脑缺血会导致IL-1β和TNF-α等促炎症因子的表达上调〔13~15〕。在短暂性局部脑缺血模型中IL-1β和TNF-α的表达被上调,并在再灌注数小时内达到顶峰。IL-1β和TNF-α对脑缺血时嗜中性粒细胞的浸润和胶质细胞的激活起着十分关键的作用,IL-1β或TNF-α的抑制剂可以缓解脑缺血损伤〔16,17〕。脑缺血后炎症应答过程所致的损伤程度主要取决于促炎症因子的级联反应和抗炎症因子的诱导作用〔2〕。抗炎症因子IL-10和 TGF-β1对缓解脑缺血再灌注损伤具有重要的调控作用,外源性IL-10和 TGF-β1的给予可以抵抗脑缺血再灌注损伤〔18~21〕。许多研究已证实,IL-10能抑制促炎症因子的产生〔22〕。在本实验中,虫草素能显著地上调抗炎症因子IL-10和 TGF-β1的表达,并抑制促炎症因子IL-1β和TNF-α的表达。从中可推测,虫草素可能通过抑制炎症反应过程,阻止嗜中性粒细胞的浸润和胶质细胞的激活,从而起到脑保护作用。
NF-κB是细胞内重要的核转录因子,广泛分布于神经元、小胶质细胞和星形胶质细胞中。NF-κB的激活可以诱导多种促炎症因子的表达,促进炎症反应。静息状态下,NF-κB与其抑制因子IκB结合成复合物存在于细胞质中。在应激条件下,NF-κB被激活,进入细胞核,从而促进相关基因的表达。许多研究证实,脑缺血会导致NF-κB的活化,诱导多种促炎症因子的表达,如IL-1β和TNF-α〔23,24〕。在本实验中,脑缺血再灌注时细胞核内NF-κB的含量显著地增加,NF-κB被活化。这一结果与脑缺血再灌注所致IL-1β和TNF-α的上调具有同向变化趋势。而虫草素能显著得抑制NF-κB的活化。这些研究结果表明,虫草素可能通过抑制NF-κB的活化,下调促炎症因子IL-1β和TNF-α的表达,从而抑制炎症反应。
本研究表明,虫草素对脑缺血再灌注损伤所致的炎症反应具有抑制作用,可能通过降低促炎症因子的表达,增加抗炎症因子的表达,抑制NF-κB的活化,进而起到脑保护作用。这些研究结果表明虫草素可应用于脑缺血性卒中的治疗。
4 参考文献
1Noorian R,Nogueira AR,Gupta R.Neuroprotection in acute ischemic stroke〔J〕.J Neurosurg Sci,2011;55(2):127-38.
2Wang Q,Tang XN,Yenari MA.The inflammatory response in stroke〔J〕.J Neuroimmunol,2007;184(1-2):53-68.
3Durukan A,Tatlisumak T.Acute ischemic stroke:overview of major experimental rodent models,pathophysiology,and therapy of focal cerebral ischemia〔J〕.Pharmacol Biochem Behav,2007;87(1):179-97.
4Han HS,Yenari MA.Cellular targets of brain inflammation in stroke〔J〕. Curr Opin Investig Drugs,2003;4(5):522-9.
5Amantea D,Nappi G,Bernardi G,etal.Post-ischemic brain damage:pathophysiology and role of inflammatory mediators〔J〕.FEBS J,2009;276(1):13-26.
6Ng TB,Wang HX.Pharmacological actions of Cordyceps,a prized folk medicine〔J〕.J Pharm Pharmacol,2005;57(12):1509-19.
7Feng X.Regulatory roles and molecular signaling of TNF family members in osteoclasts〔J〕.Gene,2005;350(1):1-13.
8Hwang IK,Lim SS,Yoo KY,etal.A phytochemically characterized extract of Cordyceps militaris and cordycepin protect hippocampal neurons from ischemic injury in gerbils〔J〕.Planta Med,2008;74(2):114-9.
9Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-91.
10Won KJ,Lee SC,Lee CK,etal.Cordycepin attenuates neointimal formation by inhibiting reactive oxygen species-mediated responses in vascular smooth muscle cells in rats〔J〕.J Pharmacol Sci,2009;109(3):403-12.
11Noh EM,Kim JS,Hur H,etal.Cordycepin inhibits IL-1beta-induced MMP-1 and MMP-3 expression in rheumatoid arthritis synovial fibroblasts〔J〕.Rheumatology (Oxford),2009;48(1):45-8.
12Benakis C,Bonny C,Hirt L.JNK inhibition and inflammation after cerebral ischemia〔J〕.Brain Behav Immun,2010;24(5):800-11.
13Ye XH,Wu Y,Guo PP,etal.Lipoxin A4 analogue protects brain and reduces inflammation in a rat model of focal cerebral ischemia reperfusion〔J〕.Brain Res,2010;1323:174-83.
14Davies CA,Loddick SA,Toulmond S,etal.The progression and topographic distribution of interleukin-1beta expression after permanent middle cerebral artery occlusion in the rat〔J〕.J Cereb Blood Flow Metab,1999;19(1):87-98.
15Zhang Z,Chopp M,Goussev A,etal.Cerebral vessels express interleukin 1beta after focal cerebral ischemia〔J〕. Brain Res,1998;784(1-2):210-7.
16Loddick SA,Turnbull AV,Rothwell NJ.Cerebral interleukin-6 is neuroprotective during permanent focal cerebral ischemia in the rat〔J〕.J Cereb Blood Flow Metab,1998;18(2):176-9.
17Barone FC,Arvin B,White RF,etal.Tumor necrosis factor-alpha.A mediator of focal ischemic brain injury〔J〕.Stroke,1997;28(6):1233-44.
18Zhang RL,Chopp M,Chen H,etal.Temporal profile of ischemic tissue damage,neutrophil response,and vascular plugging following permanent and transient (2H) middle cerebral artery occlusion in the rat〔J〕.J Neurol Sci,1994;125(1):3-10.
19Frenkel D,Huang Z,Maron R,etal.Nasal vaccination with myelin oligodendrocyte glycoprotein reduces stroke size by inducing IL-10-producing CD4+ T cells〔J〕.J Immunol,2003;171(12):6549-55.
20Ooboshi H,Ibayashi S,Shichita T,etal.Postischemic gene transfer of interleukin-10 protects against both focal and global brain ischemia〔J〕. Circulation,2005;111(7):913-9.
21Pang L,Ye W,Che XM,etal.Reduction of inflammatory response in the mouse brain with adenoviral-mediated transforming growth factor-ss1 expression〔J〕.Stroke,2001;32(2):544-52.
22Moore KW,de Waal Malefyt R,Coffman RL,etal.Interleukin-10 and the interleukin-10 receptor〔J〕.Ann Rev Immunol,2001;19:683-765.
23Nurmi A,Lindsberg PJ,Koistinaho M,etal.Nuclear factor-kappaB contributes to infarction after permanent focal ischemia〔J〕. Stroke,2004;35(4):987-91.
24Stephenson D,Yin T,Smalstig EB,etal.Transcription factor nuclear factor-kappa B is activated in neurons after focal cerebral ischemia〔J〕. J Cereb Blood Flow Metab,2000;20(3):592-603.
