预防性绿茶多酚干预对帕金森病小鼠多巴胺能神经元的保护作用
2014-09-12黄雪芳刘承伟
叶 俊 陈 敏 黄雪芳 刘承伟
(桂林医学院附属医院急诊科,广西 桂林 541004)
帕金森病(PD)是中老年人常见的中枢神经系统变性疾病,其发病机制至今尚未阐明,在早期如何通过一系列的干预手段预防或延缓PD的发生发展则具有重大意义。目前倾向于认为氧化应激水平的提高是PD重要的病理生理机制之一〔1~3〕。在氧化应激时,与幼年动物相比,老年动物对蛋白质的损伤更敏感,并且动物暴氧化应激状态时所导致的酶学改变与衰老时变化相似。绿茶多酚(GTPs)是一种抗氧化剂,是绿茶中所提取的多酚类化合物,含丰富的儿茶素,其中以表没食子儿茶素没食子酸酯(EGCG)含量最多,占儿茶素含量的50%~60%,被认为是GTPs的主要活性物质,具有抗氧化、清除自由基的积极作用〔4,5〕,在许多神经变性疾病中显示出神经保护作用。本研究以神经毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)注射C57BL/6J老年小鼠建立PD模型,研究预防性GTPs干预是否存在对PD老年模型多巴胺能神经元存在更好的保护和修复作用并进一步探讨其可能作用机制。
1 材料与方法
1.1实验动物 健康雄性C57BL/6J小鼠,SPF级,18月龄60只,体重20~25 g,由北京华阜康生物科技股份有限公司提供,许可证编号:SCXK(京)2009-0004;饲养条件:桂林医学院SPF级实验动物饲养室,许可证号:SYXK桂2007-0001。饲以实验动物中心提供的饲料(成分为大米粉、玉米粉、鱼粉等)。自由摄食、饮水,适应环境1 w后进行实验。实验室温度25℃~28℃,通风、自然采光。
1.2主要试剂 GTPs,由浙江东方茶业科技有限公司提供, 生产批号为20070518, GTPs纯度100%,其中EGCG 含量为70.75%。MPTP购自Sigma公司。兔抗酪氨酸羟化酶抗体(TH)由Bioworld 公司提供,超氧化物歧化酶(SOD)试剂盒和丙二醛(MDA)试剂盒均购自南京建成公司。其他试剂均为国产或进口分析纯。
1.3动物分组及处理 随机分成预防组、MPTP组、治疗组和空白对照组,各组均为15只。MPTP处理方式为腹腔注射MPTP(30 mg/kg),1次/d,连续7 d;GTPs干预方式为在小鼠饮水中掺入GTPs,浓度为0.1%(W/V)。
模型组:每日上午MPTP处理。预防组:注射MPTP前3个月开始GTPs干预MPTP处理。治疗组:MPTP处理后开始GTPs干预3个月。空白对照组:腹腔注射同体积的生理盐水,连续7 d。
1.4黑质多巴胺能神经元数目测定 各组动物各取7只进行免疫组织化学方法测定黑质多巴胺能神经元数目。麻醉动物后以4%多聚甲醛经心灌注断头取脑后固定,常规脱水,石蜡包埋,连续冠状切片(片厚4 μm),隔三取一,后行TH染色:二甲苯梯度脱蜡,无水乙醇,95%乙醇,蒸馏水进行水化处理,0.01 mol/L PBS洗3次;切片甩干,用免疫组化专用油笔在脑切片周围画圈;3%过氧化氢室温孵育30 min;0.01 mol/L PBS洗3次;加封闭液室温20 min;加TH(1∶200)4℃过夜; 0.01 mol/L PBS洗3次;加二抗(1∶200)室温,2 h孵育;0.01 mol/L PBS洗3次;加链霉亲和素标记的辣根过氧化物酶(1∶100),室温1 h。DAB液显色3~10 min;PBS终止反应;苏木素复染5 min;梯度酒精脱水,中性树脂封片。
1.5SOD和MDA水平测定 各组动物各取8只进行SOD和MDA水平测定。小鼠迅速断头取脑,冰上分离中脑腹侧组织,吸干称重后置于匀浆器内充分匀浆,低温 14 000 r/min离心30 min,参照试剂盒说明书分别测定氧化应激标志物SOD和脂质过氧化物MDA水平。
2 结 果
2.1黑质多巴胺能神经元计数结果 TH阳性神经元胞体聚集于黑质致密区(SNc),突起密集分布于黑质网质区(SNr)。与空白对照组TH阳性细胞数量(235±22.5)比较,预防组(201±20.5)、治疗组(185±21.9)、MPTP组(150±23.2)均明显降低(P<0.01),但预防组降低幅度最小。见图1。
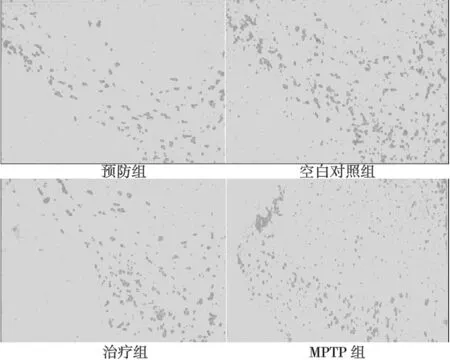
图1 小鼠脑组织黑质TH疫组织化学染色(×100)
2.2SOD和MDA水平测定 MPTP组、预防组和治疗组SOD水平均较空白对照组降低(P<0.01),而MDA水平则相反(P<0.01),变化幅度预防组<治疗组 表1 各组SOD和MDA测定结果 PD是与衰老密切相关的神经系统退行性疾病,平均发病年龄为60周岁,故而本实验选择老年动物建立模型,力求最大限度接近PD真实的发病背景。衰老与氧化应激反应之间的密切关系已被许多实验所研究并证实。衰老是由于自由基进攻细胞,过度氧化所致。随着年龄增长自由基清除剂活性下降,大量有害自由基会破坏组织细胞,组织器官的机能逐步发生紊乱及障碍,过多的活性氧自由基就会有破坏行为,导致人体正常细胞和组织的损坏,心脏病、老年痴呆症、PD和肿瘤等疾病就会接踵而来。 以MPTP成功诱导C57BL/6J老年小鼠建立经典的亚急性PD模型后用GTPs进行干预,发现GTPs能够有效减少MPTP造成的黑质多巴胺神经元的丢失、降低SOD及提高MDA水平和活性,增加抗氧化能力,尤其是在损伤前使用GTPs干预的预防组各项指标均优于GTPs后处理的治疗组。 PD特征性病理变化为黑质多巴胺能神经元的大量变性缺失,当达到60%~80%水平时就会出现静止性震颤、肌强直、运动迟缓等典型症状。本实验应用GTPs干预后证实GTPs能够减少多巴胺能神经元的缺失起到保护作用,而在损伤前进行预防性用药则能达到更佳效果。PD发病机制至今不甚明了,但是随年龄增长同时升高的氧化应激水平已为大多数学者所关注和认同的研究热点〔6〕。抗氧化是预防衰老的重要步骤,因为自由基或氧化剂会将稀薄的组织分解,影响代谢功能,并会引起不同的健康问题。 SOD和MDA等抗氧化指标的测定是研究氧化应激水平的常用手段。EGCG是GTPs的重要活性成分,主要以原型存在于血液和靶器官中,且能够通过血脑屏障(BBB)进入神经系统〔7〕,成为其发挥神经保护作用的前提。预防性使用GTPs,将整体内环境包括神经系统在内的抗氧化能力和清除自由基的功能〔8〕在病变之前先提升到更高水平或减少由衰老所致过多的氧自由基,降低体内自由基水平,同时促进内源性抗氧化酶如SOD的生成,从而提高发生病理改变的阈值,在同等的致病条件下能降低被损伤程度和范围,最大限度的保护包括黑质多巴胺能神经元在内的神经系统,其效果远远大于病变之后的治疗性用药的神经修复作用。外源性补充GPTs,通过抗氧化、抗炎等广泛的生物活性途径对多巴胺能神经元进行保护和修复,作为防治PD及其他神经系统退行性疾病可能的安全的潜在性途径,具有良好的研究价值和应用前景。 4 参考文献 1ChenWQ,Zhao XL,Hou Y,etal.Protective effects of green tea polyphenols on cognitive impairments induced by psychological stress in rats〔J〕.Behav Brain Res,2009;202(1):71-6. 2Avila I,Reilly MP,Sanabria F,etal.Modeling operant behavior in the Parkinsonian rat〔J〕.Behav Brain Res,2009;198(2):298-305. 3Sanyal J,Bandyopadhyay SK,Banerjee TK,etal.Plasma levels of lipid peroxides in patients with Parkinson ′s disease〔J〕.Eur Rev Med Pharmacol Sci,2009;13(2):129-32. 4Guo Q,Zhao B,Li M,etal.Studies on protective mechanisms of four components of green tea polyphenols against lipid peroxidation in synaptosomes〔J〕.Biochim Biophys Acta,1996;1304(3):210-22. 5Nanjo F,Goto K,Seto R,etal.Scavenging effects of tea catechins and their derivatives on 1,1-diphenyl-2-picrylhydrazyl radical〔J〕.Free RadBiol Med,1996;21(6):895-902. 6Raut A,Ratk A.Oxidative damage and sensitivity to nociceptive stimulus and opioids in aging rats〔J〕.Neurobiol Aging,2009;30 (6):910-9. 7Abdelmohsen MM,Kuhnle G,Rechnner AR,etal.Uptake and metabolism of epicatechin and its access to the brain after oral ingestion〔J〕.Free Radic Biol Med,2002;33(12):1693-702. 8Ounjaijean S,Thephinlap C,Khansuwan U,etal.Effect of green tea on iron status and oxidative stress in iron-loaded rats〔J〕.Med Chem,2008;4(4):365-70.
3 讨 论
