GnRH/EGFP转基因对雌性大鼠黄体生成素分泌的影响
2014-09-12薛昊罡盖晓东孙维琦齐明宇
薛昊罡 盖晓东 孙维琦 历 春 齐明宇
(北华大学附属医院骨外科,吉林 吉林 132001)
青春期启动是以促性腺激素释放激素(GnRH)脉冲式规律性的释放为标志,在大鼠中,下丘脑释放GnRH与黄体生成素(LH)分泌至血浆有着重要的关系〔1,2〕,这表明LH的分泌是评价GnRH释放的一个理想的指标。本文采用重复取静脉血样的方法来测定其LH的分泌水平。
1 材料与方法
1.1实验动物 所有WISTAR-IMAMICH大鼠均购自上海斯莱克实验动物有限责任公司,许可证号为SCXK(沪)2010-008,所有试验用鼠均在清洁级动物房饲养和繁殖,饲养条件为(27±1)℃,湿度70%±4%。每日自然光照,正常饮食喂养。
1.2试剂与材料 PMSG、HCG购自浙江宁波激素制品厂;M16、M2、透明质酸酶及矿物油为美国sigma公司产品;0.9%生理盐水、75%酒精均自行配制。
1.3方法
1.3.1通过对WISTAR-IMAMICH大鼠受精卵进行显微注射和胚胎移植方法建立GnRH/EGFP转基因大鼠 ①显微操作和胚胎移植:将优质单细胞受精胚胎按每批30~40枚置于Olympus倒置显微镜下进行雄原核显微注射。为最大限度确保所得试验数据的一致性,排除注射针的影响,整个试验中使用的是同一批次制备的规格基本一致的注射针,并用IM-300自动注射仪控制相同的注射压力和剂量。注射后胚胎转入新鲜的M16培养滴中,在37℃、5%CO2培养箱中培养60 min。培养后倒置显微镜下检查和记录胚胎存活数。以具有完整卵胞质膜、正常卵周隙判断为存活,胞质扩散、卵周隙消失的则为死亡胚胎〔3〕。②胚胎移植:存活的单细胞胚胎经输卵管移植到同期发情的假孕受体WISTAR-IMAMICH大鼠体内,双侧移植,每侧8~12枚。移植后19~22 d记录产子数〔4〕。③首建大鼠PCR整合检测:抽提仔鼠尾组织DNA,并根据显微注射序列设计一对特异性引物,上游5′-CGCTCGAGTTCCTTCACAGTAAAGGG-3′;下游:5′-CGGGATCCTCTGGGACACTGAAGTCT-3′。
1.3.2分组 选择8~13月龄的GnRH/EGFP转基因雌性大鼠,选择相同月龄WISTAR-IMAMICH雌性大鼠作为对照组,其中GnRH/EGFP转基因雌性大鼠8只,平均月龄(11.7±0.60)个月;WISTAR-IMAMICH雌性大鼠6只,平均月龄(12.1 ±0.24)个月;选择8~13月龄的GnRH/EGFP转基因雄性大鼠14只,平均月龄(10.6±0.8)个月,选择相同月龄WISTAR-IMAMICH雄性大鼠7只作为对照组,平均月龄(11.2±0.16)个月。GnRH/EGFP转基因雌性大鼠及其对照WISTAR-IMAMICH大鼠在(1.8±0.20)或(1.9±0.30)月龄行卵巢切除;而GnRH/EGFP转基因雄性大鼠及其对照WISTAR-IMAMICH大鼠在(2.0±0.58) 或(2.6±0.60)月龄进行阉割。
1.3.3样品收集 在大鼠右心房颈静脉表面插入导管3~5 d后,于8∶00~12∶00收集血样1 ml,0、12、24、36、48、60、72、84、96、108、120、132、144、156、168、180 min各取样1 ml,血标本保存于-20℃冰箱备检。
1.3.4雌二醇诱导的GnRH峰评价 卵巢切除4 d后,大鼠皮下注射1 μg苯甲酸雌二醇;7 d后,再给予盐酸苯丙烯啶以诱导LH峰。
1.3.5交配诱导GnRH峰评价 经卵巢切除12 d后,雌性转基因大鼠(9∶00)皮下注射2 μg苯甲酸雌二醇,14 d后注射苯甲酸雌二醇500 μg(9∶00)。4 h后,将雌性大鼠与已证实的种公合笼进行2 h的交配实验,并作为未交配对照。实验结束后迅速将实验动物进行安乐死,并保留其躯干、血液和大脑。
1.3.6LH测定 血清LH水平用双抗体RIA测定,每个血标本均进行2管测定,取其平均值。
1.3.7c-fos免疫组化 雌二醇诱导组与交配诱导组大鼠的下丘脑切开,4%多聚甲醛固定,常规石蜡包埋,切片,用于光镜及免疫组化研究。

2 结 果
2.1脉冲式LH变化情况 由图1和图2可知非转基因对照大鼠的脉冲式LH分泌较转基因雌性大鼠的LH分泌更明显。经统计发现两组大鼠的平均LH浓度和LH脉冲幅度无明显差异,但是转基因雌性大鼠的LH脉冲频率明显低于雌性对照组大鼠(P<0.05)。这种差异在图中主要体现在转基因雌性大鼠中仅出现一次脉冲,而对照组WISTAR-IMAMICH雌性大鼠的脉冲次数则达到了3~5次,平均(4.1±0.5)次。
LH脉冲同样也在阉割的雄性转基因和非转基因大鼠中出现(图3、图4)。所有的雄性大鼠在3个小时的取样监测中出现了至少2次的LH脉冲(2~6次脉冲),其中转基因雄性大鼠平均LH脉冲为(2.8±0.7)次,而对照组雄性大鼠的平均LH脉冲次数则达到了(2.3±0.9),两组雄性大鼠的LH浓度、LH脉冲幅度及LH脉冲频率均无明显差异(P>0.05)。
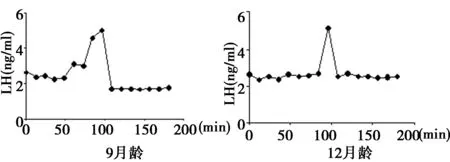
图1 GnRH/EGFP转基因雌性大鼠经卵巢切除后的LH分泌情况

图2 非转基因WISTAR-IMAMICH雌性大鼠经卵巢切除后的LH分泌情况
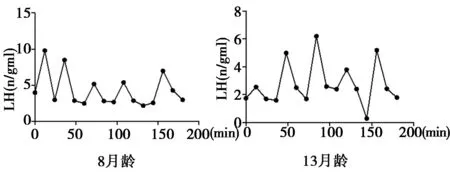
图3 GnRH/EGFP转基因雄性大鼠阉割后的LH分泌情况

图4 非转基因WISTAR-IMAMICH雄性大鼠阉割后的LH分泌情况

图5 脑组织神经元荧光金和EGFP标记
2.2脑组织神经元荧光金和EGFP标记 采用荧光金(FG)逆行追踪法观察5只雌性大鼠的1 208个GnRH神经元、4只雄性大鼠的1 310个GnRH神经元,见图5。经统计,每只雌性大鼠中被荧光金标记的神经元达(112±36)个,检测率为(41.9±5.7)%;雄性大鼠达(99±20)个,检测率为(38±7.2)%。
2.3雌二醇、交配诱导的GnRH分泌变化 在转基因雌性大鼠中雌二醇诱导LH分泌随时间的变化情况,其中12∶00的LH浓度较低〔(1.41±0.32)ng/ml〕,第一次明显增加是在16∶00〔(6.82±0.72)ng/ml〕,直至22∶00 LH水平仍然处于较高水平〔(6.47±0.68)ng/ml〕,其中19∶50的LH水平最高〔(13.76±1.35)ng/ml〕。在转基因雌性大鼠中雌二醇诱导激活了70%的GnRH神经元。
在转基因雌性大鼠中交配诱导的LH分泌水平明显高于未交配的雌性WISTAR-IMAMICH大鼠〔(1.36±0.42)ng/ml〕。发生交配的雌性大鼠的60%GnRH神经元被激活。
3 讨 论
目前的研究结果显示GnRH/EGFP转基因雌性大鼠的阵发性GnRH分泌的脉冲频率明显下降(仅1次),而正常对照雌性大鼠的脉冲频率则与文献报道一致〔5,6〕。本研究中转基因雌性大鼠的下丘脑组织中标记上荧光金的EGFP-GnRH神经元比例与文献中所报道的转基因和非转基因大鼠相一致〔7,8〕,并且与转基因雄性大鼠也相接近。鉴于在去势大鼠中观察到的GnRH与LH分泌之间的关系〔1,2〕,本研究说明GnRH/EGFP转基因雌性大鼠GnRH神经元GnRH分泌水平下降。
在本研究中,激素诱导和交配诱导均可引起GnRH峰。这说明脉冲频率的减少并不能反映雌性大鼠的激素分泌对其整体的影响。在引起GnRH峰期间,c-fos在含有EGFP的GnRH神经元中的表达与下丘脑对激素和交配刺激引起的GnRH峰是一致的。综合起来看,虽然卵巢切除大鼠的激素分泌下降,但是表达有EGFP的GnRH神经元却可以发生交配诱导的神经内分泌反射。在这方面,最近有文献报道即使相对较少的GnRH神经元仍可以支持其GnRH分泌功能〔9〕。转基因雌性大鼠在内源激素刺激、外源激素治疗及交配等三种状况下会发生强烈的激素激增。
引起转基因雌性大鼠LH搏动下降的原因目前尚未清楚。本研究中雄性大鼠正常的间断性激素分泌可能本质上并非是由于EGFP在神经元中的表达,这可能是多种内部和外部因素共同作用的结果,其中一些内部或外部因素可能是调节激素搏动性分泌的主要因素。最近的相关研究表明〔10〕GnRH-EGFP转基因雌性大鼠的GnRH神经元的受体表达较复杂。而这些受体可能在雌性大鼠激素搏动性分泌中起着重要的作用。另外,GnRH神经元需要整合到多种内部或外部因素影响的下丘脑回路中(雌、雄各不相同)。据文献证实GnRH神经元的分布较为广泛〔11〕,转基因和非转基因大鼠的单个GnRH神经元的高斯分布情况比较类似。但是,在下丘脑上解剖定位GnRH神经元中起到生殖调节作用的准确位置却很难。
4 参考文献
1Levine JE, Ramirez VD. Luteinizing hormone-releasing hormone release during the rat estrous cycle and after ovariectomy, as estimated with push-pull cannulae 〔J〕. Endocrinology, 1982;111:1439-48.
2Levine JE, Duffy MT. Simultaneous measurement of luteinizing hormone (LH)-releasing hormone, LH, and follicle-stimulating hormone release in intact and short-term castrate rats 〔J〕. Endocrinology, 1988;122: 2211-21.
3Xue HG, Yamamoto N, Kato M,etal. Morphological characteristics of gonadotropin releasing hormone (GnRH) neurons in the preoptic area of GnRH-EGFP transgenic rat 〔J〕. Neurosci Res(Suppl), 2007;58:221.
4Xue HG, Yamamoto N, Kato M,etal. Panorama description of gonadotropin releasing hormone (GnRH) neurons in the preoptic area of GnRH-EGFP transgenic rat 〔J〕. Acta Anatomica Nipponica(Suppl),2007; 82:201.
5Coquelin A. Absence of female-induced luteinizing hormone release in orchidectomized, sexually active mice 〔J〕. Biol Reprod, 1991;45: 424-31.
6Gibson MJ, Miller GM, Silverman AJ. Pulsatile luteinizing hormone secretion in normal female mice and in hypogonadal female mice with preoptic area implants 〔J〕. Endocrinology, 1991;128: 965-71.
7Jennes L, Stumpf WE. Gonadotropin-releasing hormone immunoreactive neurons with access to fenestrated capillaries in mouse brain 〔J〕. Neuroscience, 1986;18:403-16.
8Silverman AJ, Witkin JW, Silverman RC,etal. Modulation of gonadotropin-releasing hormone by uptake of fluorogold from the vasculature 〔J〕.Synapse, 1990;6:154-60.
9Herbison AE, Poreous R, Pape JR,etal. Gonadotropin-releasing hormone neuron requirements for puberty, evulation, and fertility 〔J〕. Endocrinology, 2008;149:597-604.
10Todman MG, Han SK, Herbison AE. Profiling neurotransmitter receptor expression in mouse gonadotropin-releasing hormone neurons using green fluorescent protein-promoter transgenics and microarrays 〔J〕. Neuroscience, 2005;132:703-12.
11Silverman AJ, Livine I, Witkin JW. The gonadotropin-releasing hormone (GnRH) neuronal systems: immunocytochemistry and in situ hybridization. In: Knobil E, Neill JD, eds.The physiology of reproduction〔M〕.New York: Raven, 1993:1683-709.
