胃癌新辅助化疗有效性的Meta分析
2014-09-12窠文博李育泉魏茂强
窠文博 姜 雷 李育泉 魏茂强 陈 燕 赵 鹏
(兰州大学第一临床医学院,甘肃 兰州 730000)
胃癌的治疗手段主要有手术、化疗,外科手术是目前唯一有可能治愈该疾病的手段〔1〕。然而大多数患者一经诊断即为进展期胃癌,局部进展期胃癌即使行根治术后预后仍较差,5年生存率约为10%~30%〔2〕,为此,各个国家都在尝试各种治疗手段以期提高其生存时间。在欧洲国家胃癌的5年生存率约为20%~30%,而在日本大约为60%〔3〕。究其原因除了和日本早期胃癌的比例较高以外,还可能和这些国家的治疗策略不同相关。有研究表明新辅助化疗可以通过降低患者的病理分期从而提高病灶的手术切除率〔4〕。最近一项报道显示,新辅助化疗在局部进展期胃癌的治疗中有良好的疗效〔5〕。然而,对于新辅助化疗缺乏有效的反应可能会延误手术切除治疗的时机且化疗诱导毒性可能会增加手术并发症〔6〕。因此,新辅助化疗是否可以改善胃癌患者的预后尚无定论〔7〕,本文旨在用Meta分析的方法定量评价新辅助化疗在胃癌治疗中的有效性,以期为临床实践提供决策依据。
1 材料与方法
1.1研究对象标准 ①经组织病理学检查证实为胃癌的患者;②进展期胃癌患者,重要脏器功能正常,能耐受手术治疗和化疗的患者,其年龄、性别、种族、国籍不限,术后有随访;③排除肿瘤复发、二次手术、其他脏器合并有肿瘤的患者,对化疗过敏者及孕妇;任何时间接受了放疗、免疫治疗、生物治疗者;失访率超过20%的研究。
1.2观察指标 ①术后三年生存率;②术后五年生存率;③R0手术切除率;④术后并发症发生率。
1.3检索策略 中文检索词为“胃癌、胃肿瘤、新辅助化疗、术前化疗”。英文以“Gastric cancer;Stomach cancer;Neoadjuvant chemotherapy; Preoperative chemotherapy;Neoadjuvant therapy;5-year survival rates;Radical resection”为检索词。计算机检索PubMed (1966-2012.6)、Cochrane library、 EMABSE、中国生物医学文献数据库(1978-2012.6)、中国期刊全文数据库(1994-2008.6)、中文科技期刊全文数据库(1989-2008.6),无语种和出版类型的限定,并积极与本领域的专家及通讯作者联系,核实出未检出的信息。阅读了与新辅助化疗的相关的临床实践指南,利用网络查询相关信息,并查找相关研究的参考文献。随机对照试验检索遵循Cochrane系统评价手册5.1中描述的RCT检索策略。检索词根据具体数据库调整,所有检索采用主题词与自由词相结合的方式,且所有检索策略通过多次预检索后确定。
1.4文献筛选和资料提取 首先浏览文献题名和摘要,排除明显不符合纳入标准的文献后,对可能符合标准的文献由作者获取原文并阅读全文,以确定是否符合纳入标准并提取相关资料,核对纳入文献的结果。对符合纳入标准的RCT进行资料提取,填写资料提取表格。提取资料内容包括:①作者信息、出版年限、样本量、化疗方案;②试验的基本情况、两组患者的基线情况和疾病状况;③试验设计、研究时间和随访时间、干预措施、失访人数和失访处理、反应研究质量的指标等;④结局测量指标:术后三年生存率;术后五年生存率;R0手术切除率;术后并发症发生率。
1.5文献质量评价 纳入文献按照Cochrane handbook 5.0手册提供的随机对照试验的质量评价标准进行评估: ①随机序列的产生是否正确;②是否采用分配隐藏;③是否采用盲法;④是否存在选择性报告结果偏倚;⑤结果数据的完整性,失访情况;⑥其他偏倚来源。
1.6统计学分析 采用Cochrane协作网提供的Rev Man 5.1版软件进行Meta分析,按照Meta分析要求整理文献数据,计数资料采用相对危险度(RR)或优势比(OR)为疗效分析统计量,计量资料采用加权均数差(WMD)或标准化均数差(SMD)。各效应量均以95%可信区间(CI)表示。参数估计时,先做异质性检验。无异质性选择固定效应模型,如果存在异质性则选择随机效应模型。如果异质性较大采用描述性分析。必要时采取敏感性分析检验结果的稳定性。采用Review Manager 5.1分析软件绘制森林图和漏斗图。
2 结 果
2.1文献检索结果 初检有关文献439篇。阅读题名、摘要,排除综述13篇,放疗加化疗15篇,其他非随机对照试验、非临床研究文献284篇,干预措施不符77篇。剩余50篇查找原文,排除未达到纳入标准的文献40篇,最终纳入的10个研究均为随机对照试验,共4 386例患者,各纳入研究的基本特征见表1。

表1 纳入研究的基本特征
2.2纳入研究的方法学质量 3个研究〔9,13,16〕采用是随机分配,其他研究未描述随机的具体方法。10个研究中,2个研究〔4,9〕的隐藏分组方法采用密封信封的方法,其他研究未描述。10个研究中,1个研究〔4〕采用了双盲,其他研究都未描述盲法。10个研究均有失访。见表 2。
2.3Meta分析结果
2.3.1三年总生存率 纳入5个研究,共978例〔4,12~15〕,新辅助化疗组505例,手术组473例。新辅助化疗组与手术组在三年生存率方面的差异有统计学意义,合并OR值为1.74,95%CI为(1.31,2.29),且5个研究同质性较好(I2=0%,P=0.93),合并统计量采用固定效应模型,合并效应量检验Z=3.88,P值为0.000 1。见图 1。
2.3.2五年总生存率 纳入7个研究,共1 376例〔4,8~10,13~15〕,新辅助化疗组648例,手术组728例。新辅助化疗组与手术组在五年生存率方面的差异有统计学意义,合并OR值为1.52,95%CI为(1.15,2.01),纳入研究的同质性较好(I2=4%,P=0.39),合并统计量采用固定效应模型,合并效应量检验Z=2.97,P值为0.003。见图2。
2.3.3R0手术切除率 纳入6个研究,共990例〔4,9,12,14~16〕,新辅助化疗组482例,手术组508例。新辅助化疗组与手术组在R0手术切除率方面的差异有统计学意义,合并OR值为1.78,95%CI为(1.32,2.41),纳入的研究同质性较好(I2=0%,P=0.71),合并统计量采用固定效应模型,合并效应量检验Z=3.78,P值为0.000 2。见图3。
2.3.4术后并发症发生率 纳入6个研究,共1 042例〔4,10,12~15〕,新辅助化疗组511例,手术组531例。新辅助化疗组与手术组在术后并发症发生率方面的差异无统计学意义,合并OR值为1.74,95%CI为(0.94,3.22),纳入的研究存在异质性(I2=64%,P=0.02),故采用随机效应模型合并统计量,合并效应量检验Z=1.77,P值为0.08。见图4。
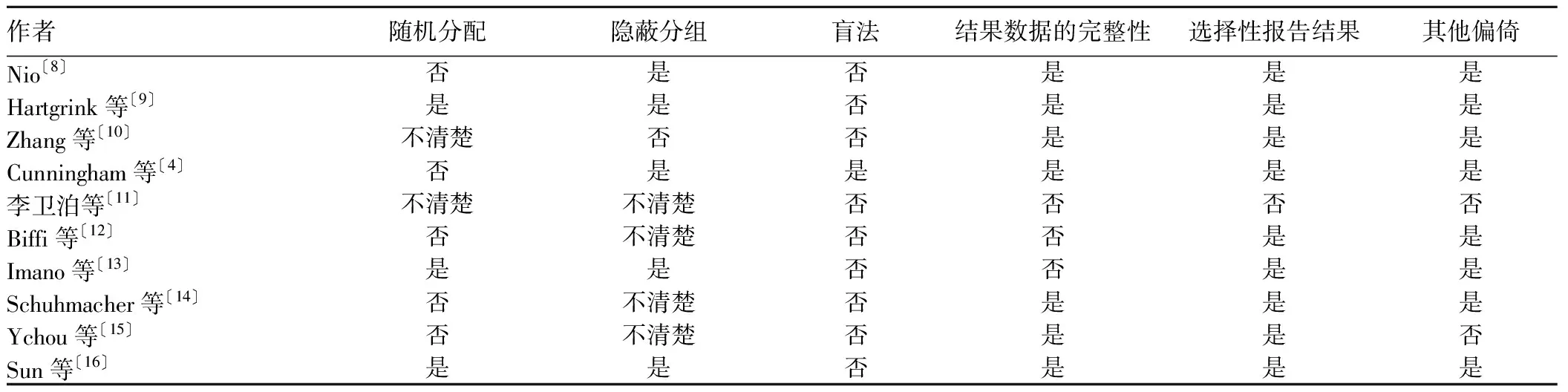
表2 纳入研究的质量评价
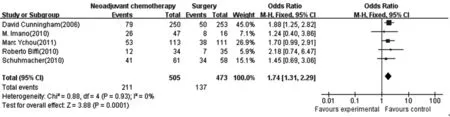
图1 新辅助化疗组与手术组对胃癌患者3年生存率影响的比较

图2 新辅助化疗组与手术组对胃癌患者5年生存率影响的比较
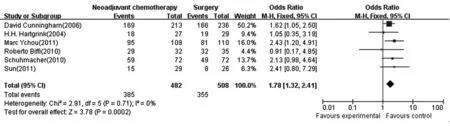
图3 新辅助化疗组与手术组对胃癌患者手术切除率的比较
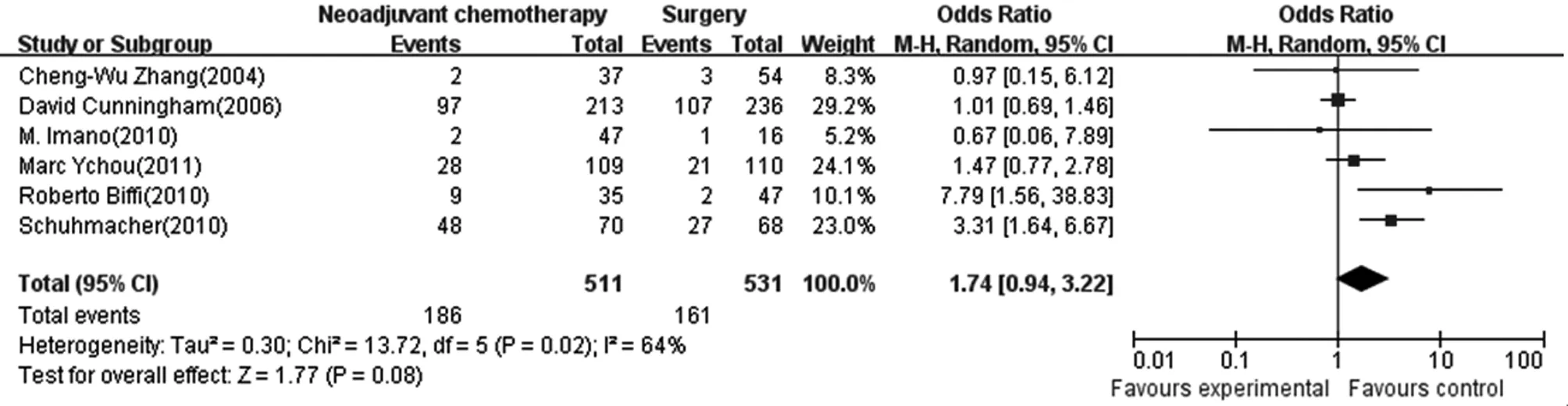
图4 新辅助组与手术组术后并发症发生率的比较(随机效应模型)
3 讨 论
新辅助化疗能否使患者生存受益一直是临床关注的焦点,为此本研究用Meta分析的方法定量评价了其有效性,结果提示新辅助化疗可以提高患者三年总体生存率,并且增加R0手术切除率,然而新辅助化疗能否提高胃癌患者五年总生存率仍存在争议〔7〕,但是从本次纳入研究的数据来看,新辅助化疗组和手术组在患者五年生存率方面的差异有统计学意义,即接受新辅助化疗的患者疗效优于手术组。对于术后并发症发生率结果显示差异无统计学意义,但是由于纳入的研究所使用化疗方案不同、纳入患者的标准不同,术后并发症的评判标准不一致等可能会影响结论的内在真实性。
为了增加R0手术切除率和总体生存率,我们采取早诊断,降低肿瘤分期等措施。在日本,早诊断是非常有临床意义的,它可以给患者带来很好的生存结局,然而,在胃癌发病率较低的国家,大规模的筛查是不可行的。虽然我们在手术治疗胃癌方面做了很多努力,如淋巴结清扫术D1、D2、D3等等,但通过提高手术水平改善患者预后达到了一个瓶颈。所以我们需要寻找新的辅助治疗手段,而新辅助化疗就是一个有潜力的有效的辅助治疗措施。
然而新辅助化疗仍然有其局限性,有些患者对于新辅助化疗不敏感,可能延误手术时机,所以我们需要对敏感的患者进行筛选,在术前进行影像学检查或者腹腔镜检查,确定肿瘤分期,对于肿瘤已浸出浆膜,伴或不伴有腹膜种植转移的患者采取新辅助化疗,若进行两个周期的化疗后复查,发现肿瘤未有缩小反而增大,说明患者对于术前化疗不敏感,应当立即手术干预,防止疾病的进一步恶化。另外,通过影像学和腹腔镜对胃癌分期的定位,我们要恰当的选择新辅助化疗的应用方案,尽可能减少术后并发症,降低肿瘤分期,增加手术切除率。目前临床上多采取联合用药方式,但仍然以氟尿嘧啶为基础,可见其在临床上对胃癌进展期患者有效,且耐受性好。当前通过分子生物学研究,了解患者基因分型以确定患者是否对于新辅助化疗敏感,从而选择相应的个体化疗方案也是可行的。
我们的Meta分析显示新辅助化疗、手术、术后化疗三联疗法相比较单纯手术或手术后化疗,对于局部晚期胃癌患者有更好的疗效。理论上,对于新辅助化疗有高反应的已经发生转移的患者推荐术前化疗,因为快速而高效的治疗措施可以显著降低肿瘤分期,并且增加R0手术的切除率,从而提高胃癌患者的总体生存率。但对于术前采取新辅助化疗时,疾病发生了进展和恶化也是我们需要担忧的问题,这样不仅让患者丧失了接受手术的时机,而且疾病的进一步发展增加了手术的难度。Cunningham等〔4〕组和Hartgrink等〔9〕组共154例患者在新辅助化疗时疾病都发生了进展,术前化疗组68例患者中,46例进行了姑息手术,22例无法切除;手术组86例中,姑息手术75例,11例无法切除。这说明手术组的切除率较高,所以新辅助化疗后疾病进展和恶化对于手术切除率的影响并不大。
新辅助化疗相比较辅助化疗仍然具有其优越性:①原发肿瘤的切除可能会刺激剩余肿瘤细胞的生长;②术后肿瘤及周围组织血供发生改变影响化疗药物浓度及放疗的效果;③对于新辅助化疗、放疗的组织病理学反应与预后呈正相关;④降低肿瘤分期,提高手术切除率;⑤防止肿瘤细胞在术中播散,降低肿瘤细胞活性;⑥消除潜在的微转移灶,降低术后转移复发的可能;⑦了解术前患者对药物的敏感性,以便为术后化疗提供依据〔17〕。因此,新辅助化疗仍然具有其可行性。
纳入的10项研究中,Hartgrink等〔9〕,Cunningham等〔4〕,Nio等〔8〕,Imano等〔13〕组在研究中详细描述了分配隐藏、失访人数、随访时间、暴露的实施、研究的设计等,研究质量较高,可靠性好,而其他研究仅提到随机分组但是并没有介绍随机方法,随访时间等也未做描述,文献质量较低。10篇文献质量高低不等,故纳入研究存在选择性报告偏倚、由于外科试验的特殊性,新辅助化疗组合单纯手术组在试验过程中无法实施盲法,因此测量性偏倚和实施偏倚的可能性很大。本系统评价在评价研究过程中,纳入文献质量参差不齐,纳入研究样本量偏小,对于术后并发症的评判标准没有统一,可能会影响结果的稳定性。且在分析新辅助化疗对术后并发症发生率影响时纳入的6篇文献存在异质性(I2=64%,P=0.02),采用随机效应模型合并统计量后,得出新辅助化疗组和单纯手术组差异无统计学意义。综上因素,在一定程度上降低了本次系统评价结果的可靠性。
新辅助化疗的治疗方案在亚洲和西方国家是不同的,在亚洲主要采用日本的口服5-Fu(氟尿嘧啶)、UFT(优福定)、5-DFUR(去氧氟尿苷),而西方国家采取静脉注射化疗药物,所以术前化疗的效果会受到化疗方案不同,剂量不同和用法不同,联合或单一的化疗,有无放射治疗等因素的影响。Cunningham等〔4〕的研究表明,术前采用ECF(表柔比星、顺铂、5-氟尿嘧啶)可以提高总体生存率,在超过500例病人中,相比较单纯手术,术前采用ECF可以降低25%的死亡人数。Wagner等〔18〕学者撰写的Cochrane系统评价已证实了ECF方案在进展期胃癌患者中的有效性,但是亚洲人群对该方案的耐受性差。目前胃癌的化疗NCCN指南仍推荐以氟尿嘧啶类为基础的联合化疗。
对于某些对术前化疗耐受性较好的局部晚期胃癌患者,术前化疗可延长其生存期,因此,新辅助化疗有望成为局部进展期胃癌患者的最佳选择,它可以作为局部进展期胃癌患者的一项治疗手段。但是,我们仍然需要更多大样本,高质量,多中心的前瞻性研究进一步证实。
4 参考文献
1Nashimoto A,Nakajima T,Furukawa H,etal.Randomized trial of adjuvant chemotherapy with mitomycin,fluorouracil,and cytosine arabinoside followed by oral Fluorouracil in serosa-negative gastric cancer:Japan Clinical Oncology Group 9206-1〔J〕.J Clin Oncol,2003;21(12):2282-7.
2De Vita F,Giuliani F,Galizia G,etal.Neo-adjuvant and adjuvant chemotherapy of gastric cancer〔J〕.Ann Oncol,2007;18(Suppl 6):120-3.
3Degiuli M,Sasako M,Ponti A,etal.Survival results of a multicentre phase Ⅱ study to evaluate D2 gastrectomy for gastric cancer〔J〕.Br J Cancer,2004;90(9):1727-32.
4Cunningham D,Allum WH,Stenning SP,etal.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer〔J〕.N Engl J Med,2006;355(1):11-20.
5Paoletti X,Oba K,Burzykowski T,etal.Benefit of adjuvant chemotherapy for resectable gastric cancer:a meta-analysis〔J〕.JAMA,2010;303(17):1729-37.
6Weber WA,Ott K,Becker K,etal.Prediction of response to preoperative chemotherapy in adenocarcinomas of the esophagogastric junction by metabolic imaging〔J〕.J Clin Oncol,2001;19(12):3058-65.
7He LF,Yang KH,Tian JH,etal.Meta analysis of clinical effectiveness of neoadjuvant chemotherapy for gastric cancer〔J〕.Ai Zheng,2008;27(4):407-12.
8Nio Y,Koike M,Omori H,etal.A randomized consent design trial of neoadjuvant chemotherapy with tegafur plus uracil (UFT) for gastric cancer--a single institute study〔J〕.Anticancer Res,2004;24(3b):1879-87.
9Hartgrink HH,van de Velde CJ,Putter H,etal.Neo-adjuvant chemotherapy for operable gastric cancer:long term results of the Dutch randomised FAMTX trial〔J〕.Eur J Surg Oncol,2004;30(6):643-9.
10Zhang CW,Zou SC,Shi D,etal.Clinical significance of preoperative regional intra-arterial infusion chemotherapy for advanced gastric cancer〔J〕.World J Gastroenterol,2004;10(20):3070-2.
11李卫泊,宋伟庆,张玉印,等.5-氟尿嘧啶术前化疗对胃癌细胞凋亡和增殖的影响〔J〕.中华肿瘤防治杂志,2006;13(14):1077-9.
12Biffi R,Fazio N,Luca F,etal.Surgical outcome after docetaxel-based neoadjuvant chemotherapy in locally-advanced gastric cancer〔J〕.World J Gastroenterol,2010;16(7):868-74.
13Imano M,Itoh T,Satou T,etal.Prospective randomized trial of short-term neoadjuvant chemotherapy for advanced gastric cancer〔J〕.Eur J Surg Oncol,2010;36(10):963-8.
14Schuhmacher C,Gretschel S,Lordick F,etal.Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia:European Organisation for Research and Treatment of Cancer randomized trial 40954〔J〕.J Clin Oncol,2010,28(35):5210-8.
15Ychou M,Boige V,Pignon JP,etal.Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma:an FNCLCC and FFCD multicenter phase Ⅲ trial〔J〕.J Clin Oncol,2011;29(13):1715-21.
16Sun XC,Lin J,Ju AH.Treatment of Borrmann type IV gastric cancer with a neoadjuvant chemotherapy combination of docetaxel,cisplatin and 5-fluorouracil/leucovorin〔J〕.J Int Med Res,2011;39(6):2096-102.
17季加孚.胃癌外科治疗中的若干问题〔J〕.实用肿瘤杂志,2003,(05).
18Wagner AD,Grothe W,Behl S,etal.Chemotherapy for advanced gastric cancer〔J〕.Cochrane Database Syst Rev,2005;(2):CD004064.
