破血化瘀,填精补髓方剂对脑出血大鼠脑血肿周围组织生长因子的表达
2014-09-12任吉祥毕铁琳周翔宇王海燕
任吉祥 毕铁琳 周翔宇 王海燕
(长春中医药大学附属医院, 吉林 长春 130021)
脑出血(ICH)是具有病死率、致残率高,并发症多等特点,已发展成为危害人类健康的主要疾病之一〔1〕。虽然ICH后神经细胞凋亡的启动机制尚不十分清楚,但大量研究发现诱导ICH后细胞凋亡的因素很多,如缺血导致的自由基瀑布效应〔2〕,炎性反应,其细胞因子的分泌表达,凝血酶的作用等〔3〕。中医药在治疗脑卒中恢复期神经功能恢复、重建等方面具有毒副作用小,疗效确切等优点〔4〕。在“髓虚毒损”的脑病发病病机关键指导下,将出血性脑卒中“破血化瘀,豁痰开窍,泄热醒神”的治疗大法进一步创新,提出了“破血化瘀,填精补髓”治疗总则。由水蛭、生大黄、生蒲黄、虻虫、瓜蒌、三七、石菖蒲、龟板胶等组成“破血化瘀,填精补髓”中药汤剂是作者所在研究团队在长期临床实践中总结出来的重要方剂,能有效改善脑出血患者的临床症状,提高患者的日常生活能力〔5〕。实验拟以醒脑健神胶囊为药性对照药物,观察破血化瘀,填精补髓方剂对急性期ICH大鼠脑组织中脑源性神经营养因子(BDNF)、酪氨酸激酶 B(TrKB)及血管内皮生长因子(VEGF)表达的影响,进一步探讨ICH后大鼠神经元的保护性作用及其可能的机制。
1 材料和方法
1.1材料
1.1.1动物 清洁级Wistar大鼠150只,鼠龄8 w,雌雄不限,体质量150~160 g,由吉林大学实验动物中心提供,动物许可证号:SCXK(吉)2011-0063。动物分笼饲养,室温维持在20℃~25℃,湿度40%~70%,光照条带强度15~20Lux,大鼠自由饮水和摄食。实验中对动物的操作符合科技部2006年颁布的《关于善待实验动物指导性意见》。
1.1.2药物 破血化瘀,填精补髓法实验方剂由水蛭(山东,水蛭全体呈圆柱形)8 g、生大黄10 g(青海,茎红色)、生蒲黄15 g(江苏,黄色粉末)、虻虫5 g(江苏,形似蜜蜂,体中等,黄绿色)、瓜蒌20 g(安徽,果实近球形,熟时橙红色,光滑)、三七10 g(云南,光滑无毛,绿色或带多数紫色细纵条纹)、石菖蒲15 g(杭州,其根茎具气味,叶全缘,排成二列)、龟板胶10 g(河南,四方形的扁块,褐色略带微绿)组成,采用传统煎药法取适量药材置于砂锅中,加水浸泡3 min,煮沸,冷却,过滤去渣后取药液进行浓缩,使1 ml药液中含生药1 g,4℃保存备用。醒脑健神胶囊(批号:111216),主要由牛黄、郁金、菖蒲、胆南星、虻虫、川芎组方),由吉林省中医院制剂室制备。
1.2方法
1.2.1实验动物分组 将ICH模型成功大鼠120只,随机分成五组:模型组,高、中、低剂量组,阳性药组,每组24只;另设假手术组各24只;每组分为四个时间点,分别为(1、3、7、14 d),每个时间点为6只。
1.2.2大鼠ICH模型的建立 参照文献〔6,7〕报道的方法,大鼠以10%水合氯醛腹腔麻醉(350 mg/kg),固定于大脑立体定位仪上,于前囟前0.2 mm中线向左侧旁3 mm处钻一直径约为1 mm的小孔,断尾取血,用微量注射器沿钻孔方向将50 μl的抗凝血缓慢注入左侧尾状核,留针10 min,之后缓慢退针,缝合头皮。假手术组不注射自体血。大鼠出现明显的神经系统病理体征,左侧肢体失用性偏瘫症状出现,以前肢为重,行走过程呈顺时针向追尾状,则为制备成功ICH模型〔8〕。
1.2.3中医治疗 高、中、低剂量药物治疗组大鼠分别以5、10、20 g/kg破血化瘀,填精补髓方剂灌胃治疗,1次/d。阳性药组大鼠以0.3 g/kg醒脑健神胶囊灌胃治疗,1次/d。假手术组及模型组大鼠以10 ml/kg生理盐水灌胃。对照组大鼠自由饮食饮水。
1.2.4神经功能评价 造模后1、3、7,14 d,使用Longa等〔9〕评分法评定大鼠神经功能。0 分:没有神经功能缺损;1 分:左侧前爪不能完全伸展;2 分:行走时,大鼠向左侧转圈;3 分:行走时,大鼠身体向左侧(瘫痪侧)倾倒;4 分:不能自发行走,有意识丧失。
1.2.5取材 造模后1,3,7及14 d,分别以10%水合氯醛过量麻醉大鼠,迅速断头开颅取脑,在冰盘上的培养皿(经DEPC处理)上分离右侧脑组织,以注血针孔处为中心取脑组织约100 mg,置于冻存管,-80℃冰箱保存备用。
1.2.6大鼠脑水肿的测量 造模后3、7 d,把大鼠断头处死,取大脑,冠状位切片,切成2 mm厚,用数码相机拍照。使用病理图像分析软件(Image-Pro Plus)以冠状位血肿最大切面与相应冠状切面的面积比作为脑水肿的指标。
1.2.7大鼠大脑含水量的测定 采用干湿法测定大鼠大脑含水量。取大鼠2 mm厚冠状位脑片,精确称取脑组织湿质量,置于100℃~110℃的烤箱中烘烤24 h至恒重后,称取干质量,脑组织含水量(%)=(湿质量-干质量)/湿质量×100%〔10〕。
1.2.8反转录PCR检测大鼠大脑黑质豆状核中BDNF及其受体TrkB mRNA的表达水平 取大鼠大脑黑质组织100 mg置于DEPC水处理过的玻璃匀浆器中,加Trizol(Invitrogen,Carlsbad,USA)1 ml充分匀浆,室温放置5 min;将组织匀浆转移至EP管中,4℃下,12 000 r/min离心10 min;将上清液转移至另一EP管中,每管加氯仿0.2 ml,室温静止2~3 min后,4℃,12 000 r/min离心15 min;将无色上层水相,转移至另一洁净的EP管中,加入等体积的异丙醇,上下轻轻摇匀,室温下静止10 min。4℃,12 000 r/min离心10 min;弃去上清液,每管加入75%冰乙醇1 ml,4℃,7 500 r/min离心5 min。去除上清液,室温下干燥沉淀3~5 min,加入0.2 ml无RNase水溶解沉淀,制成组织总RNA溶液。RNA保存于50 μl无RNase灭菌用水中,-80℃保存。经2%琼脂糖凝胶电泳检测RNA的完整性,应用紫外分光光度计(上海元析仪器有限公司)测定RNA,A260 nm/A280 nm比值在1.8~2.0,表明RNA的纯度高,可用于反转录PCR实验。引物由北京奥科生物技术有限责任公司合成。取0.2 ml PCR反应管,每管依次加入cDNA溶液2 μl,10×Taq酶缓冲液5 μl,dNTPs(10 mmol/L)2 μl,目的基因上、下游引物各10 μl,内参上、下游引物各5 μl,cDNA溶液5 μl,Taq酶3 μl,DEPC处理水3 μl,总反应体积50 μl。BDNF上游:GTC CAC GGA CAA GGC AAC TTG G;下游:ACC GGA CAT GTC CAC TGC AGT;扩增长度392 bp;TrkB上游:GAT GTT CCA GCC ACT GTGAAC C;下游:CCC AAG ACC AGC AAGCAT AAG C;扩增长度257 bp;GAPDH上游:ACCACAGTCCATGCCATCAC;下游:TCCACCACCCTGTTGCTGTA;扩增长度450 bp;GAPDH预变性94℃ 5 min,变性94℃ 30 s,退火55℃ 30 s,延伸72℃ 1 min,后延伸72℃ 10 min,循环次数35;BDNF预变性94℃ 5 min,变性94℃ 1 min,退火58℃ 1 min,延伸72℃ 2 min,后延伸72℃ 10 min,循环次数35;TrkB预变性94℃ 5 min,变性94℃ 1 min,退火56℃ 1 min,延伸72℃ 2 min,后延伸72℃ 10 min,循环次数35。采用常规方法,用TAE缓冲液,制备含溴乙啶(终浓度为1 μg/μl)的1.5%琼脂糖,每道加样10 μl,室温下100V恒压电泳25 min。电泳结束后,取5 μl反应产物做2%琼脂糖凝胶电泳,用凝胶图像分析仪(杭州天能生物科技有限公司)采集图像,用凝胶成像分析系统分析平均吸光度值。
1.2.9免疫组织化学染色观察大鼠脑组织中的表达 将10%甲醛固定的大鼠脑采用常规石蜡包埋、切片,制成2 mm切片,分别进行苏木素-伊红(HE)染色。大鼠脑组织切片以二甲苯脱蜡、梯度乙醇水化,枸橼酸缓冲液热修复 30 min,室温自然冷却;3% H2O2室温孵育5 min,以阻断内源性过氧化物酶,磷酸盐缓冲液(PBS)冲洗5 min×3次;滴加一抗(1∶50~200)4℃过夜,PBS冲洗,5 min×3;滴加通用型IgG抗体-辣根过氧化物酶(HRP)(即用型)37℃孵育15 min,PBS 5 min×3;应用二氨联苯氨(DAB)溶液显色,蒸馏水冲洗、HE复染、充分水洗、酸乙醇分化、充分水洗、乙醇脱水、二甲苯透明、树脂胶封片。阴性对照不加一抗。高倍镜下观察细胞染色情况,拍照记录结果。应用图像分析方法(motic image advanced 3.2,北京仪嘉林科技有限公司)测定灰度值。

2 结 果
2.1破血化瘀,填精补髓方剂改善ICH大鼠神经系统体征及神经功能 与假手术组相比,ICH大鼠出现明显的神经系统病理体征,右侧脑损伤后,左侧肢体失用的偏瘫症状,以前肢为重,行走过程呈顺时针方向追尾状,大鼠神经功能缺损评分明显增加(P<0.01);与模型组大鼠比较,以不同剂量破血化瘀,填精补髓方剂或醒脑健神胶囊治疗的大鼠上述症状明显改善(P<0.01),至第7天时,受试药中、高剂量组大鼠神经系统体征基本恢复正常。见表1。
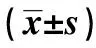
表1 破血化瘀,填精补髓法对脑出血大鼠神经功能缺损评分的影响
2.2破血化瘀,填精补髓方剂减少ICH大鼠吸收出血面积比 在连续给药3 d后,阳性药组与模型组大鼠比较,ICH面积比无显著性差异(P>0.05);受试药低、中、高剂量组与模型组大鼠比较,ICH面积比均有显著性差异(均P<0.05);在连续给药第7天后,受试药三个剂量组与模型组大鼠比较ICH面积比均有显著性差异(均P<0.01),并表现出具有一定的时-量依赖关系。见表2。
2.3破血化瘀,填精补髓方剂减少ICH大鼠脑组织含水量 干湿法测定结果显示,与假手术组大鼠比较,造模3 d后,模型组大鼠损伤脑区脑含水量明显增加(P<0.01)。与模型组大鼠比较,造模3 d后阳性药组及受试药低、中、高剂量组大鼠脑含水量明显降低(P<0.05);但造模后7 d时各组大鼠脑含水量没有显著性差异(P>0.05)。见表3。
2.4破血化瘀,填精补髓方剂增加ICH大鼠血肿周围组织BDNF,TrkB和VEGF表达 免疫组化染色显示,与假手术组大鼠相比,ICH大鼠血肿周围组织BDNF表达增加(P<0.05);经不同剂量破血化瘀,填精补髓方剂或醒脑健神胶囊治疗的大鼠血肿周围组织BDNF表达进一步增加(P<0.05)。见表4。

表2 破血化瘀,填精补髓法对各组大鼠出血面积比随时间变化的比较

表3 破血化瘀,填精补髓方剂对ICH大鼠脑组织含水量的影响

表4 破血化瘀,填精补髓法对ICH大鼠脑血肿周围组织BDNF表达(灰度值)的影响
免疫组化染色显示,与假手术组大鼠相比,ICH大鼠血肿周围组织TrkB表达增加(P<0.05),而经不同剂量破血化瘀,填精补髓方剂或醒脑健神胶囊治疗的大鼠血肿周围组织,TrkB表达进一步增加(P<0.05)。见表5。
免疫组化染色显示,与假手术组大鼠相比,ICH大鼠血肿周围组织VEGF表达增加(P<0.05);而经不同剂量破血化瘀,填精补髓方剂或醒脑健神胶囊治疗的大鼠血肿周围组织VEGF表达进一步增加(P<0.05)。见表6。

表5 破血化瘀,填精补髓法对ICH大鼠脑血肿周围组织TrkB表达(灰度值)的影响

表6 破血化瘀,填精补髓法对ICH大鼠脑血肿周围组织VEGF表达(灰度值)的影响
2.5破血化瘀,填精补髓方剂增加ICH大鼠损伤脑区BDNF和TrkB mRNA表达 反转录PCR检测结果显示,与假手术组大鼠相比,造模后第7天,ICH大鼠损伤脑区BDNF和TrkB mRNA的表达明显升高;而与模型组相比,不同剂量破血化瘀,填精补髓方剂均能明显增加大鼠损伤脑区BDNF和TrkB mRNA表达,且受试药中、高剂量组的效果更为显著,但阳性药物醒脑健神胶囊对大鼠损伤脑区BDNF和TrkB mRNA表达没有明显影响。
3 讨 论
ICH后引起机体和脑组织局部产生一系列病理性反应,其中最重要的是局部脑血流量减少,脑内血肿,血肿分解产物(凝血酶)和脑组织直接损伤释放的各种血管活性物质所致的脑水肿、颅内压增高及迟发性的神经元损伤〔11〕,这些变化直接影响脑出血的预后。迄今为止尚缺乏确切有效的治疗方法,如何降低患者的病死率及致残率是目前急需解决的难题。
BDNF是一类多功能的多肽生长因子,广泛存在于脑内各组织,以大脑皮质、海马、纹状体分布最为丰富。生理情况下,BDNF在中枢神经系统正常发育过程中,可调节神经元的存活、分化和轴突导向;病理情况下,BDNF参与了脑损伤的保护过程〔12,13〕。在脑缺血损伤后,早期即有BDNF蛋白及mRNA的表达水平明显升高,特别是在缺血相对耐受的齿状回颗粒细胞中,出现BDNF蛋白及受体TrkB的持续表达,提示这些细胞可能通过产生BDNF,作为一种内源性的神经保护剂而抵抗缺血、缺氧,从而对局部缺血、缺氧的神经元发挥潜在的保护作用。Cheng等〔14〕发现在缺血、缺氧性脑损伤后脑室内给予BDNF有显著的神经保护作用,且早期应用效果更佳,并可上调TrkB受体,阻断胞内损伤因子对蛋白激酶C的失活,特异性防止神经细胞缺血后的死亡〔15〕。实验发现,在连续给受试药第3天时,BDNF在血肿周围表达明显增加,于第7天达高峰,推测其一方面,可能为受试药在脑内促进在皮质、海马及血肿周围的神经元或胶质细胞中合成,诱导BDNF蛋白表达及分泌增加,保护受损神经元;另一方面,受试药通过提高内源性BDGF表达水平,与特异受体相结合,启动细胞内信号传导途径,产生相应的效应分子,调节神经元和周围结构、促进神经元存活、轴突再生而大鼠神经系统病理体征具有明显改善作用〔16〕。经临床研究证明了该受试药可改善出血性脑卒中的中医证候、减轻患者神经功能缺损程度、 提高患者的生活能力和生活质量,其有效率达到84.00%〔6〕。
另有研究表明,BDNF mRNA则主要表达于神经元,部分表达于血肿周围的活化小胶质细胞〔17〕。传统观念认为,BDNF是一种靶源性的神经生长因子,即BDNF在靶组织(如皮质、海马等)内合成、分泌,作用于投射纤维终末的受体TrkB,形成配体-受体复合物,经逆行转运到神经元的胞体而发挥神经元存活。近来研究发现BDNF以类似出胞的形式分泌到细胞外基质中而对临近的神经细胞发挥营养作用〔18〕。本实验结果推测受试药可能通过促进靶组织皮质、海马等处神经元或胶质细胞内BNDF mRNA的表达。而BDNF mRNA表达的增高又可促进其基因表达产物-BDNF蛋白的合成与分泌,然后通过逆行运输的方式到达受损区域,从而发挥神经营养作用,促进受损神经元的存活。
TrkB是BONF的高亲和力受体,主要分布于大鼠脑内包括大脑皮质、海马齿状回、黑质-纹状体、下丘脑、小脑、中脑顶盖区和脑干等,其阳性颗粒不仅分布于神经元胞体,而且延续到纤维,其中以海马齿状回和皮质的含量最高,成为脑内分布最为广泛〔19〕。TrkB免疫组织化学染色结果表明,其作用机制可能BDNF与其特异性受体TrkB结合对突触可塑性和神经元具有保护作用。
VEGF是近年来发现的一种具有肝素结合活性的生长因子,为同性二聚体蛋白化合物,高度特异地作用于血管内皮细胞,刺激血管内皮细胞增殖,诱导体内新生血管形成〔20〕。正常情况下表达水平很低,病理条件下,可在其血管内皮中检测到受体的高表达。众多实验已证实,脑缺血后VEGF的表达上调:主要是通过PKC途径,通过促进内皮细胞增生,在缺血区诱导大量新生血管形成,改善微循环,增加受累脑组织再灌注及供氧量,促进受损脑组织修复,加强神经元的营养和神经元功能的恢复〔21〕。有关VEGF在出血性脑血管病的病理机制中的作用,国内外的研究多集中在VEGF对血脑屏障、脑水肿、脑损伤及脑保护等方面的影响。一部分学者认为VEGF可能参与ICH后血脑屏障的破坏,促进脑水肿的形成〔22〕并加剧缺血性神经元的损伤〔23〕。另一部分学者则认为VEGF参与了ICH后血脑屏障的保护、减轻脑水肿及脑损伤,有神经保护作用〔24〕。研究结果提示受试药具有明显的增加了损伤脑区VEGF阳性细胞数量。
综上,破血化瘀、填精补髓法治疗大鼠急性期ICH,可明显改善神经功能缺失症状,减轻脑血肿,促进脑水肿的吸收。其机制可能与促进BDNF表达,开通BDNF-TrkB通路,而达到神经元细胞的保护及修复有关。
4 参考文献
1吴 江.神经病学 〔M〕. 北京:人民卫生出版社,2006:170.
2胡书超,张祥建.脑出血后的神经细胞凋亡机制及治疗策略 〔J〕.国外医学·脑血管疾病分册,2004;12(7):524-6.
3郭富强,李晓佳,陈隆益,等. 脑出血患者血肿周围组织细胞因子与细胞凋亡相关基因表达的动态观察 〔J〕. 中华神经医学杂志,2006;5(7):1097-8.
4江爱娟,胡建鹏,申国明,等.两种中药复方对脑缺血大鼠脑组织BDNF和bFGF表达的影响 〔J〕. 辽宁中医药大学学报,2009;11(7):188-90.
5赵德喜,于 兰.“破血化瘀”法为主治疗出血性脑卒中临床研究〔J〕.长春中医药大学学报,2012;28(6):974-5.
6张 昊,马晓依,吕 妍,等.大鼠脑出血模型,中国医药指南〔J〕.2012;10(34):88-9.
7田增有,孟令丽,杨莎莎,等.脑出血模型制作方法研究进展〔J〕.河北联合大学学报(医学版),2012;14(6):809-10.
8Blandini F,Armentero MT. Animal models of Parkinson's disease〔J〕.FEBS J,2012;279(7):1156-66.
9Longa EZ,Weinstein PR,Carlson S,etal. Reversible middle cerebral artery occlusion without craniotomy in rats 〔J〕.Stroke,1989;20(1): 84-91.
10Abe K,Yuki S,Kogure K. Strong attenuation of isch emic and postischemic brain ed ema in rats by a novel free radical scavenger 〔J〕.Stroke,1998;19(4): 480-5.
11Kim JS. Cytokines and adhesion molecules in stroke and related diseases 〔J〕. J Neurol Sci,1996;137(2): 69-78.
12Schabitz WR,Berger C,Kollmar R,etal. Effect of brain-derived neurtrophic factor treatment and forced arm use on functional motor recovery after small cortical ischemia 〔J〕.Stroke,2004;35(4): 992-7.
13侯莉娟,乔德才.脑源性神经营养因子的研究现状〔J〕.中国康复医学杂志,2005;20(12):940-2.
14Cheng Y,Gidday JM,Yan Q,etal. Marked age dependent neuroprotection by brain derived neurotrophic factor against neonatal hypoxic-ischemic brain injury 〔J〕.Ann Neurol,1997;41(4): 521-9.
15邹 伟,王汉芳,匡洪宇,等.针刺对脑出血急性期大鼠血浆内皮素含量的影响 〔J〕.中国中医药科技,1998;5(5): 302.
16Liu Y,Himes BT,Murray M,etal. Grafts of BDNF-producing fibroblasts rescue axotomized rubrospinal neurons and prevent their atrophy〔J〕. Exp Neurol,2002;178(2): 150-64;
17武 衡,黎杏群,唐 涛,等.脑溢安对脑出血大鼠脑源性神经营养因子蛋白表达的影响 〔J〕. 湖南医科大学学报,2003;28(5): 485-9.
18邹 伟,刘 芳,孙晓伟,等.头针对急性脑出血大鼠BDNF和NGF表达的影响〔J〕. 中医药学报,2010;38(6):14-7.
19Pencea V,Bingaman KD,Wiegand SJ,etal. Infusion of brain-derived neurotrophic factor into the lateral ventricle of the adults rat leads to new neurons in the parenchyma of the striatum,septum,thalamus,and hypothalamus 〔J〕.J Neurosci,2001;21(17): 6706-17.
20Zhang X,Li H,Hu S,etal.Brain edema after intracerebral hemorrhage in rats:the role of inflammation 〔J〕. Neurol J India,2006;54(4):402-7.
21Byzova TV,Goldman CK,Jankau J,etal. Adenovirus encoding vascular endot helial growth factor-D induces tissue-specific vascular patterns in vivo 〔J〕.Blood,2002;99(12):4434-42.
22Kanazawa M,Igarashi H,Kawamura K,etal. Inhibition of VEGF signaling pathway attenuates hemorrhage after tPA treatment〔J〕.J Cereb Bood Flow Meab,2011;31(6): 1461-74.
23Dietrich W D,Busto R,Halley M,etal. The importance of brain temperature in alterations of the blood-brain barrier following cerebral ischemia〔J〕.J Neuropathol Exp Neurol,1990;49(7):486-97.
24Sun J, Zhou W, Ma D,etal. Endothelial cells promote neural stem cell proliferation and differentiation associated with VEGF activated Notch and Pten signaling〔J〕.Dev Dyn, 2010;239(9):2345-53.
