小干扰RNA抑制MDM2对HepG2细胞的影响及机制
2014-09-12赵燕颖李亚刚赵春燕杨泽成张舵舵孙远杰
赵燕颖 李亚刚 赵春燕 杨泽成 张舵舵 孙远杰
(吉林大学第四临床医院内科,吉林 长春 130011)
肝癌存在多种原癌基因的激活和抑癌基因的失活、突变,最终导致其编码蛋白质的改变,从而引起细胞恶变〔1〕。MDM2的基因产物可以和野生型p53(wtp53)结合,可以起到一种对p53的负调节作用,因为MDM2基因的过度表达,可以减少p53基因的抑癌作用,即使是低水平MDM2的表达,也将会引起细胞成瘤性的增强〔2〕。目前已有大量研究表明在消化系统肿瘤如胃癌、肝癌、胰腺癌中MDM2都是过渡表达的〔3〕。siRNA技术已经成为研究基因功能的一种公认的有效工具,并且可以用于筛选药物靶点,为治疗肿瘤、病毒感染带来突破。目前尚未见用siRNA技术干扰MDM2表达对人肝癌细胞的报道。本文作者设计siRNA MDM2并转染人肝癌细胞,观察其对细胞增殖和凋亡的影响和对MDM2及其上下游基因蛋白的表达影响,探讨其作用机制。
1 材料与方法
1.1材料 胎牛血清、IMDM培养基 (Gibco);Trizol Reagent,逆转录和PCR试剂盒(Invitrogen)、SilencerTMsiRNA construction kit(Ambion 公司);LipofectamineTM2000 转染试剂盒(Invitrogen公司);引物由上海生工生物技术公司合成;细胞株(中国科学院上海细胞所)。兔抗人MDM2、wtp53、p21、Bcl-2和β-actin抗体及羊抗兔二抗购于UPSTATE,Hybond 硝酸纤维素膜 (NC) 购自Amersham。
1.2siRNA 的设计和合成 根据已知Gen Bank MDM2 mRNA序列和siRNA的设计原则〔4〕,利用Ambion 公司的在线设计来寻找靶序列,并做同源序列搜索,排除那些和其他编码序列或表达序列标签(EST)同源的序列,用SilencerTMsiRNA construction kit体外合成siMDM2-1,siMDM2-2,阴性对照(control siRNA)购于Ambion,与任何编码序列无同源性。
1.3细胞培养及转染 人肝癌细胞HepG2细胞株由中科院上海细胞所提供。在含10%小牛血清的IMDM培养液中培养,于5%CO2和37℃条件下培养。HepG2细胞采用脂质体LipofectamineTM2000进行转染。取对数生长期的HepG2细胞用0.25 %胰酶消化后,制成单细胞悬液,用细胞记数板进行细胞记数。取96孔板和10 ml培养瓶。96孔板每个培养皿接种细胞数为1×104,培养瓶接种1×106,37℃,5%CO2条件下培养24 h后进行转染。做好分组标志(Ⅰ组:PGCsilencerTM-MDM2 siRNA-1;Ⅱ组:PGCsilencerTM-MDM2 siRNA-2;Ⅲ组:PGCsilencerTM-control siRNA;Ⅳ组:只加转染试剂lipofectin)。转染步骤依据LipofectamineTM2000转染说明书。
1.4RT-PCR检测siMDM2对细胞基因的影响 转染后72 h用Trizol 提取各组细胞中的总RNA。总RNA中逆转录出cDNA,再通过PCR法扩增,操作均严格按试剂盒说明书进行。以β-actin作为内参,MDM2扩增产物为300 bp,上游5′-AACCACCTCACAGATTCCAG-3′,下游5′-TCAAGGTGACACCTGTTCTC-3′;p53扩增引物为490 bp,上游5′-GTGGTGGTGCCCTATGAG -3′;下游5′-GGGAGGTAGACTGACCCTTT-3′;P21扩增产物为486 bp,上游5′-GCTGAGCCGCGACTGTGAT-3′下游5′-TGAGACTAAGGCAGAAGATGTA-3′;Bcl2扩增产物为382 bp,上游5′-GACCGAAGTCCGCAGAAC-3′,下游5′-CCAACGTGCCATGTGCTA-3′;β-actin 扩增产物为 520 bp,上游:5′-GGGACCTGACAGACTACCT-3′,下游:5′-CGTACTCCTGCTTGCTGA-3′。PCR 产物经1 %琼脂糖凝胶系统电泳(含溴乙啶),拍照鉴定。用Pharmacia ImageMaster 凝胶成像仪观察,并用 ImageMaster 软件分析条带峰面积,转染各组信号值相对于对照组的百分率进行统计作图。
1.5MTT法检测siMDM2对细胞增殖的影响 转染siMDM-1、2和control siRNA,每组4复孔,培养24,48,72 h 后每孔加入5 g/ L MTT 溶液15 μl,37℃孵箱中继续孵育4 h后吸弃孔内培养上清液,每孔加150 μl二甲基亚砜(DMSO),振荡10 min,用酶联免疫检测仪570 nm测定各孔吸光度,记录结果。以时间、吸光度绘制细胞增殖曲线,细胞增殖抑制率(%)=(1-处理组吸光度/未处理组吸光度)×100%,计算出抑制率。
1.6流式细胞仪检测siMDM2对细胞凋亡的影响 转染后继续培养72 h后收集各组的HepG2细胞磷酸盐缓冲液(PBS)洗涤,70%冰乙醇固定,碘化丙啶染色,流式细胞仪检测。通过软件Multicycle进行分析,以DNA含量为横坐标,受检细胞为纵坐标作图,用累积曲线分割法计算各期细胞所占比例。G1峰前面出现的亚2倍体峰即为凋亡峰,计算各组凋亡率。
1.7划痕实验检测siMDM2对细胞迁移能力的影响 将HepG2细胞种于24孔培养板中,用含10%胎牛血清(FBS)的IMDM培养基常规培养。次日待细胞融合度达到80%~90%时,用中号枪头进行划痕,PBS洗3次以去除划下的细胞,加入新鲜的培养液,转染,培养48 h。荧光显微镜拍照纪录。比较转染前后划痕宽度的变化。
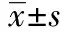
2 结 果
2.1重组质粒酶切和测序鉴定 PGCsilencerTM-MDM2 siRNA经Hind Ⅲ和BamH Ⅰ双酶切后呈2条带,分成大的载体片段和小的目的片段。将重组质粒PGCsilencerTM-MDM2-siRNA送上海生工测序(测序号D02.CS060503093_0253.SD13D229-1.F;D04.CS060503093_0255.SD13D230-1.F),引物序列根据载体序列,采用Primer-Premier5.0设计为:5′-AAGAAGAGAGTGTGGAATCTA-3′。结果表明siRNA表达模板成功构建于PGCsilencer载体上,序列完全正确,与目的序列相同。见图1。

1:Marker;2:siMDM2-1;3:siMDM2-1/HindⅢ+BamHⅠ;4:siMDM2-2;5:siMDM2-2/HindⅢ+BamHⅠ;6:control siRNA;7:control siRNA / Hind Ⅲ+ BamH Ⅰ;8:Marker
2.2siMDM2转染后细胞基因表达的变化 以β-actin作为内参照,对靶基因mRNA进行RT-PCR结果定性定量分析,各组引物的扩增基因片段经电泳和HE染色后,结果显示扩增片段大小与所设计的大小完全一致。siMDM2-1,2对基因表达影响趋势一致,转染2组siMDM2后MDM2和Bcl2 mRNA表达水平有显著的下调,p53和p21 mRNA表达水平有显著上调,而转染阴性质粒组各基因表达水平无明显改变。半定量扫描分析,和空白组比较转染2组si-MDM2的HepG2中MDM2 mRNA的表达量平均下调61.7%;p53 mRNA表达量平均上调46.9%;p21 mRNA表达量平均上调41.8%;Bcl2 mRNA平均下调39.5%,和空白组比均具有显著性差异(P<0.05,n=4); control siRNA组各基因表达量与空白对照组无明显差异(P>0.05,n=4)。见图2。
2.3siMDM2 转染后细胞增殖的变化 MTT法检测显示转染siMDM2后HepG2细胞增殖受到不同程度的抑制,转染2组si MDM2后24、48、72 h的平均抑制率为(30.9±2.99)%、(45.6±3.15)%和(52.1±3.29)%。抑制率随时间的增加而增高,各转染组抑制率明显高于control siRNA组,control siRNA组细胞增殖未见明显改变。而且siMDM2-1组抑制率稍高于siMDM2-2组,但差异无统计学意义(P>0.05)。
2.4siMDM2转染后细胞凋亡的变化 转染siMDM2可以诱导HepG2细胞凋亡,转染2组siMDM2的细胞凋亡率分别为(41.9±2.59)%和(34.9±1.98)%,明显高于control siRNA组(2.6±0.39)%(P<0.05)。同时,和空白组比siMDM2组细胞处于S期的细胞比例明显减少;而处于G0/G1期的细胞比例明显增加。
2.5siMDM2转染后细胞迁移能力的变化 control组与control siRNA组迁移较快,而siMDM2组迁移速率变慢,control组与control siRNA组之间差异无显著性(P>0.05),各组siMDM2之间差异无显著性(P>0.05)。siMDM2组迁移距离与空白组和control siRNA组相比,差异有显著性意义(P<0.05)。见图3。

图2 转染后各组MDM2、P53、P21和Bcl2基因表达的变化

图3 转染后HepG2细胞迁移能力的变化
3 讨 论
目前原癌基因、抑癌基因、凋亡基因等癌症相关基因的过度表达被认为是肝癌发生的主要原因。一些研究表明,可以用RNAi技术抑制原癌基因,突变的抑癌基因,细胞周期相关基因,抗凋亡相关基因等的表达来抑制肝癌的发生和发展〔1〕。肝癌的发生是多基因参与的结果,随着肝癌分子机制研究的不断深入,可成为RNAi技术靶位点的基因也越来越多,因此,如能利用RNAi技术抑制癌基因的表达,从而影响上下游基因表达变化,就可能抑制肝癌的发生和发展。
MDM2作为一种癌基因,其生物学作用是增强细胞的增殖活力,使细胞生存期延长,促进细胞增生及肿瘤的生长〔5〕。MDM2能与p53结合,抑制p53的抑癌功能。p53和Bcl-2同属于细胞凋亡的重要调控因子,在调节细胞凋亡的过程中有相互联系、共同作用的关系〔6〕。Farah等〔7〕认为p53基因诱导细胞凋亡的机制可能为:降低细胞内源性Bcl-2蛋白表达和抑制其功能,p53基因与Bcl-2蛋白表达呈明显负相关。另外,MDM2蛋白还可以与p21结合,终止p21被p53活化的抑制细胞增生的作用〔8,9〕。P21是ras基因家族中一种共同表达产物,是细胞周期负性调控基因,可被野生型p53蛋白诱导表达而使细胞周期停滞于G1期。MDM2过表达可以下调p53和p21表达,上调Bcl-2的表达从而刺激细胞无限制性生长,这可能在某些肿瘤的发生及发展中起着关健性作用。
本文结果显示siMDM2可抑制MDM2基因的表达从而促进p53表达,最终导致p21表达增加和Bcl-2表达降低,这可能是siMDM2抑制肿瘤细胞增殖和诱导其凋亡的主要机制之一。
本课题组在siRNA MDM2对前列腺癌增殖和凋亡的影响研究基础上〔10〕,对干扰MDM2在肝癌治疗中作用的进一步研究。研究结果基本一致,进一步证明了本研究组设计合成的siRNA MDM2质粒可以抑制肿瘤细胞增殖和诱导凋亡,同时可以抑制肿瘤细胞的迁移能力。siRNA技术为肿瘤基因治疗提供了一个新的可供选择的策略和技术平台,本研究亦表明MDM2可能是肿瘤治疗的一个新的靶点。
4 参考文献
1Zeng XX,Zheng RL,Zhou T,etal.Novl thienopyridine derivatives as specific anti- hepatocellular carcinoma (HCC) agents:synthesis,preliminary structure-activity relationships,and in vitro biological evaluation〔J〕.Bioorg Med Chem Lett,2010;20(21):6281-5.
2Akkiz H,Sümbül AT,Bayram S,etal.MDM2 promoter polymorphism is associated with increased susceptibility to hepatocellular carcinoma in Turkish population〔J〕.Cancer Epidemiol,2010;34(4):448-52.
3Kang KF,Zhang X,Chen XW,etal.Expressions of MDM2 and MMP-7 in normal liver,cirrhosis,hepatocellular carcinoma tissues〔J〕.Zhonghua Gan Zang Bing Za Zhi,2010;18(1):67-8.
4Elbashir SM,Harborth J,Weber K,etal.Analysis of gene function in somatic mammalian cells using small interfering RNAs〔J〕.Methods,2002;26(2):199-213.
5刘冬满,何世东,张志勇.子宫内膜癌中p15及MDM2蛋白表达〔J〕.中国老年学杂志,2010;30(4):1936-7.
6Esposito F,Tornincasa M,Chieffi P,etal.High-mobility group A1 proteins regulate p53- mediated transcription of Bcl-2 gene〔J〕.Cancer Res,2010;70(13):5379-88.
7Farah IO,Begum RA,Ishaque AB,etal.Differential protection and transactivation of P53,P21,Bcl2,PCNA,cyclin G,and MDM2 genes in rat liver and the HepG2 cell line upon exposure to pifithrin〔J〕.Biomed Sci Instrum,2007;43:116-21.
8Rong JJ,Hu R,Song XM,etal.Gambogic acid triggers DNA damage signaling that induces p53/p21(Waf1/CIP1) activation through the ATR-Chk1 pathway〔J〕.Cancer Lett,2010;296(1):55-64.
9Xu H,Zhang Z,Li M,etal.MDM2 promotes proteasomal degradation of p21Waf1 via a conformation change〔J〕.J Biol Chem,2010;285(24):18407-14.
10李然伟,赵燕颖,杨泽城,等.siRNA抑制人前列腺癌细胞PC3的MDM2表达及细胞增殖〔J〕.肿瘤防治研究,2009;36(1):24-7.
