狼疮清颗粒对AHN模型大鼠肾功能和MRL/lpr小鼠肾组织NF-κBp65蛋白表达的影响
2014-09-12瞿凌晨赵晓莉吕高虹
梁 涛 瞿凌晨 赵晓莉 梁 卫 吕高虹
(南京中医药大学药理教研室,江苏 南京 210023)
狼疮性肾炎(LN)是系统性红斑狼疮(SLE)最常见的并发症之一,几乎所有SLE均有不同程度肾脏病变〔1〕。LN的发病机制目前一般认为是由于自身免疫功能紊乱,产生大量抗体,形成的免疫复合物沉积在肾小球基底膜和毛细血管壁,引起肾脏损伤〔2〕。本文研究的狼疮清颗粒是从《备急千金要方》所载的犀角地黄汤中而来,具有清热解毒、凉血化瘀、滋养阴液功效,本实验拟研究其对LN是否具有治疗作用,以期为狼疮颗粒治疗狼疮肾炎提供实验依据。
1 资料与方法
1.1试验药物 狼疮清颗粒:南京中医药大学提供,批号100726;泼尼松:天津药业公司,批号:100309;弗氏完全佐剂:均为美国Sigma公司;尿蛋白、肌酐(Cr)、尿素氮(BUN)试剂盒:由南京建成生物有限公司提供;NF-κBp65一抗小鼠来源:Santa cruz提供;全蛋白抽提试剂盒,丽春红染色液,SDS-PAGE凝胶配制试剂盒,一抗稀释液,二抗稀释液,内参一抗(β-actin一抗来源兔),ECL检测试剂盒,SDS-PAGE凝胶配制试剂盒,考马斯亮蓝染色法检测蛋白试剂盒均为南京凯基生物科技发展有限公司提供。
1.2实验动物 MRL/lpr小鼠、C57BL/6J小鼠:中国人民解放军军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2007-004。Wistar大鼠由南京中医药大学实验动物中心提供,实验动物使用许可证号:SYXK(苏)2002-0053;实验动物饲养许可证号:SCXK(苏)2002-0012。
1.3仪器 Western电泳仪:Bio-Rad,America;高速冷冻离心机,美国科俊仪器公司;低温冰箱:Sanyo,Japan;电热恒温干燥箱:上海润东荣丰科学仪器有限公司;振荡器:上海沪西分析仪器厂;多用脱色摇床:江苏金坛市正基仪器厂;微量加样器:Eppendorf;pH计:梅特勒-托丽多仪器公司;SyneRgy HT酶标仪:美国Bio-Tek。
1.4狼疮清颗粒对主动型Heymann肾炎(AHN)大鼠模型肾功能影响
1.4.1抗原制备 取体重(150±20) g的Wistar大鼠,雌雄兼有,腹腔注射戊巴比妥钠麻醉,在无菌条件下剖开腹腔,结扎肾动脉,自结扎处向肾脏插管,剪断肾静脉,经插管用生理盐水反复冲洗肾脏,使之成灰白色,取下肾脏,取肾皮质用电动匀浆器磨成匀浆,每次取皮质匀浆35 g,加弗氏完全佐剂70 ml,置乳钵研匀,缓缓加入生理盐水140 ml边加边磨,使乳化均匀完全。
1.4.2模型制作 取体重(150±15) g的雄性Wistar大鼠,放入大鼠代谢笼中(每笼1只),收集24 h尿蛋白总量,除随机抽取10只作正常对照组(正常组)外,其余大鼠腹腔注射上述同种大鼠肾皮质加弗氏完全佐剂液,每次2 ml/只,每2 w注射1次,共造模12 w,前后共注射7次,同时肌注硫酸庆大霉素注射液以预防感染。并于造模第8周同法收集24 h尿液,测定24 h尿蛋白。
1.4.3分组方法 取24 h尿蛋白量在20.07~41.37 mg之间的造模大鼠40只,按尿蛋白水平分层后随机分为4组:模型组:给予其他组等体积蒸馏水;狼疮清颗粒(中药)组:给予狼疮清颗粒(22.8 g/kg),狼疮清颗粒+泼尼松(中药+西药)组:给予狼疮清颗粒+泼尼松(22.8+0.005) g/kg,泼尼松(西药)组:给予泼尼松(0.005 g/kg)。10只同批大鼠作为正常组给予等体积蒸馏水。灌胃连续4 w。
1.4.4观察指标及检测方法 ①尿蛋白、尿素氮、肌酐检测:实验结束,代谢笼收集24 h尿液,测定尿蛋白,眼眶取血,离心,收集血清,酶标仪测定BUN,Cr。②肾脏组织病理学观察:大鼠处死后,取出肾脏,经肾门最大面切取1/2肾脏,10%甲醛固定,逐级酒精脱水、浸蜡、石蜡包埋,常规切片4 μm,PAS染色,Mias22000图像分析仪分析。肾小球毛细血管壁厚度:随机选择 PAS染色肾小球数15个,观察毛细血管壁厚度。分级标准为:(-)血管壁厚度没有增加;(+)血管壁厚度增加数占总量的0%~25%;()血管壁厚度增加数占总量的26%~50%;()变性占总量的51%~75%;()变性占总量的76%~100%。
1.5对狼疮性MRL/lpr小鼠NF-κBp65蛋白的表达的影响
1.5.1试验方法及分组 取MRL/lpr小鼠20只,雌性,8周龄,饲养至90日龄,随机分成4组,每组5只:模型组:MRL/lpr小鼠给予蒸馏水;狼疮清颗粒(中药)组:MRL/lpr小鼠给予狼疮清颗粒(45.6 g/kg);泼尼松(西药)组:MRL/lpr小鼠给予泼尼松(0.01 g/kg);狼疮清颗粒+泼尼松(中药组+西药)组:MRL/lpr小鼠给予狼疮清颗粒(45.6 g/kg)+泼尼松(0.01 g/kg)。正常对照组:C57BL/6J小鼠5只,给予蒸馏水。灌胃给药,给药体积0.1 ml/10 g,连续4 w。
1.5.2Western印迹检测肾组织NF-κBp65蛋白的表达 灌胃给药4周末将小鼠脱臼处死,迅速取出肾脏待测。采用Western 印迹的方法,进行SDS-PAGE凝胶电泳,步骤参照文献。丽春红染色显示凝胶中的蛋白条带后,转移至PVDF膜上进行NF-κBp65蛋白的检测。一抗NF-κBp65小鼠多克隆抗体(1∶200)和β-actin(1∶200),二抗(辣根过氧化酶标记抗体,山羊抗小鼠多克隆抗体1∶5 000稀释)。采用ECL化学发光试剂盒,显影定影水洗晾干后,对胶片感光条带进行灰度扫描。应用BIO-RAD图像分析软件对Western印迹杂交条带进行密度扫描,以NF-κBp65条带灰度值与β-actin条带灰度值比值表示组织中NF-κBp65表达水平。
2 结 果
2.1对主动型 Heymann肾炎(AHN)大鼠肾功能影响 狼疮清颗粒组、狼疮清颗粒+泼尼松组、泼尼松组的BUN、Cr和尿蛋白水平均显著低于模型组(P<0.05),同时病理结果显示:各给药组大鼠肾小球毛细血管壁厚度、肾小管变性、与模型组大鼠相比均有不同程度的改善。见表1、表2。

表1 对主动型 Heymann肾炎(AHN)大鼠肾功能的作用
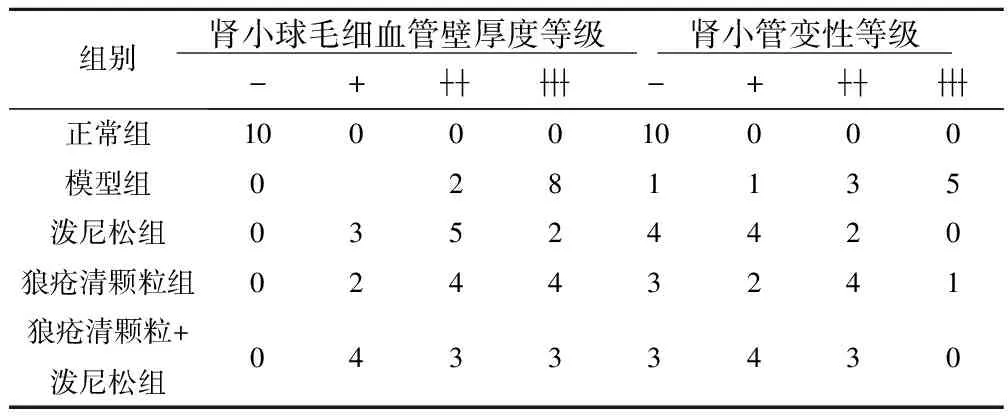
表2 AHN大鼠肾脏病理学观察结果(n, n=10)
2.2对狼疮样MRL/lpr小鼠肾组织 NF-κBp65蛋白的影响 正常组NF-κBp65蛋白的表达(2.36±0.073 7),模型组(6.25±0.062 8)显著增加(P<0.01);与模型组相比较,狼疮清颗粒组(4.30±0.059 1)、泼尼松组(4.17±0.042 9)、狼疮清颗粒+泼尼松组(2.56±0.052 8)、NF-κBp65蛋白的表达显著降低(P<0.01),其中狼疮清颗粒与泼尼松合用NF-κBp65蛋白表达下降最明显。
3 讨 论
本实验结果显示给药后各组降低24 h尿蛋白、血清BUN、Cr的含量。而24 h尿蛋白、血清Cr、BUN是衡量肾功能的重要指标,蛋白尿的轻重反映了肾小球基底膜的病变程度,另外肾脏病变时尿中异常出现的蛋白本身可能造成肾脏的损害,加重肾间质的炎症反应并促进其纤维化〔3〕。当肾实质受损害时,肾小球滤过率降低后,血中Cr、BUN含量就会急剧上升,作为肾小球滤过功能和肾损伤的指标之一〔4〕。本结果提示我们狼疮清颗粒具有改善AHN肾炎模型大鼠肾功能的作用。
NF-κB最初是从B淋巴细胞的核提取物中发现的一种能与免疫球蛋白κ链基因的增强子κB序列特异性结合的蛋白因子,最常见的形式是p65和p50蛋白亚基组成的二聚体,它广泛参与许多基因(特别是免疫炎症相关基因)的转录调控,包括白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α、ICAM-1、IL-6、IL-15等细胞因子基因的表达,从而在免疫炎症的病理过程中起重要作用〔5,6〕。近年来,对NF-κB在炎症和免疫性疾病中的作用及相关药物的作用机制研究成为抗炎免疫药理学的一大热门领域〔7〕。有研究表明〔8〕:NF-κB与狼疮肾炎活动有密切联系,可能参与了狼疮肾炎的发病机制。因此,抑制NF-κB的过度活化很可能成为治疗SLE分子机制的一个较好的靶点。本研究显示:狼疮清颗粒能抑制狼疮小鼠肾脏组织中NF-κB蛋白的表达,可能是其治疗狼疮性肾病的机制之一。
4 参考文献
1Cavallo T,Cameron WR,Lapenas D,etal.Immunopathology of early and silent lupus nephropathy〔J〕.Am J Pathol,1977;87:1-5.
2高春芳.系统性红斑狼疮小鼠模型的研究近况〔J〕.国外医学·皮肤性病学分册,1995;4(21):212.
3史跃先.蛋白尿在慢性肾脏病中的作用〔J〕.中华肾脏病杂志,1997;(5):318.
4戚仁铎.诊断学〔M〕.北京:人民卫生出版社,1990:36.
5Makarov SS.NF-κB as a therapeutic target in chronic inflammation:recent advances〔J〕.Molecul Med Today,2000;6:441-9.
6Pahl HL.Activators and target genes of Rel/NF-κB transcription factors〔J〕.Oncogene,1999;18:6853-8.
7向 明,吴 镭,刘 屏.我国抗炎免疫药理学研究的重要领域和发展趋势〔J〕.中国药理学通报,2003;19(2):138-9.
8许韩师,叶任高,张式鸿,等.NF-κB在狼疮肾炎中的作用〔J〕.中华风湿病学杂志,2000;4(4):213-5.
