17-β-雌二醇对去卵巢胰岛素抵抗大鼠骨骼肌中葡萄糖转运体4表达的影响
2014-09-12杨非柯刘竟芳何新平
杨非柯 刘竟芳 陈 伟 何新平
(长沙市中心医院老年医学科,湖南 长沙 410004)
胰岛素抵抗(IR)是2型糖尿病(T2DM)重要的病理生理学基础〔1〕。研究发现大量糖的摄入会导致骨骼肌和脂肪组织产生IR,这表明高糖在IR的诱发中发挥着十分重要作用〔2,3〕。然而有研究发现高糖诱导IR中存在性别差异,即高糖饮食喂养成年雄性SD大鼠可形成IR,而雌性SD大鼠却不能形成IR,但是高糖喂养去卵巢雌性大鼠可形成IR〔4〕。这些结果说明雌性大鼠体内的性激素可能是高糖难以诱导雌性大鼠形成IR的原因。胰岛素与其受体结合后,通过磷脂酰肌醇3激酶(PI-3K)/蛋白激酶B(PKB/Akt)和丝裂原激活蛋白激酶(MAPK)信号通路,促进胰岛素主要的效应蛋白葡萄糖转运体4(GLUT4)的表达和转位〔5,6〕。然而17-β-雌二醇(E2)是否通过影响GLUT4表达而拮抗高糖诱导的IR,目前还未见文献报道。因此本研究采用高果糖饮食喂养去卵巢大鼠诱导IR形成,观察17-β-雌二醇对GLUT4表达和磷酸化Akt水平的影响。
1 材料和方法
1.1主要仪器及试剂 17-β-雌二醇为Sigma 公司产品。鼠尾动脉血压仪(HX-Ⅱ型)由中南大学湘雅医学院生理学教研室提供。全自动γ计数仪由上海第二仪器厂生产。全自动生化分析仪为日本日立公司产品。垂直电泳仪与转膜系统为美国BioRad公司产品。ABI7500荧光定量PCR仪及分析软件购自美国ABI 公司。GOS7500型凝胶成像分析系统购自美国UVP公司。Moloney小鼠白血病病毒(MMLV)第一链cDNA合成试剂盒、Hot Star Taq Master Mix试剂和总RNA提取试剂盒购自美国Iinvitrogen公司。兔抗大鼠GLUT4和p-Akt单克隆抗体、辣根过氧化物酶标记羊抗兔二抗Santa Cruz公司产品。BCA蛋白定量试剂购自美国Pierce公司。雌二醇和胰岛素放免法检测试剂盒由北京东雅生物工程公司提供。引物和D-果糖由上海生工生物工程技术服务有限公司提供。其他试剂为国产分析纯。
1.2去卵巢胰岛素抵抗动物模型制备和实验分组 清洁级成年雌性SD大鼠40只,约3月龄,体重(200±20)g,由中南大学实验动物学部提供。大鼠购进后适应性喂养1 w,然后随机均分为四组,每组10只:正常对照组大鼠普通饲料喂养8 w;模型组大鼠卵巢切除后高果糖饲料喂养8 w;17-β-E2替代组大鼠卵巢切除后高果糖饲料喂养8 w,同时将17-β-E2(30 μg/kg体重)〔7,8〕进行皮下注射,1次/d。溶媒对照组10只,卵巢切除后高果糖饲料喂养8 w,同时每天皮下注射无水乙醇(30 μl/kg)。高果糖饲料中三大能量物质按热卡计算:果糖占60%,脂肪占11%,蛋白质占29%。大鼠由专人饲养,自由进食水,12 h光照,温度在(22±3)℃,每笼8只。
1.3卵巢切除术 大鼠于术前禁食12 h,自由饮水。1%戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,仰卧位固定大鼠。无菌状态下,做腹正中切口打开腹腔,找到双角子宫,分别沿每侧子宫找到卵巢,仔细分离周围组织,充分暴露卵巢。在卵巢与子宫相连接处结扎后,切除卵巢,分层缝合关闭腹腔。术后未用抗生素,大鼠自然清醒。
1.4大鼠体重、血压、血脂、血清雌激素水平的测定和胰岛素敏感指数的计算 果糖喂养后第8周末,大鼠于实验前禁食和禁水12 h,在清醒状态下用套尾法测量尾动脉的收缩压(SBP)。用电子称称量大鼠体重(BW)。1%戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,仰卧位固定,采用心脏放血制备血清。分离两侧肾周及附睾周围脂肪组织作为内脏脂肪(VF),称重并计算其与体重的比值(VFW/BW)。全自动生化分析仪测定空腹血糖(FBS)和血清甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C )和密度脂蛋白胆固醇(HDL-C)水平。放射免疫法测定血清雌激素浓度和空腹胰岛素(FSI)水平。按照李光伟等〔9〕的方法计算胰岛素敏感指数(ISI)。
1.5骨骼肌葡萄糖摄取率的测定 取大鼠股四头肌组织约200 mg,将骨骼肌撕成肌丝置于含Krebs-Ringer碳酸盐缓冲液(KRBB)的试管中,37℃振摇孵育30 min。将肌肉转移到新鲜的KRBB液中孵育2 h后,将3H-2-脱氧葡萄糖(3H-2-DG) 加入各实验管孵育30 min。各管加入3.0 ml冷的KRBB以终止反应。肌肉匀浆去蛋白后4 000 r/min离心15 min,取上清液进行液闪计数。葡萄糖摄取率(GUR)表示为3H计数值与组织重量的乘积〔10〕。
1.6实时定量PCR测定骨骼肌中GLUT4 mRNA表达水平 取适量的大鼠股四头肌,按照Trizol试剂盒说明提取细胞的总RNA。按照逆转录试剂盒说明,以提取的总RNA为模板进行逆转录反应扩增,合成cDNA第一链。取适量的cDNA样品进行10倍梯度稀释,分别进行实时定量PCR反应扩增,反应总体系为25 μl,包括cDNA 4 μl,PCR上下游引物及探针(10 μmol/L)各0.3 μl,Hot Star Taq Master Mix (2×)12.5 μl,灭菌去离子水补足总体积到25 μl。PCR扩增程序为:95℃ 10 min以激活Hot Star Taq DNA合成酶,扩增循环94℃ 60 s,60℃ 90 s,共55个循环。反应体系加入96孔板中,每个样品设置3个平行重复孔。GLUT4引物为:上游:5′- GGCTGTGAGTGAGTGCTIT-3′,下游: 5′- GGTITCTGCTCCCTATCGT-3′。同时扩增β-actin作为内参,β-actin引物为:上游:5′-CCATCATCTTGCAGGAGCG-3′,下游:5′-CTGGCAGTGAGCTATACTCG-3′。结果分析以对照组为100%对GLUT4 mRNA的表达进行分析。
1.7Western印迹分析测定骨骼肌中GLUT4蛋白的表达水平 取适量股四头肌组织用4℃预冷的PBS清洗3次,弃PBS液。加入200 μl蛋白裂解缓冲溶液,轻轻吸打数次,冰上裂解细胞20 min。待细胞完全裂解后,用细胞刮将细胞全部刮下并转移至1.5 ml离心管中。4℃离心30 min。然后收集上清液至无菌的1.5 ml离心管中,上清液为细胞总蛋白,立即吸取10 μl上清液进行蛋白浓度测定。取50 μg蛋白质样本加入2×SDS凝胶加样缓冲液中,煮沸使蛋白质变性。然后用6%SDS-聚丙烯酰胺凝胶进行电泳分离,电压为80 mA,电泳2 h,将分离的蛋白质用半干转膜仪转移至聚偏氟乙烯(PVDF)膜上,采用丽春红染色观察转移效果,并确定蛋白质分子质量标准位置。然后用5%脱脂牛奶室温封闭2小时,加入1∶150兔抗鼠ABCA1和p-Akt一抗,4℃过夜。三羟甲基氨基甲烷缓冲液(TBST)液洗膜3次,5 min/次。加入辣根过氧化物酶标记的二抗,4℃孵育4 h,TBST液洗膜3次。蛋白质印迹荧光检测试剂盒显示于X光片。以同样的方法显示β-actin,以此作为加样的内参。经显影和定影后,凝胶图像分析系统对胶片进行扫描和半定量分析。
2 结 果
2.1大鼠体重、SBP、血清FBS、FSI、ISI、E2的变化 如表1所示:去卵巢IR模型组大鼠的体重、SBP、FBS和 FSI水平与正常对照组相比均显著升高(均P<0.05),而ISI和血清E2水平与正常对照组相比均显著降低(P<0.05,P<0.01)。与去卵巢IR模型组相比,17-β- E2替代组大鼠的体重、SBP、FBS和 FSI 水平均显著降低(均P<0.05),ISI和血清E2水平均显著升高(P<0.05,P<0.01)。溶媒对照组与模型组相比较以上各项指标均无显著差异(P>0.05)。

表1 各组大鼠体重、SBP、FBS、FSI、ISI、E2的水平
2.2大鼠内脏VFW、血清TG、TC、HDL-C和LDL-C的水平和骨骼肌葡萄糖摄取率的变化 见表2,模型组大鼠的VFW、VFW/BW值、TG、TC和LDL-C水平与正常对照组相比均显著性升高(均P<0.05),HDL-C水平和股四头肌糖摄取均显著性减低(均P<0.05)。17-β-E2替代组大鼠的VFW、VFW/BW值、TG、TC和LDL-C水平均显著性降低(均P<0.05),HDL-C水平和股四头肌糖摄取均显著性增加(均P<0.05)。溶媒对照与模型组相比各项指标均无显著性差异(P>0.05)。

表2 各组大鼠内脏VFW、血清TG、TC、HDL-C和LDL-C的水平和股四头肌葡萄糖摄取率
2.317-β-E2对股四头肌中GLUT4 mRNA和蛋白表达的影响 采用实时定量PCR和Western 印迹分别分析测定股四头肌中GLUT4 mRNA和蛋白的表达。如图1所示:去卵巢IR模型组大鼠股四头肌中GLUT4 mRNA和蛋白的表达与正常对照组相比均显著性降低(GLUT4 mRNA分别35.73±5.27和100.00±0.00;GLUT4蛋白分别34.19±5.27和86.13±9.67)(均P<0.05),而与模型组相比17-β-E2显著上调大鼠股四头肌中GLUT4 mRNA和蛋白的表达(94.67±11.42,85.49±10.08,均P<0.05)。溶媒对照组与17-β-E2替代组相比大鼠股四头肌中GLUT4 mRNA和蛋白的表达没有差异显著性(36.81±4.86,35.69±4.72,P>0.05)。
2.417-β- E2对磷酸化Akt蛋白水平的影响 采用Western印迹分析测定股四头肌中磷酸化Akt蛋白的水平。如图2所示:与正常对照组相比,去卵巢IR模型组大鼠股四头肌中磷酸化Akt的水平显著性降低(68.43±9.64,28.39±4.12,P<0.05),而与模型组相比,17-β-E2显著性上调大鼠股四头肌中磷酸化Akt的水平(69.14±8.31,P<0.05)。溶媒对照组与17-β-E2替代组相比大鼠股四头肌中磷酸化Akt的水平没有差异显著性(27.34±3.57,P>0.05)。
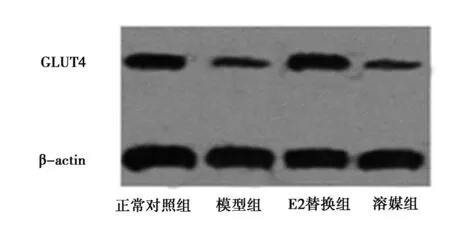
图1 17-β- E2对股四头肌GLUT4蛋白表达的影响
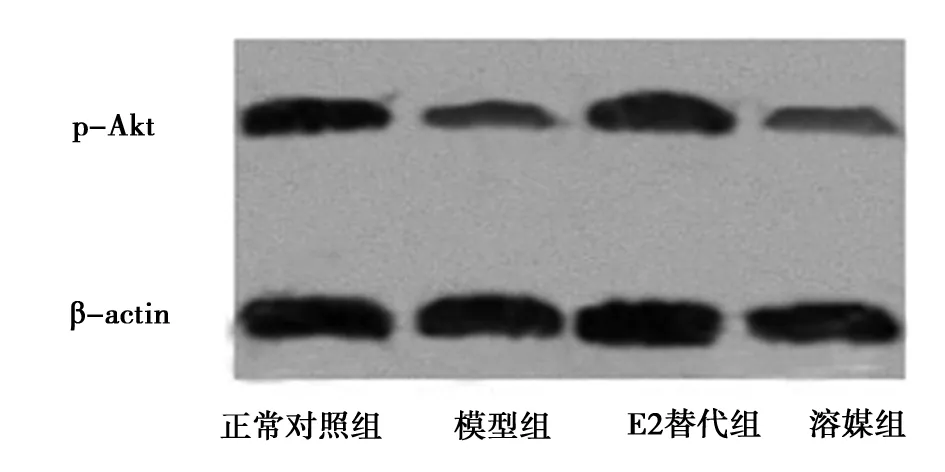
图2 17-β- E2对磷酸化Akt蛋白水平的影响
3 讨 论
IR时胰岛素的靶组织如:骨骼肌和脂肪组织等对内源性胰岛素的生物效应降低,导致葡萄糖摄取和利用发生障碍。胰岛素是体内促进合成代谢的主要激素,也是体内唯一具有降血糖作用的激素,由胰岛的β细胞分泌后经血液循环运到达相应的靶组织和器官。胰岛素与其受体结合,通过一系列的信号转导途径而产生效应。胰岛素信号转导通路主要有磷脂酰肌醇3激酶(PI-3K)通路和丝裂原激活蛋白激酶(MAPK)通路。前一通路主要介导胰岛素调节代谢的作用,后一通路主要介导胰岛素促生长的作用。PI-3K信号通路在胰岛素抵抗的发生中发挥着重要作用,而蛋白激酶B(PKB/Akt)是PI-3K重要的下游信号分子,通过 Akt 的磷酸化调节GLUT4的表达和转位,因此其磷酸化水平的高低可反映胰岛素信号通路的激活状态〔11,12〕。
目前认为胰岛素信号转导通路受损是IR发生的主要原因,他分为三个环节:胰岛素受体前、受体、受体后水平的障碍,其中受体后水平的障碍包括葡萄糖激酶活性的降低、葡糖糖转运和糖原合成障碍等倍受人们的关注成为研究的热点〔13,14〕。骨骼肌是胰岛素重要的外周靶器官,骨骼肌糖原合成对机体血糖的稳定发挥着重要的作用。GLUT4是骨骼肌糖代谢的主要限速环节。研究显示在IR状态或糖尿病大鼠中骨骼肌GLUT4的表达和葡萄糖的摄取显著性降低〔15,16〕。
研究表明雌激素可改善IR状态、提高靶组织对胰岛素的敏感性、纠正IR状态下的血脂紊乱、降低冠心病的发病危险〔17,18〕。Xie等〔19〕研究发现雌激素预处理可抑制高浓度的胰岛素引起的HepG细胞中胰岛素受体和胰岛素受体底物1-2(IRS1-2)的表达降低及IR的产生。Gonzalez等〔20〕也发现雌激素能够增加雌性S-D大鼠骨骼中的胰岛素受体的表达,增加胰岛素的敏感性。研究发现雌激素受体β的激活可以调节GLUT4的表达二雌激素受体α的刺激可以增加骨骼肌葡萄糖的摄取〔21,22〕。
本研究结果表明高果糖可能通过损伤胰岛素的信号传导通路而导致IR。17-β-E2可能是通过增加骨骼肌中p-Akt 磷酸化的水平和GLUT4的表达,增强胰岛素的信号传导,防止高果糖饮食诱导的去卵巢大鼠IR的产生。然而Barros等〔23〕研究发现大鼠怀孕期间的雌激素水平的升高可以减少骨骼肌GLUT4的表达,降低了胰岛素的敏感性,导致妊娠IR和妊娠糖尿病。这些矛盾的结果可能与妊娠期间其他的激素如:孕激素等的改变有关。
17-β-E2抑制高果糖诱导的去卵巢大鼠胰岛素抵抗,其机制可能与17-β-E2上调骨骼肌中p-Akt和GLUT4的表达有关。
4 参考文献
1Stepanova M,Lam B,Younossi Y,etal. Association of hepatitis C with insulin resistance and type 2 diabetes in US general population: the impact of the epidemic of obesity 〔J〕. J Viral Hepat,2012;19(5):341-5.
2Castro GS,Santos RA,Portari GV,etal. Omega-3 improves glucose tolerance but increases lipid peroxidation and DNA damage in hepatocytes of fructose-fed rats〔J〕. Appl Physiol Nutr Metab,2012;37(2):233-40.
3Briand F,Thiéblemont Q,Muzotte E,etal. High-fat and fructose intake induces insulin resistance,dyslipidemia,and Liver steatosis and alters In vivo macrophage-to-feces reverse cholesterol transport in hamsters 〔J〕. J Nutr,2012;142(4):704-9.
4Galipeau D,Verma S,McNeill JH. Female rats are protected against fructose-induced changes in metabolism and blood pressure〔J〕. Am J Physiol Heart Circ Physiol,2002;283(6): 2478-84.
5Montaseri A,Busch F,Mobasheri A,etal. IGF-1 and PDGF-bb suppress IL-1β-induced cartilage degradation through down-regulation of NF-κB signaling: involvement of Src/PI-3K/AKT pathway 〔J〕. PLoS One,2011;6(12):e28663.
6Sue M,Hayashi M,Kawashima A,etal. Thyroglobulin (Tg) activates MAPK pathway to induce thyroid cell growth in the absence of TSH,insulin and serum 〔J〕.Biochem Biophys Res Commun,2012;420(3): 611-5.
7周寿红,凌宏艳,田绍文,等. 17-β-雌二醇对去卵巢胰岛素抵抗大鼠主动脉舒缩功能损伤的保护作用 〔J〕. 生理学报,2005;57(5): 627-35.
8Horvath KM,Hartig W,Veen R,etal. 17beta-estradiol enhances cortical cholinergic innervation and preserves synaptic density following excitotoxic lesions to the rat nucleus basalis magnocellularis 〔J〕. Neuroscience,2005;110(3): 489-504.
9李光伟,Bennett PH. 关于空腹血糖、空腹胰岛素乘积的倒数在流行病学研究中应用的补充说明 〔J〕. 中华糖尿病杂志,2005;13(4): 247-9.
10陈璐璐,汪晓芬,郑 涓,等. 大鼠追赶生长早期脂肪组织和骨骼肌葡萄糖代谢差异及其机制〔J〕. 中华内分泌代谢杂志,2008;24(3): 244-7.
11Gonzalez E,Flier E,Molle D,etal. Hyperinsulinemia leads to uncoupled insulin regulation of the GLUT4 glucose transporter and the FoxO1 transcription factor 〔J〕. Proc Natl Acad Sci U S A,2011;108(25):10162-7.
12王涤非,蒋丽娟,邱忠霞,等. 罗格列酮对老年胰岛素抵抗小鼠骨骼肌细胞葡萄糖转运体4转位的影响〔J〕. 中国老年学杂志,2006;26(5): 636-8.
13Zhang Y,Li Y,Niepel MW,etal. Targeted deletion of thioesterase superfamily member 1 promotes energy expenditure and protects against obesity and insulin resistance 〔J〕. Proc Natl Acad Sci USA,2012;109(14):5417-22.
14Dhar A,Castillo L. Insulin resistance in critical illness 〔J〕. Curr Opin Pediatr,2011; 23(3):269-74.
15Sasaki Y,Sone H,Kamiyama S,etal. Administration of biotin prevents the development of insulin resistance in the skeletal muscles of Otsuka Long-Evans Tokushima fatty rats 〔J〕. Food Funct,2012;3(4):414-9.
16Kampmann U,Christensen B,Nielsen TS,etal. GLUT4 and UBC9 protein expression is reduced in muscle from type 2 diabetic patients with severe insulin resistance 〔J〕. PLoS One,2011; 6(11): e27854.
17Faulds MH,Zhao C,Dahlman-Wright K,etal. The diversity of sex steroid action: regulation of metabolism by estrogen signaling 〔J〕. J Endocrinol,2012;212(1): 3-12.
18Meyer MR,Clegg DJ,Prossnitz ER,etal. Obesity,insulin resistance and diabetes: sex differences and role of oestrogen receptors 〔J〕. Acta Physiol (Oxf), 2011;203(1): 259-69.
19Xie P,Liu ML,Gu YP. Oestrogen improves glucose metabolism and insulin signal transduction in HehG2 cell 〔J〕. Clin Exp Pharmacol Physiol,2003;30: 643-8.
20Gonzalez C,Alonso A,Grueso NA. Role of 17beta-estradiol administration on insulin sensitivity in the rat: implications for the insulin receptor 〔J〕. Steroids,2002;67: 993-1005.
21Rüegg J,Cai W,Karimi M,etal. Epigenetic regulation of glucose transporter 4 by estrogen receptor β 〔J〕. Mol Endocrinol,2011;25(12): 2017-28.
22Gorres BK,Bomhoff GL,Morris JK,etal. In vivo stimulation of oestrogen receptor α increases insulin-stimulated skeletal muscle glucose uptake〔J〕. J Physiol,2011;589(8):2041-54.
23Barros RP,Morani A,Moriscot A,etal. Insulin resistance of pregnancy involves estrogen-induced repression of muscle GLUT4 〔J〕. Mol Cell Endocrinol,2008;295(1-2): 24-31.
