依达拉奉对糖尿病大鼠脑缺血再灌注海马区神经元凋亡的影响
2014-09-12陈晓敏吴迪宾陈德杰邓远飞万汇涓黄春娇
丁 欣 陈晓敏 吴迪宾 赵 雷 陈德杰 邓远飞 万汇涓 黄春娇
(北京大学深圳医院特诊/老年病科,广东 深圳 518036)
细胞凋亡调控因子Fas介导的细胞凋亡是糖尿病脑缺血再灌注海马神经元损伤机制之一〔1〕,由此推测阻断Fas在糖尿病脑缺血再灌注后的表达,就会减少神经元的凋亡。目前有关依达拉奉对糖尿病脑缺血再灌注海马神经细胞凋亡调控基因的研究尚少。本研究通过依达拉奉对糖尿病大鼠局灶性脑缺血再灌注损伤海马区神经元凋亡及凋亡因子Fas蛋白的表达的研究,进一步探讨依达拉奉对脑均保护作用。
1 材料和方法
1.1主要试验器械及药物 链脲佐菌素(STZ)(美国Sigma);SD大鼠(购自广东动物实验中心);依达拉奉(必存注射液,南京先声药业有限公司);Fas、TUNEL试剂盒(武汉博士德生物工程有限公司)。
1.2实验动物及分组 健康雄性SD大鼠21只,2~3月龄,体重150~180 g,高脂饮食1个月。动物随机分为3组: MCAO组、MCAO+生理盐水组、依达拉奉干预组。每组7只。
1.3糖尿病动物模型 各组动物按照魏文石等〔2〕报道的方法建立糖尿病动物模型。具体方法是:高脂饮食1个月的大鼠禁食8 h后,左下腹腹腔注射STZ 55~60 mg/kg体重,稳定3 d后,用稳豪血糖仪LifeScan OneTouchUItra (美国强生公司)测定大鼠尾尖血糖,随机血糖16.7 mmol/L以上的大鼠判定为糖尿病大鼠。每3天测试血糖确证,常规饲养30 d,期间不进行胰岛素干预,也不进行糖尿病饮食控制,动态观察大鼠的症状和体征。
1.4脑缺血再灌注模型 局灶性脑缺血再灌注动物模型的建立按照文献〔3,4〕报道的方法加以改进。大鼠腹腔内注射10%水合氯醛麻醉后,仰卧固定。颈部正中切口分离并暴露左侧颈总动脉及颈外动脉,并在劲外动脉分叉处剪一小口,将长5 cm的尼龙线(直径0.188 mm)顺势缓慢送入,深度为1.8 cm,在大脑中动脉起端填塞大脑中动脉血流。栓塞成功的大鼠在缺血后2 h拔线至颈外动脉残端内进行再灌注,并结扎残端。实行再灌注时轻抽提线头即可。进行神经功能评分,选择苏醒后行走向右旋转或右侧肢体瘫痪(1~3分)的大鼠为栓堵成功者进行实验。假手术组步骤同前,但不阻断左侧大脑中动脉。术后动物放在37℃的恒温台上直到苏醒。
1.5依达拉奉干预 栓塞后30 min开始尾部静脉注射依达拉奉(0.5 g/kg),以后每12 h给药1次,直到第3天动物处死为止。MCAO+生理盐水组同样时间给予等量生理盐水; MCAO组不注射,只是在规定的时间点处死动物,断头取脑。
1.6病理标本制备 各组大鼠在脑缺血再灌注后3 d断头取出脑组织。具体方法是各组动物经10%水合氯醛(300 mg/kg)腹腔麻醉下左心室插管,依次灌入0.9%氯化钠和4%多聚甲醛各100 ml后断头取脑。沿脑冠状位额极后7~10 mm,将大鼠脑切成5 mm厚度的组织块,组织块经4℃4%多聚甲醛-0.01 MPBS液固定,剃度酒精脱水,低温石蜡包埋。取有大体病变的组织块从额侧开始切取组织切片,切成厚度为6 μm。每个组织片每隔200 μm连续取6张,常规HE染色。
1.7TUNEL 法细胞凋亡检测 严格按凋亡试剂盒所示步骤进行:脑组织石蜡切片脱蜡至水,3%H2O2室温处理10 min,蒸馏水洗涤2 min连续3次,加ProteinaseK 37℃消化10 min,TBS洗2 min连续3次,加标记液37℃标记2 h,加封闭液室温封闭30 min,加生物化抗地高辛抗体,37℃反应30 min,加SABC 37℃反应30 min,TBS冲洗5 min连续4次,DAB显色;充分冲洗,苏木素轻度复染,梯度酒精脱水,二甲苯透明,封片固定。光学显微镜下细胞核中有棕黄色颗粒者为TUNEL染色阳性的凋亡细胞,每只大鼠随机取3张切片,在400倍物镜下选取周围5个不重复的视野,以目镜网络测试系统手工计数100 μm长度内的海马CA1区TUNEL免疫组化阳性细胞数,取其平均值为最后结果。
1.8免疫组化法 Fas 检测 脑组织石蜡切片脱蜡至水,染色方法参照试剂盒说明:3%H2O2消除内源性过氧化物酶的活性,蒸馏水冲洗3次;枸橼酸钠缓冲液热修复抗原,小牛血清室温下封闭15 min;滴加兔抗鼠Fas抗体,4℃过夜,阴性对照用0.01 mol/L PBS代替一抗;滴加生物素化山羊抗兔IgG,37℃孵育20 min,PBS冲洗5 min连续4次;滴加试剂SABC,37℃水浴20 min,PBS冲洗5 min连续4次;DAB显色,充分冲洗,不复染,梯度酒精脱水,二甲苯透明,封片固定,显微镜观察。光镜下细胞质着棕色为Fas表达阳性细胞。同样每只大鼠随机取3张切片,在400倍物镜下选取周围5个不重复的视野,以目镜网络测试系统手工计数100 μm长度内的海马CA1区Fas免疫组化阳性细胞数,取其平均值为最后结果。

2 结 果
TUNEL法显示:MCAO组海马CA1区可见多量凋亡细胞(56.3±4.3), 同样MCAO+生理盐水组海马区均也可见多量的凋亡细胞(58.9±4.9),比较无明显差异(P>0.05),而与两组比较,依达拉奉干预组凋亡细胞数显著减少(34.3±5.2)(P<0.05)。见图1。免疫组化显示:同样MCAO组、MCAO+生理盐水组大鼠海马区均可见多量Fas阳性细胞,并且两组比较无明显差异(191.2±4.9 vs 189.2±4.2,P>0.05),而依达拉奉干预组(158.5±3.5)与MCAO组、MCAO+生理盐水组相比Fas阳性细胞明显减少(P<0.01),见图2。
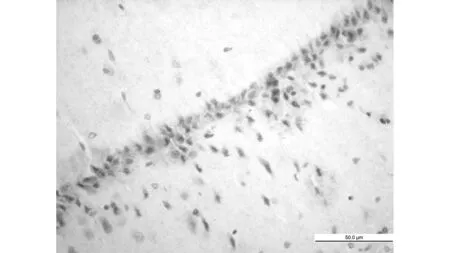
MCAO组
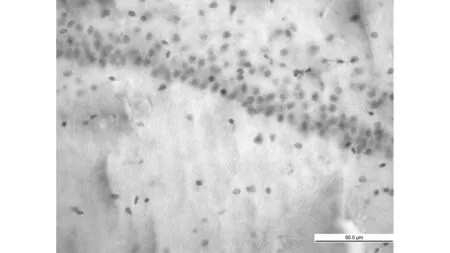
MCAO +生理盐水组

依达拉奉干预组
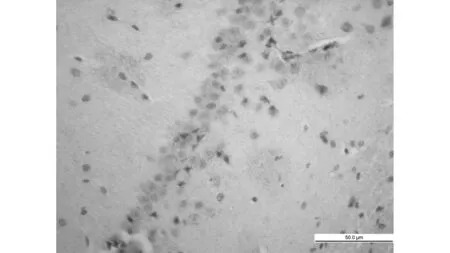
MCAO组
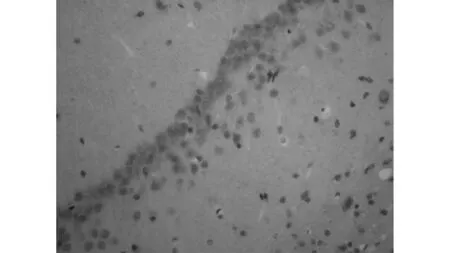
MCAO+生理盐水组
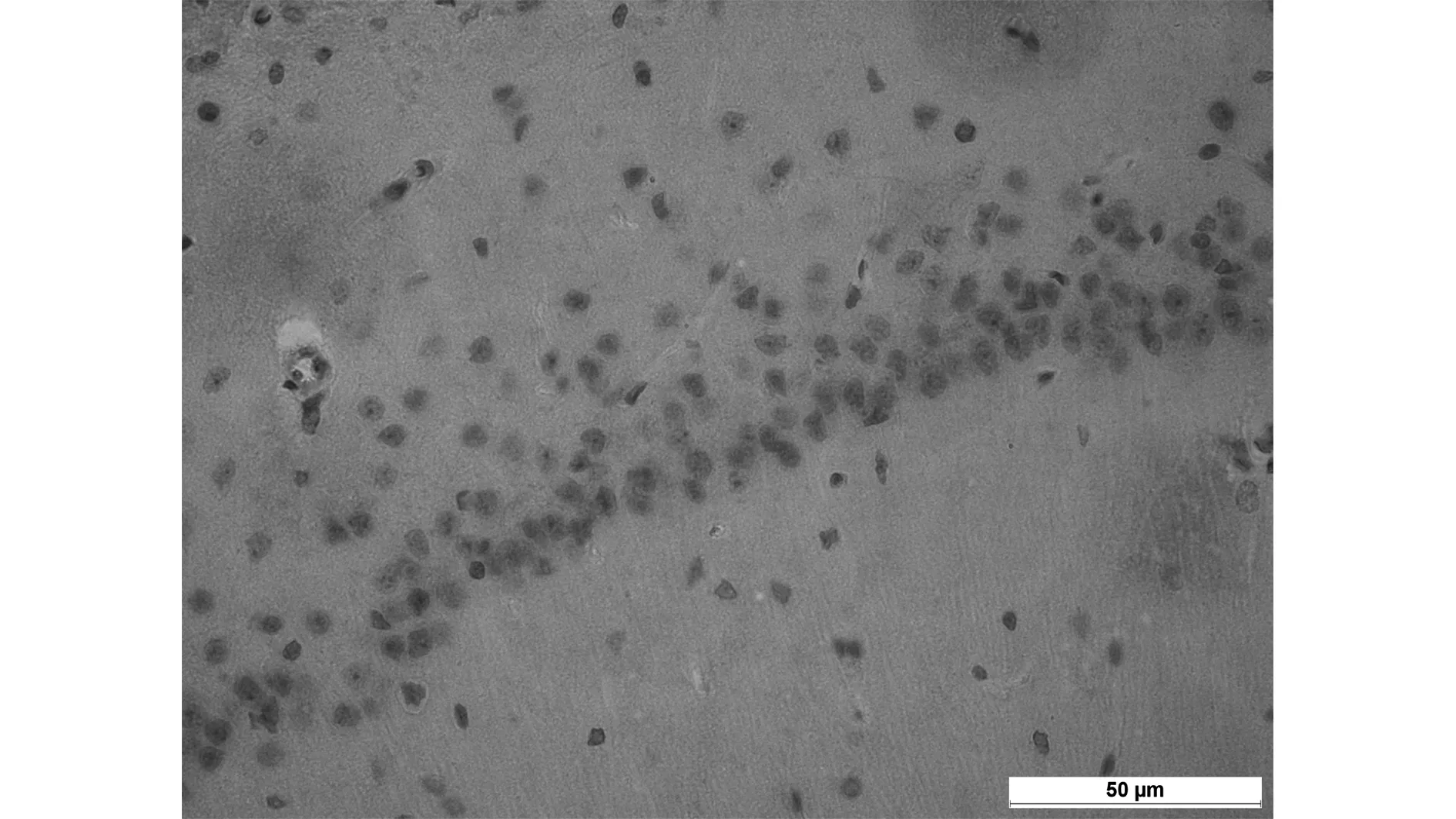
依达拉奉干预组
3 讨 论
糖尿病不仅是缺血性脑血管病的独立危险因素,而且可加重脑缺血再灌注后的损伤。本研究证明Fas介导的细胞凋亡机制是糖尿病加重脑缺血再灌注海马神经元损伤机制之一〔1〕,由此推测阻断Fas蛋白在糖尿病脑缺血再灌注后的表达,就会减少神经元的凋亡。
依达拉奉通过清除脑缺血后再灌注时大量产生的自由基及抑制脂质过氧化,减少神经细胞的凋亡,以及由脑缺血引起的脑水肿及神经细胞损伤,从而起到脑保护作用〔5~9〕。
本研究结果显示TUNEI检测糖尿病大鼠脑缺血再灌注海马区神经元的凋亡情况,显微镜观察显示,EDA治疗组凋亡的神经细胞数量均少于MCAO、MCAO+生理盐水组。Fas蛋白免疫组化分析,依达拉奉治疗组Fas阳性细胞数明显少于MCAO、MCAO+生理盐水组,P<0.01,与TUNEI检测的结果一致,说明依达拉奉在糖尿病脑缺血再灌注损伤的过程中,可能通过抑制细胞凋亡因子Fas蛋白的表达起到保护神经的作用。
综上所述,本研究显示依达拉奉可通过抑制细胞凋亡因子、减少细胞凋亡从而减轻糖尿病大鼠脑缺血再灌注损伤。提示糖尿病脑缺血急性期应用依达拉奉可减少凋亡因子的表达从而起到保护海马区神经的作用。但依达拉奉具体通过什么途径、对其他细胞凋亡因子的影响尚需进一步研究。
4 参考文献
1丁 欣,张季声,吴 军, 等. Fas蛋白在糖尿病大鼠局灶性脑缺血再灌注损伤后海马区的表达及意义〔J〕.解剖科学进展,2008;14(3):284-6.
2魏文石, 吴笃初, 吕传复. STZ-诱导慢性糖尿病大鼠大脑中动脉梗死模型的建立〔J〕. 中国临床神经科学, 2000;8(3): 226-8.
3Ito D, Tanaka K, Suzuki S,etal. Enhanced expression of ibal ionized cacium-binding adaoter molecule after transient focal cerebral ischemia in rat brain〔J〕. Stroke, 2001; 32(5):1208.
4Zea-longa E,Weinstain PR,Carlsoul S,etal. Reversible middle cerebral cuterg occlusion without craniectomy in rats〔J〕.Stroke, 1989; 20(1):84-9.
5Takeda T,Takeda S, Takumida M,etal. Protective effects of edaravone against ischemia-induced facial palsy〔J〕. Auris Nasus Larynx, 2008; 35(3):321-7.
6Nakamura T, Kume T, Katsuki H,etal. Protective effect of serofendic acid on ischemic injury induced by occlusion of the middle cerebral artery in rats〔J〕. Eur J Pharmacol, 2008;586(1-3):151-5.
7Amemiya S,Kamiya T,Nito C,etal. Anti-apoptotic and neuroprotective effects of edaravone following transient focal ischemic in rats〔J〕.Pharmacol,2005;516(2):125-30.
8Yury A, Bellido R, Takehiko S,etal. MCI-186(Edaravone), a free radical scavenger, attenuates, ischemia-reperfusion injury and activation of phospholipase A2 in anisolated rat lung model after 18h of cold preservation〔J〕. Eur J Cardio-Thoracic Sur,2006; 29(3):304-11.
9Noor JI,Ueda Y,Ikeda T,etal. Edaravone inhibits Lipid,peroxidation in neonatal hypoxic-ischemic rats:an in vivo microdialysis study〔J〕.Neurosci Lett, 2007;414(1):5-9.
