肺动脉高压大鼠心肌骨桥蛋白及其整合素β3受体表达的变化
2014-09-12王俊东杨达宽李治纲李树德
王俊东 杨达宽 李治纲 李树德
(昆明医科大学,云南 昆明 650500)
骨桥蛋白(OPN)是一种细胞黏附功能的分泌型糖基化磷蛋白,不仅是细胞外基质也是细胞信号转导因子。整合素是一类由α和β亚基组成的黏附分子,主要作用为介导细胞和细胞外基质及细胞之间的黏附和信号转导,其中整合素αvβ3可识别并结合OPN,经跨膜信号转导将信号转至胞内,与细胞的迁移等生理活动有关,在心血管病理生理机制中发挥重要的作用〔1〕。正常心肌细胞OPN呈低表达状态,但在病理状态下OPN在心肌细胞中呈高表达状态,与心肌肥大和心室重塑有密切关系〔2〕。本研究通过观察在肺动脉高压情况下OPN及其整合素β3受体基因在右心室心肌中的表达变化,探讨其与右心室重塑的关系,为临床诊治提供理论基础。
1 材料与方法
1.1动物 选取体重250~300 g的60只二级雄性SD大鼠,由昆明医学院实验动物中心提供。随机等分为5组,1个对照组和4个实验组,每组12只。
1.2试剂 Trizol-reagent RNA提取试剂盒、随机引物和M-MLV和RNase inhibitor (Invitrogen公司),Taq DNA polymerase(Promega公司),野百合碱(MCT,Sigma Chemical公司)。OPN和整合素β3鼠抗人单克隆抗体(工作液),羊抗鼠生物素化IgG(工作液)。
1.3建立肺动脉高压和右心室重塑动物模型 每组大鼠在注射MCT后第1、2、3、4周获取组织。这四个试验组分别简称PAH1、PAH2、PAH3和PAH4实验组。饲养1 w后皮下注射MCT (60 mg/kg),注射后第1、2、3、4周测量血流动力学指标并留取标本,每个时间点测10只大鼠〔3〕。对照组注射生理盐水后4 w重复测压。以放血的方式处死动物,迅速取出其心肺(置于液氮内待测)后剪下右心室,分别称取右心室(RV),左心室加室间隔(LV+S)的重量,计算右心室肥厚指数=〔Rv(LV+S)〕。
1.4RT-PCR法测定OPN和整合素β3 mRNA表达 根据Trizol一步法从冻存右心室中提取总RNA后采用20 μl反应体系逆转录合成cDNA。以OPN mRNA、整合素β3 mRNA和β-actin mRNA为模板设计引物后分别进行OPN、整合素β3与β-actin扩增,1.5%琼脂糖凝胶电泳产物后用凝胶成像仪观察,半定量分析条带峰面积(Image Master Total lab v1.01),分别计算OPN、整合素β3与β-actin光密度的比值。见表1。
1.5免疫组织化学染色法测定OPN和整合素β3蛋白的表达 采用SP法,石蜡切片(3~5 mm),常规脱水后微波加热修复12 min后加一抗于4℃过夜,复温后,加二抗,室温孵育25 min,加辣根酶标记链霉卵白素工作液室温孵育25 min,二氨基联苯胺(DAB)显色5~20 min,苏木素复染后显微镜观察并照相。阳性对照切片由我院病理科提供,磷酸盐缓冲液(PBS)代替一抗作为阴性对照。OPN和整合素β3表达在细胞胞质中,呈棕黄色的颗粒。采用IBAS 2.5全自动图像分析系统,每张切片在400倍光镜下分别取5个视野测定灰度值,求平均值。
1.6Western 印迹法检测OPN和整合素β3蛋白表达的水平 心肌组织常规蛋白电泳和膜转入。一次抗体反应(1∶200,4℃,12 h)后进行二次抗体反应(1∶1,1 h),与过氧化酶标记的链球菌抗生物素蛋白(1∶1) 反应1 h后用增强的蛋白反应系统探测免疫反应带,将反应带胶片置于ES2000扫描仪中扫描并将图像经Power Mac Photoshop6.0软件转送至NIH-Image 1.62软件中对反应带的面积和密度进行测定并计算。
1.7统计学方法 采用SPSS11.0软件。多组计量资料的比较采用方差分析,两两比较方差齐性者采用LSD法,方差不齐时采用Dunnettt3法;采用Pearson等级相关分析。
2 结 果
2.1各组OPN和整合素β3 mRNA及蛋白水平 对照组大鼠右心室心肌OPN及其整合素β3 mRNA表达水平低于肺动脉高压各组(P<0.05),且随着肺动脉高压时间延长,两者表达水平均呈升高趋势(P<0.05)。见表2,图1。OPN和整合素β3主要表达于心肌细胞质中,在光镜下呈棕黄色染色。对照组心肌OPN和整合素β3受体表达水平均很低。肺高压组心室心肌OPN和整合素β3受体表达水平增高,并随着肺动脉高压产生的时间延长而增高(P<0.01),见图2。
2.2右心室肥厚指数与OPN和整合素β3 mRNA的表达的相关性分析 右心室心肌0PN mRNA及整合素β3 mRNA表达水平与右心室肥厚指数均呈正相关关系,相关系数分别为0.828、0.822(P<0.05)。
2.3Westem 印迹检测各组OPN和整合素β3检测蛋白表达水平 在实验第4周,PHA4组大鼠右心室心肌组织OPN和整合素β3蛋白表达水平(分别为16.67±1.73 和14.28±1.22)均高于对照组(分别为4.42±0.72和3.93±0.70),P<0.01。见图3。

表1 大鼠OPN,整合素 β3及β-actin引物

表2 各组大鼠OPN与整合素β3 mRNA表达变化
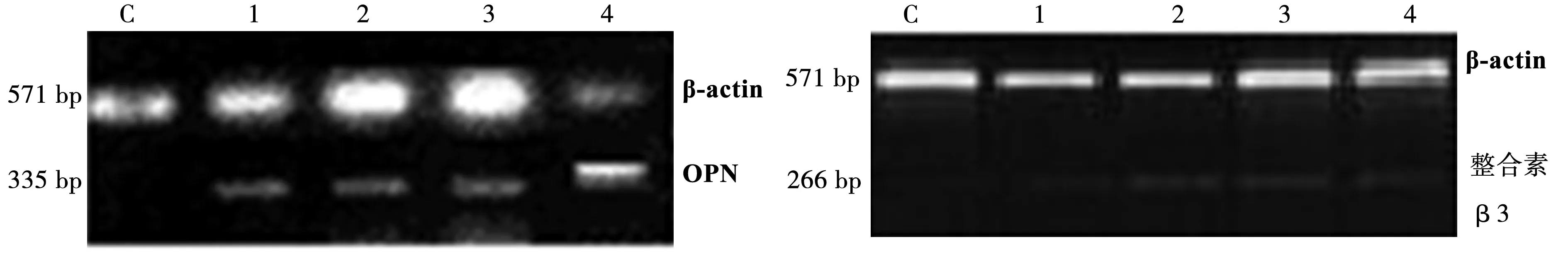
C,1,2,3,4分别为对照组,PHA1,PHA2,PHA3和PHA4组
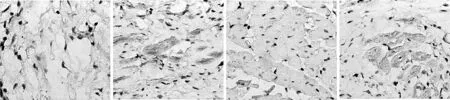
对照组,OPN PHA4组,OPN 对照组,整合素β3 PHA4组,整合素β3
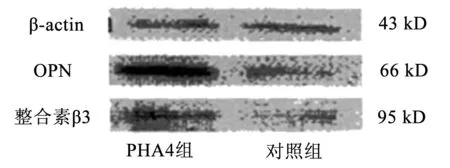
图3 OPN和整合素β3蛋白免疫印迹图
3 讨 论
肺动脉高压是肺心病患者的常见病理特征,发展末期常导致心肌损伤从而形成右心室肥大。肺动脉高压的发生机制十分复杂,有多种因素参与此病理过程〔4~12〕。有学者认为心肌细胞生长及肥大的过程与细胞外基质蛋白和整合素有关〔13〕。OPN是一种含有能与心肌细胞表面整合素β3结合的RGD结构的非胶原性细胞外基质,与血管平滑肌及心肌细胞的迁移、增殖和分化等过程有密切关系〔13〕。Chen等〔4〕研究发现OPN是血管平滑肌细胞由收缩表型向合成表型转化的标记,抑制血管平滑肌细胞的凋亡,在抗炎和损伤修复过程中的重要作用。整合素β3基因通过识别并结合RGD结构从而参与细胞活动,生长因子等能够提高鼠心肌间质纤维细胞ανβ3 mRNA水平,并激活细胞信号转导通路,进一步促进细脆生长,可能与心肌重建有关〔10,11〕。
本次研究结果提示肺动脉高压情况下右室心肌中OPN及其整合素β3受体mRNA表达增加,可能与肺动脉高压下右室肥大的发生机制有关;并且证实OPN和整合素β3受体蛋白表达和右心肥大的产生有密切关系。推测OPN及其整合素β3受体高表达与肺动脉高压时右心室肥大有关。作用机制可能是肺动脉高压下右心室压力增加导致OPN增加,OPN增加导致整合素β3受体与其结合增加从而激活细胞生长信号转导通路刺激细胞增长加快从而重建右心室。
综上,右心室心肌OPN及其受体整合素β3基因表达随着大鼠肺动脉高压及右室肥大形成逐渐增加,可能在右心室心肌重塑中起重要的作用。
4 参考文献
1Li G,Chen YF,Kelpke SS,etal.Estrogen attenuates integrinbeta(3)-de-pendent adventitial fibroblast migration after inhibition of osteopontin production in vascular smooth muscle cells〔J〕.Circulation,2000;101(25):2949-55.
2Trueblood NA,Xie Z,Communal C,etal.Exaggerated left ventricular dilation and reduced collagen deposition after myocardial infarction in mice lacking osteopontin〔J〕.Circ Res,2001;88(10):1080-7.
3Okada K,Tanaka Y,Bernstein M,etal.Pulmonary hemodynamics modify the rat pulmonary artery response to injury:a neointimal model of pulmonary hypertension〔J〕.Am J Patbol,1997;151(4):1019-25.
4Chen YF,Feng JA,Li P,etal.Atrial natriuretic peptide - dependent modulation of hypoxia - induced pulmonary vascular remodeling〔J〕.Life Sci,2006;79(14):1357-65.
5Renault MA,Jalvy S,Belloc I,etal.AP - 1 is involved in UTP - induced osteopontin expression in arterial smooth muscle cells〔J〕.Circ Res,2003;93(7):674-81.
6Liou YM,Chang LY,Liaw JM,etal.Osteopontin gene expression in the aorta and the heart of propylthiouraeil - induced hypothyroid mice〔J〕.J Biomed Sci,2005;12(6):869-80.
7Weintraub AS,Lin X,Itskovich VV,etal.Prenatal detection of embryo resorption in osteopontin - deficient mice using serial noninvasive magnetic resonance microscopy〔J〕.Pediatr Res,2004;55(3):419-24.
8Tamura A,Shingai M,Aso N,etal.Osteopontin is released from the heart into the coronary circulation in patients with a previous anterior wall myocardial infarction〔J〕.Circ J,2003;67(9):742-4.
9Hsueh WA,Law RE,Do YS.Integrins,adhesion,and cardiac remodeling〔J〕.Hypertension,1998;31(1 Pt 2):176-80.
10武宗寅,喻林升.低氧高二氧化碳性肺动脉高压大鼠血浆内皮素和肺细小动脉显微形态的变化〔J〕.中国病理生理杂志,1997;13(4):383-5.
11Gravallese EM.Osteopontin:a bridge between bone and the immune system〔J〕.J Clin Invest,2003;112(2):147-9.
12Xie Z,Singh M,Singh K.Osteopontin modulates myocardial hypertrophy in response to chronic pressure overloas in mice〔J〕.Hypertension,2004;44(6):826-31.
13Swynghedauw B.Molecular mechanisms of myocardial remodeling〔J〕.Physiol Rev,1999;79(1):215-62.
