芹菜素对膀胱癌T24细胞增殖、凋亡和CyclinD1、 Caspase-3表达的影响
2014-09-12高瑞林李毅宁张建育郭一泓
高瑞林 李毅宁 张建育 郭一泓
(福建医科大学附属第二医院泌尿外科,福建 泉州 362000)
膀胱癌治疗多采用保留膀胱的经尿道电切术进行治疗。而保留膀胱的各种手术治疗后,约的患者在2年内肿瘤可能复发,故常采用术后膀胱内药物灌注治疗以预防其复发,但却存在不同程度的多药耐药。芹菜素,又称芹黄素、洋芹素,广泛分布于温热带的蔬菜和水果中,尤以芹菜中含量为高;在一些药用植物如车前子、络石藤等中也有很高的含量,植物源性饮料如茶、酒以及一些调味品中也有分布。芹菜素是一种植物黄酮类化合物,具有多种生物学活性和药理作用,它具有抗肿瘤、抗氧化、抗炎、镇静等作用〔1〕,尤其在抗肿瘤方面,包括抗乳腺癌〔2〕、宫颈癌〔3〕、卵巢癌〔4〕、胰腺癌〔5〕、肝癌〔6〕、胃癌〔7〕、白血病等〔8〕。其抗肿瘤机制复杂,主要是抑制肿瘤细胞的增殖、侵袭和转移,干扰肿瘤细胞的信号转导,诱导肿瘤细胞凋亡、降低肿瘤细胞的多重耐药性以及减少抗肿瘤药物(如丝裂霉素和环磷酰胺等)对正常细胞的毒性等〔9〕作用,为预防膀胱癌术后复发提供了一种新选择。本文通过研究芹菜素对膀胱癌T24细胞增殖、凋亡及CyclinD1、Caspase-3表达的影响来探讨芹菜素抗膀胱癌的机制。
1 材料与方法
1.1材料 T24人移形细胞膀胱癌细胞,购自中国科学院上海细胞生物学研究所(Shanghai Institute of Cell Biology,Chinese Aeademyof Seienees)。芹菜素,中国药品生物制品检定所(批号:111901-201102);CyclinD1、Caspase-3抗体,美国Santa Cruz公司;胎牛血清(FBS), RPMI 1640,胰蛋白酶为Gibco BRL公司;DMSO购自Amresco 公司;CCK-8试剂盒,同仁化学研究所;TRIzol、ECL化学发光试剂盒,Invitrogen 公司。PVDF膜(Millipore公司),BCA蛋白测定试剂盒(Pierce公司,美国)。其余试剂均为进口或国产分析纯。
1.2细胞培养 T24细胞培养使用的是含10%小牛血清、100 U/ml青霉素及100 μg/ ml链霉素的RPMI-1640培养基,在5%CO2、饱和湿度、37 ℃孵箱中培养,更换培养液,待细胞生长至贴满培养瓶壁时,用0.25%胰酶消化传代。取对数生长期细胞用于实验。
1.3CCK8测定细胞增殖 收集对数生长期T24膀胱癌细胞制备成密度为1×106的细胞悬液,接种于96孔板(100 μl/孔),置于培养箱培养24 h(37℃,5%CO2)。然后加入芹菜素(终浓度0,25,50,75,100 μmol/L,每组细胞设6个复孔),分别培养24,48,72 h。吸除培养基,并用PBS洗涤细胞两次后加入新的培养基,然后加入10 μl CCK8溶液。置于细胞培养箱内继续孵育1 h,采用酶标仪在450 nm波长处测定OD值。加入相应量细胞培养液和CCK8溶液但没有加入细胞的孔作为空白独照。细胞增殖率(%)=〔A(加药)-A(空白)〕/〔A(加药)-A(空白)〕×100。
1.4流式细胞术检测芹菜素对T24细胞周期及凋亡的影响 收集对数生长期的T24细胞106/孔接种于6孔细胞培养板中。培养24 h后,分别用0,50,75,100 μmol/L的芹菜素处理细胞48 h,各组均设3个复孔。①用不含EDTA的胰蛋白酶收集处理后的细胞,800 r/min(r=12 cm) 离心10 min,沉淀采用300 μl PBS重悬,逐滴加入700 μl预冷的无水乙醇中,乙醇终浓度为70%,4 ℃避光固定过夜。离心10 min,去上清。PBS洗两次。重悬细胞于500 μl 含100 U/ml的RNase A的PBS缓冲液中,避光,37℃孵育30 min。加2 mg/ml PI至终浓度50 μg/ml,避光孵育30 min。流式细胞仪检测细胞周期。②以无EDTA的2.5 g/L胰蛋白酶收集上清漂浮细胞和底壁细胞。加200 μl上样缓冲液重悬,加入2 μl Annexin-FITC,5 μl PI,孵育后行流式细胞仪检测细胞凋亡情况。
1.5Western印迹检测CyclinD1、Caspase-3的蛋白表达 收集对数期细胞制备成密度1×106个/ml的细胞悬液,接种于24孔板(100 μl/孔),加入0,50,75,100 μmol/L共孵育48 h,用RIRP裂解液裂解细胞并提取总蛋白。用BCA法测定测定所提取蛋白的浓度,置于-20℃保存备用。取蛋白50 μg进行SDS聚丙烯胺凝胶电泳后,转移蛋白至PVDF膜,5%脱脂奶粉封闭2 h,加入第一抗体4℃孵育过夜,TBST洗膜(10 min×3);加入二抗室温孵育60 min,用TBST洗10 min×3次;再用TBS洗膜10 min。ECL浸泡后X片曝光,分析结果。所用内参为β-actin。

2 结 果
2.1对T42细胞的生长抑制作用 CCK-8结果显示不同浓度的芹菜素(0,25,50,75,100 μmol/L)作用于细胞后,在各时间点对T42细胞的增殖均有抑制作用,见表1。随着芹菜素浓度增加细胞死亡率增加,细胞毒作用呈明显的时间和剂量依赖性。与对照组相比,50 μmol/L以上浓度药物可明显抑制T24细胞增殖(P<0.05);药物浓度低于25 μmol/L时对细胞抑制作用不明显,与对照组无明显差异。根据该试验结果,选取50,75,100 μmol/L芹菜素浓度进行后续实验。
2.2芹菜素对T-24细胞凋亡的影响 50、75、100 μmol/L芹菜素溶液作用于膀胱癌T24细胞48 h后,呈浓度依赖性改变细胞周期分布,一方面降低G2/M期的细胞比例,另一方面增高G0/G1期细胞的比例,说明芹菜素可能通过阻滞细胞在G0/G1期来抑制细胞增殖。见表2。同时经流式细胞术检测,与空白对照组相比芹菜素处理各组细胞凋亡率明显增加(P<0.05);细胞凋亡率随着药物浓度增加而增加,各浓度药物处理组之间细胞凋亡率差异也具有统计学意义(P<0.05)。
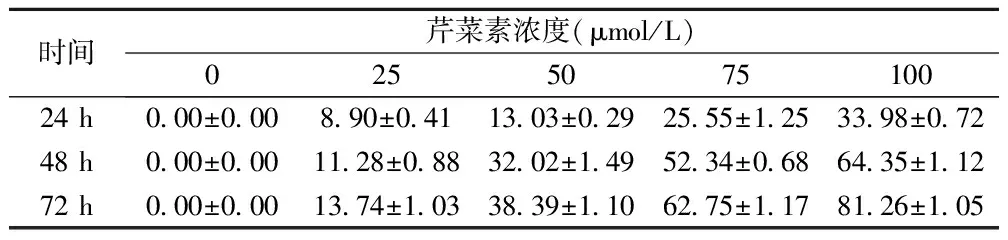
表1 芹菜素作用于T24细胞24、48、72 h后对其增殖的影响(%)
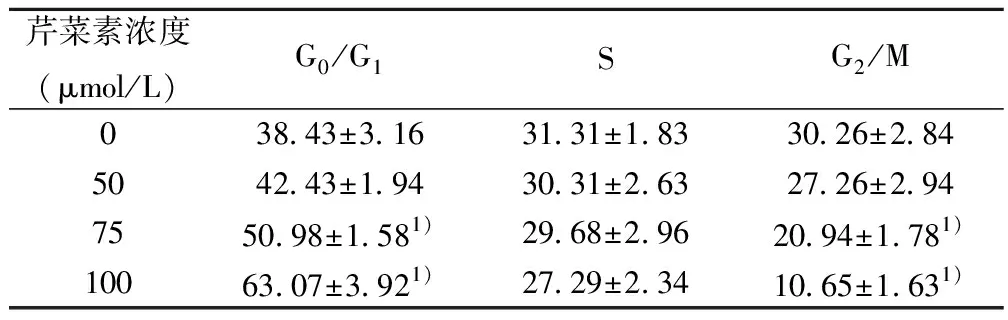
表2 不同浓度芹菜素作用膀胱癌T24细胞后细胞周期分布(%)
2.3芹菜素对CyclinD1和Caspase-3蛋白表达的影响 用50、75、100 μmol/L芹菜素分别作用T24细胞48 h,Western印迹法检测各浓度组CyclinD1和Caspase-3蛋白表达水平的差异见表3,图1。芹菜素能剂量依赖性抑制CyclinD1表达,同时增强Caspase-3表达。CyclinD1和Caspase-3蛋白免疫印迹条带分别和内参条带进行灰度比。各组进行统计学处理,与对照组相比,各组间有显著差异(P<0.05)。各组间差异具有统计学意义, 蛋白表达水平随用药浓度增加而升高, 蛋白表达水平随用药浓度降低。

图1 Western 印迹检测CyclinD1和Caspase-3蛋白表达
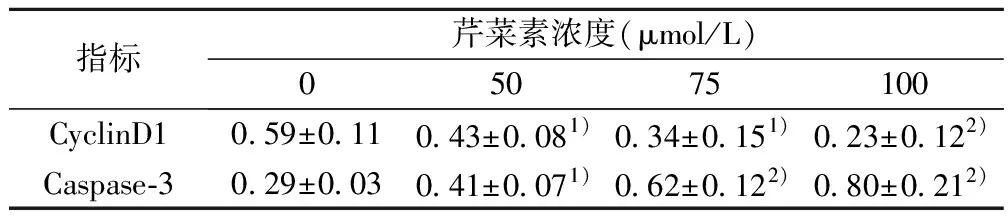
表3 Western 印迹检测CyclinD1和Caspase-3蛋白表达(%)
3 讨 论
膀胱癌发病率居恶性肿瘤的第9位〔10〕。在我国,男性膀胱癌发病率位居全身肿瘤的第8位,女性排在第12位以后〔11〕,发病率远低于西方国家。近年来,我国部分城市肿瘤发病率报告显示膀胱癌发病率有增高趋势〔12,13〕,其生物学行为复杂多变,突出表现为易复发、多发、浸润和转移等。膀胱癌的发生是多基因多步骤的复杂过程,已证明与多种抑癌基因异常表达有一定的相关性。细胞周期是细胞从上一次分裂结束开始生长到下一次分裂终了所经历的过程,所需的时间即为细胞周期。分为G1、S、G2、M期。G1期是DNA合成前期,G2期是DNA合成后期,S期是DNA合成期,M期指有丝分裂期。恶性肿瘤通常表现为细胞分化能力降低、存活能力增加,从而引起分化不足和生长失控〔14〕。
Cyclin D1是细胞周期控制的关键因素之一,可与 CDK4,6结合,使细胞越过G1~S细胞周期检查点,进入S期,多种肿瘤细胞 Cyclin D1过度表达,使G1期缩短,增殖速度加快,并可呈非丝裂原依赖性〔15,16〕。研究发现:CyclinD1在多种肿瘤中高表达,并且其表达与肿瘤的增殖活性和侵袭力有密切关系,也是判断肿瘤预后的一个重要指标。CychinD1对多种肿瘤的发生发展有重要的作用,如:乳腺癌、食道癌、膀肤癌和肺癌〔17~20〕。CychinD1的高表达在癌症中常见事件,但单独作为基因扩增的结果不会发生。相反,CychinD1水平升高一般是有翻译后水平调节缺陷引起的。这些研究表明,诱导CyclinD1降解可能为治疗干预癌症提供一个有效的途径〔21,22〕。
Caspase-3是细胞凋亡反应中的执行者和关键酶〔23〕,直接参与介导细胞凋亡过程。Caspase-3编码35 kD,由Fernandes-Alnemri T最早从人类的Jurkat T淋巴细胞中克隆出来的〔24〕。大多数情况下,Caspase-3是无活性的,以酶原形式存在于细胞质中,广泛表达于多种肿瘤组织及正常人体组织,可通过内源性的线粒体通路和外源性的死亡受体通路这两条途径被激活〔25〕。活化后的Caspase-3再继续激活Caspase-2,6,8,10等,级联激活的caspases最终水解细胞骨架蛋白以及核酸,最后引起细胞凋亡〔26〕。
本研究发现,芹菜素呈时间及剂量依赖方式抑制膀胱癌T24细胞增殖,诱导T24细胞死亡。通过流式细胞术检测结果可见,芹菜素诱导的膀胱癌T-24细胞死亡以凋亡为主,但并不排除坏死性细胞死亡。芹菜素可通过下调Cyclin D1使肿瘤细胞阻滞于G1期,从而抑制细胞增殖。同时,诱导细胞剪切活化型Caspase-3表达增高,直接剪切DNA,促使细胞凋亡。因此,芹菜素可以通过抑制Cyclin D1从而抑制细胞增殖,同时,还可以通过启动Caspase-3等的表达或活化从而诱导凋亡,芹菜素对膀胱癌T24细胞具有抑制增殖和诱导凋亡双重作用,这可能是芹菜素的抗肿瘤机制之一。但是其抑制肿瘤生长和诱导凋亡的确切作用机制目前尚未完全明确,因此对其机制的探讨以及芹菜素更广阔的使用价值还有待更深入研究。
4 参考文献
1吴华涛,马 涛,孟 勇.芹菜素对肿瘤抑制作用研究进展〔J〕.中国现代医生,2009;47(6):41-4.
2Leew J,Chen WK,Wang CJ,etal.Apigenin inhibits HGF-promoted invasive growth and metastasis involving blocking PI3K/Akt pathway and B4 integrin function in MDA-MB-231 breast cancer cells〔J〕.Toxicol Appl Pharmacol,2008;226(2):178-91.
3Zheng PW,Chiang LC,Lin CC.Apigenin induced apoptosis through p53-dependent pathway in human cervical carcinoma cells〔J〕.Life Sci,2005;76(12):1367-79.
4杜俊瑶,辛 彦.芹菜素抑制人卵巢癌CAOV3细胞增殖的研究〔J〕.中国实用妇科与产科杂志,2007;3(5):374-5.
5Golkar l,Salabat MR,Ujiki MB,etal.Apigenin inhibits pancreatic cancer cellp roliferation via down-regulation of hypoxia inducible factor-1α (HIF-1α) and the glucose transporter (GLUT-1) 〔J〕.J Surg Res,2007;137(2):191-2.
6Kkanth Sultanas.Apigenin induces apoptosis in HepG2 cells:possible role of TNF-a and IFN-γ〔J〕.Toxicology,2006;217(2-3):206-12.
7胡太平,曹建国.芹菜素诱导人胃癌细胞凋亡作用及机制研究 〔J〕.国际病理科学与临床杂志,2007;27(10):6-10.
8Vargo MA,Voss OH,Poustk AF,etal.Apigenin-induced-apoptosis is mediated by theactivation of PKCD and caspases in leukemia cells〔J〕.Biochem Pharmacol,2006;72(6):681-92.
9Siddique YH,Beg T,Afzal M.Antigenotoxic effect of apigenin against anti-cancerous drugs〔J〕.Toxicol In Vitro,2008;22(3):25-31.
10Parkin DM,Bray F,Ferlay J,etal.Global cancer statistics,200〔J〕.CA Cancer J Clin,2005;55(2):74-108.
11虞颂庭,臧美孚,夏 溟.尿路上皮肿瘤概论.吴阶平.吴阶平泌尿外科学〔M〕.济南:山东科学技术出版社,2004:919-42.
12魏矿荣,陈振雄,梁智恒,等.中山市1970-1999年膀胱癌发病趋势分析〔J〕.中国肿瘤,2005;14(4):235-7.
13张 薇,项永兵,刘振伟,等.1973-1999年上海市区老年人恶性肿瘤发病趋势分析〔J〕.中华老年医学杂志,2005;24(19):701-704.
14Blagosklonny MY.Apoptosis,proliferation,differentiation:in search of theorder〔J〕.Semin Cancer Biol,2003;13(2):97-105.
15胡海一,张澍田.CyclinD1表达与肿瘤关系的研究进展〔J〕.临床和实验医学杂志,2007;6(7):143-5.
16Kamb A,Gruis NA,Weaver-Feldhaus J,etal.A cell cycle regulator potentially involved ingenesis of many tumor types〔J〕.Science,1994;264(5157):436-40.
17Vermeulen K,VanBoekstaele DR,Berneman ZN.The cell cycle:a review of regulation,deregulation and therapeutic targets in cancer〔J〕.Cell Prolif,2003;36(3):131-49.
18Knudsen KE,Diehl JA,Haiman CA,etal.Cyclin D1:polylmorphism,aberrant splicing and cancer risk〔J〕.Oncogene,2006;25(11):1620-8.
19Musgrove EA.Cyclin D1:roles in mitogenic signaling and oncogenic transformation〔J〕.Growth Factors,2006;24(1):13-9.
20Yamamoto M,Tamakawa S,Yoshie M,etal.Neoplastic hepatocyte growth associated with cyclin D1 redistribution from the cytoplasm to the nucleus in mouse hepatocarcinogenesis〔J〕.Mol Carcinog,2006;45(12):901-13.
21Feng Q,Sekula D,Muller R,etal.Uncovering residues that regulate cyclin Dl proteasomal degradation〔J〕.Oncogene,2007;26(35):5098-106.
22Huang JW,Shiau CW,Yang YT,etal.Peroxisome proliferator-activated receptor gamma-independent ablation of cyclin D1 by thiazolidinediones and their derivative in breast cancer cells〔J〕.Mol Pharmaeol;2005;67(4):1342-8.
23Garcia-Calvo M,Peterson EP,Rasper DM,etal.Purification and catalytic properties of human caspase family members〔J〕.Cell Death Differ,1999;6(4):362-9.
24Fernandes-Alnemri T,Litwack G,Alnemri ES.CPP32,a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1 beta-converting enzyme〔J〕.J Biol Chem,1994;269(49):30761-4.
25Boehning D,van Rossum DB,Patterson RL,etal.A peptide inhibitor of cytochrome c/inositol 1'4'5-trisphosphate receptor binding blocks intrinsic and extrinsic cell death pathways〔J〕.Proc Natl Acad Sci USA,2005;102(5):1466-71.
26Nicholson DM,Thornberry NA.Caspase:killer proteases〔J〕.Trends Biochem Sci,1997;22(8):299-306.
