Livin和VEGF在甲状腺癌中的表达及与临床病理因素的相关性
2014-09-12白建平秦大伟
白建平 张 霆 秦大伟
(解放军254医院普通外科,天津 300142)
甲状腺癌是最常见的甲状腺恶性肿瘤,约占全身恶性肿瘤的1%〔1〕。细胞增殖与凋亡失衡导致了肿瘤的发生,肿瘤细胞凋亡调节失调造成的细胞凋亡抵抗是肿瘤发生的主要原因之一〔2〕。凋亡抑制蛋白(Livin)是新发现的凋亡抑制蛋白家族(IAPs)中的一员,其过度表达导致的凋亡不足和肿瘤的发生、发展有关〔3〕。血管内皮生长因子(VEGF)是一种高度特异性的血管内皮细胞有丝分裂素,可以刺激血管内皮细胞增殖、迁移并诱导新生血管生成,积极参与甲状腺肿瘤的生长和浸润过程〔4〕。本研究利用免疫组化的方法分析VEGF和Livin在甲状腺癌组织中的表达及其与甲状腺癌的临床病理特征的关系,为临床上诊疗甲状腺癌提供理论支持。
1 资料和方法
1.1一般资料 选取2011年1月至2013年6月于我院进行手术治疗的甲状腺疾病患者153例。经病理检查确诊为甲状腺癌患者82例,在就诊前均未行放射治疗、化疗治疗,其中男27例,女55例,年龄34~76〔平均(42.1±13.9)〕岁;甲状腺腺瘤患者16例,其中男5例,女11例,年龄32~74〔平均(41.9±14.6)〕岁;结节性甲状腺肿患者33例,其中男12例,女21例,年龄27~75〔平均(38.9±17.6)〕岁;同期手术无癌侵犯的癌旁组织22例,其中男12例,女10例,年龄23~70〔平均(44.1±11.8)〕岁。对四组患者性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2主要试剂 鼠抗人VEGF单克隆抗体及免疫组化试剂盒购于福州迈新生物制品公司。兔抗人Livin蛋白多克隆抗体购于武汉博士德生物工程有限公司。
1.3方法
1.3.1SP免疫组化法 操作步骤按试剂盒说明书进行,用石蜡将标本包埋后备用,进行苏木素-伊红(HE)染色。每份标本取3份切片,石蜡标本组织连续性切片,切片厚4 μm,常规脱蜡、水化。行高温高压及微波抗原修复处理,一抗4℃过夜,加入抗一抗的二抗后常温孵育30 min, 二氨基联苯胺(DBA)显色,显色后再使用HE复染,中性树脂脱水封固后判断结果。用试剂公司提供的强阳性标本切片作为阳性对照,磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
1.3.2观察指标 在400倍光镜下判断结果,每份切片取10个高倍镜视野采取双盲法阅片,观察记录切片中阳性细胞占同类观察细胞总数的百分比和其着色强度。阳性细胞的判定标准:棕黄色颗粒主要位于细胞核内,或者胞核伴胞质内,若只有胞质出现棕黄色为非特异性染色。染色强度评分标准:无色判为0分,淡黄色判为1分,棕黄色判为2分,棕褐色判为3分;阳性细胞所占的百分比计分标准:阴性计为0分,阳性细胞 ≤10%计为1分,阳性细胞11%~50%计为2分,阳性细胞51%~75%计为3分,阳性细胞>75%计为4分。切片阳性判断标准为染色强度与阳性细胞百分比的分值乘积3分或以上。
1.4统计学方法 采用SPSS21.0软件进行分析,计数资料采用χ2检验,VEGF和Livin表达的相关性采用Spearman等级相关进行分析。
2 结 果
2.1VEGF和Livin在不同甲状腺组织中的表达情况 VEGF、Livin在不同甲状腺组织中的表达存在差异(P<0.05),其中甲状腺癌组织中VEGF、Livin表达最高。见表1。
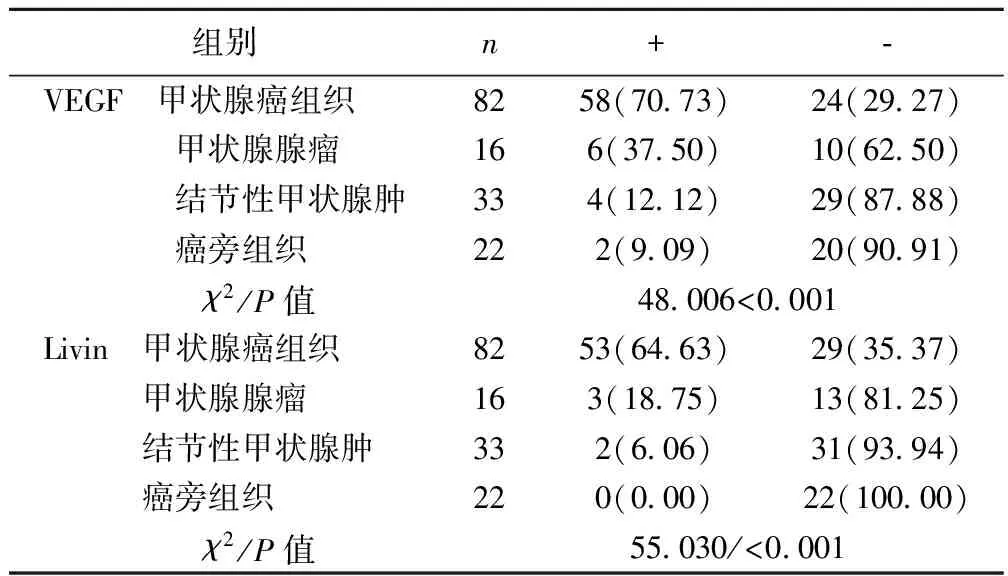
表1 VEGF和Livin在不同甲状腺组织中的表达〔n(%)〕
2.2VEGF的表达与甲状腺癌患者临床病理指标及与Livin表达的关系 VEGF的表达与甲状腺癌病理类型、TNM分期、是否伴随淋巴结转移及Livin表达有关(P<0.05)。见表2。
2.3Livin和VEGF在甲状腺癌组织表达的相关性 由Spearman相关性检验结果可见,在甲状腺癌组织中,Livin和VEGF的表达呈正相关关系(r=0.421,P=0.000)。其中Livin(-),VEGF(-)16例;Livin(-),VEGF(+)13例;Livin(+),VEGF(-)8例;Livin(+),VEGF(+)45例。
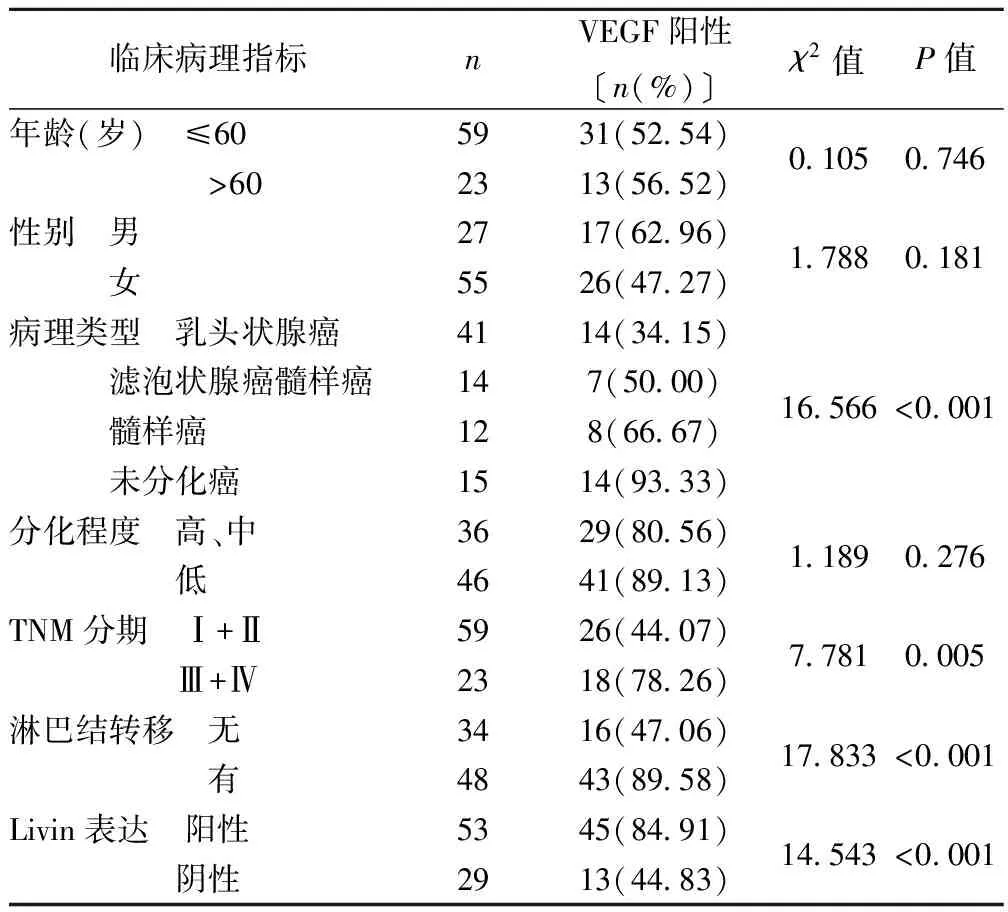
表2 VEGF的表达与甲状腺癌患者临床病理指标及与Livin表达的关系
3 讨 论
Livin基因位于人第20号染色体上,全长46 kb,包括7个外显子和6个内含子,Livin的抗凋亡活性主要依赖于其杆状病毒IAP重复区(BIR)的结构域,Livin的BIR结构和其他IAP成员类似,包含4个α螺旋、1个三股反向平行的β片层结构及一些相应的氨基酸残基,这三个结构上的突变会造成Livin生物学作用的变化,改变其抗凋亡的活性〔5, 6〕。Livin的BIR结构域和环指结构还是泛素化的靶点及随后的水解位点。Livin抑制肿瘤细胞凋亡的机制包括:(1)直接抑制easpase或procaspase;(2)转化生长因子(TGFP)激活激酶(TAKl)依赖的c-Jun氯基末端激酶(JNKl)的激活;(3)Livin的抗凋亡作用还受到线粒体释放的caspase活化蛋白(SMAC)的调节〔7~9〕。
VEGF可以在生理或病理情况下促进血管生成, 可以增强血管内皮细胞有丝分裂活性,并促进内皮细胞的活化与迁移,是最重要的一种促血管生成蛋白〔10, 11〕。研究发现,VEGF及VEGF-mRNA在很多实体癌如宫颈癌、肺非小细胞癌等组织中表达较正常组织明显升高并和预后有密切关系〔12, 13〕。本研究结果提示VEGF的高表达是甲状腺癌生物学行为活跃的风向标,预示着高侵袭性及易转移性,甲状腺组织中VEGF的高表达可以作为甲状腺癌诊断和预后判断的有效指标之一〔14〕。
本研究发现,VEGF、Livin主要在甲状腺细胞中表达,其高表达可能和甲状腺癌的发生发展有关。在甲状腺癌组织中,提示Livin和VEGF在甲状腺癌的局部浸润、远处转移及血管生成过程中具有协同作用。
总而言之,VEGF及Livin异常表达可能和甲状腺癌发生发展有关,可应用于临床诊治甲状腺癌患者和判断预后。
4 参考文献
1刘剑鸣.甲状腺癌分子生物学的研究进展〔J〕.中国普通外科杂志, 2010;19(5):564-8.
2王丹玲.肿瘤微环境与肿瘤的进展和转移〔J〕.癌症进展, 2010;8(5):445-9.
3刘石萍,史延卿,王 琦,等.食管鳞癌中Livin及相关蛋白的表达及意义〔J〕.现代中西医结合杂志, 2013;22(11):1150-2.
4吴泽建,谢楚平,蒋基令,等.甲状腺癌中survivin与VEGF因子的表达及其临床意义〔J〕.中国现代医学杂志, 2011;21(10):1158-60.
5王 秋. Livin在恶性肿瘤中的研究进展〔J〕.肿瘤预防与治疗,2011;24(5):250-3.
6洪思蔚.凋亡抑制蛋白Livin与消化系统肿瘤的相关研究进展〔J〕.医学综述, 2013;19(4):629-31.
7李 旭, 李 岩, 程世孝, 等. Livin基因增强骨肉瘤转化和顺铂耐药性的体外实验研究〔J〕.中国医科大学学报, 2013;42(8):673-7, 696.
8朱立君,崔东旭,刘宝林,等.肝外胆管癌中Livin的表达及其与临床病理特征的关系〔J〕.中国普通外科杂志, 2010;19(2):195-7.
9李珍发,彭 健,何剪太,等.凋亡抑制因子Livin的研究进展〔J〕.现代生物医学进展,2008;8(4):786-9.
10尹冬青,章华元,吴 雯. COX -2、VEGF、TGF-β1在甲状腺癌中的表达及其临床意义〔J〕.医学研究杂志, 2012;41(4):162-5.
11张 帅,沈 梁,谷维立,等. VEGF、COX-2在甲状腺癌中的表达及临床意义〔J〕.医学研究杂志, 2012;41(2):146-50.
12冯广加,何莲芝. VEGF-C、VEGF-D及VEGFR-3在宫颈癌组织中的表达及其意义〔J〕.现代中西医结合杂志, 2013;22(6):571-3, 588.
13张利斌,王 平,熊 健,等.非小细胞肺癌中VEGF-C、VEGF-D、VEGFR-3表达与微淋巴管密度的关系〔J〕.安徽医科大学学报, 2013;48(8):933-7.
14李小民,黄作良,付祥芳,等.甲状腺癌患者血清中TSGF和VEGF联合检测的临床价值〔J〕.医学综述, 2012;18(22):3850-1.
