SiHa细胞中miR-886-5p表达抑制稳定细胞系的建立
2014-09-12王建新马翠花
王建新 马翠花
(秦皇岛市第一医院检验科, 河北 秦皇岛 066000)
宫颈癌已成为女性生命和健康的严重威胁〔1~3〕。尽管高致病性人乳头瘤病毒(HPV)的感染被认为是宫颈癌的主要发病原因,但越来越多的证据表明HPV感染并非宫颈癌发病的单一因素〔4〕。microRNAs(miRNAs)是一类长约21~24个核苷酸的内源性非编码小分子RNA,抑制很多靶基因的表达〔5〕。miRNAs在调节细胞增殖、凋亡以及肿瘤的发生过程中起重要作用〔6,7〕。很多miRNAs在不同的癌组织中都有异常表达,可能与肿瘤的发生相关〔8~10〕。研究发现在宫颈癌中miRNAs的异常表达与宫颈癌的发生发展密切相关〔11~13〕。基因芯片研究发现miR-886-5p在宫颈癌中的表达明显高于癌周及正常组织〔14〕。本实验通过稳定转染宫颈癌SiHa细胞带有绿色荧光蛋白(GFP)标签的miR-886-5p inhibitor/NC,抗生素筛选后选择表达GFP的阳性克隆进行培养,得到稳定表达抑制miR-886-5p的SiHa细胞系,为深入研究miR-886-5p在宫颈癌SiHa细胞中的作用提供了良好的实验模型。
1 材料和方法
1.1实验材料 宫颈癌SiHa细胞购自协和医科大学基础医学研究所。带有GFP标签的抑制miR-886-5p表达质粒及对照质粒(miR-886-5p inhibitors/NC)均来自中国吉玛公司。主要试剂:DMEM 培养基购自GIBCO 公司,三氯甲烷、异丙醇和无水乙醇均购自北京化学试剂公司,TRIzol 试剂,MML-V试剂盒和LipofectamineTM2000 均为美国 Invitrogen公司产品,质粒小量提取试剂盒购自博大泰克公司,SYBR Premix Ex Taq试剂购自TakaRa公司,PCR 扩增引物的合成与 DNA 测序均由上海生工公司完成。
1.2细胞培养与转染 SiHa细胞培养于含10%胎牛血清(FBS)的DMEM培养基内,每3 d换液1次,0.25%胰酶消化传代,倒置显微镜下观察。在转染前1 d用12孔板接种细胞,5×105个/孔,培养过夜,待转染带有GFP标签的miR-886-5p inhibitor/NC质粒,每组3个复孔。细胞长满60%培养孔底时,用不含血清的DMEM各500 μl分别稀释2 μg待转染质粒和5 μl LiPofectamine2000转染试剂,室温放置5 min后,将两者混合作用20 min形成DNA-脂质体复合物。分别将1 ml带有miR-886-5p inhibitor/NC质粒的DNA-脂质体复合物加入各培养孔,轻轻摇匀,37℃、5% CO2、饱和湿度下培养过夜。
1.3转染细胞的筛选 细胞转染24 h后,加入5 μg/ml Blasticidin进行筛选,每5 d换液1次,直到长出细胞克隆,在显微镜下用胰酶消化,挑出克隆,移至10 cm细胞培养皿继续用Blasticidin筛选液培养。3~4 w后,荧光倒置显微镜下观察表达GFP的阳性克隆,再次用胰酶消化,挑出阳性克隆并用1 μg/ml Blasticidin筛选液大量培养。
1.4RNA提取及茎环结构的逆转录 分别收集培养的转染不同质粒SiHa细胞(约5×106个),按产品说明书,加入1 ml TRIzol试剂,吹匀后室温放置5 min,加入氯仿 0.2 ml,剧烈摇晃15 s,室温放置3 min,异丙醇沉淀10 min,12 000 r/min 4℃离心10 min,弃上清,加入1 ml 75%乙醇振荡洗涤后7 500 r/min 4℃离心5 min,吸弃上清,室温干燥10 min,加入50 μl焦碳酸二乙酯(DEPC)水溶解,55℃放置10 min,紫外分光光度计定量。用1%琼脂糖凝胶电泳监测RNA质量。茎环逆转录miR-886-5p的引物为5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACC-CGCTT-3′;以hs-U6作为内参,引物序列为5′-GGAACGCTTCACGAATTTG-3′。
1.5实时定量PCR 取总RNA(1~2 μg),用SYBR Premix Ex Taq Mix 10 μl,上下游引物各1 μl,蒸馏水补足20 μl体积。以hs-U6作为内参,进行实时定量PCR反应检测miRNA的表达,反应包括40个循环(95℃,30 s;60℃,1 min),每次设立3个复孔。特异性miR-886-5p的上下游引物分别为5′-CGGGTCGGAGTTAGCTCA-3′和5′-GTGCAGGGTCCGAGGT-3′;U6 snRNA的上下游引物分别为5′-ATTGGAACGATACAGAGAAGATT-3′和 5′-GGAACGCTTCACGAATTTG-3′。其扩增曲线和融解曲线说明引物具有很好的特异性,将扩增产物进行DNA测序分析进一步证实扩增特异性。采用ΔΔCt法分析基因的表达水平〔15〕,即RQ=2-ΔΔCt,〔ΔΔCt=(CtmiRNA-CtU6)样品(CtmiRNA-CtU6)校正样品〕。每次实验包括以水为模板的阴性对照,根据(2-ΔΔCT)计算每对样本的相对表达量。
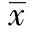

(A)SiHa细胞系稳转GFP标记的miR-886-5p表达抑制及对照质粒筛选4 w后荧光镜图片;(B) SiHa细胞系稳转miR-886-5p表达抑制及对照质粒后miR-886-5p表达量的qRT-PCR验证,U6snRNA为内参,1)P <0.05
2 结 果
用带有GFP标签的miR-886-5p inhibitor及对照质粒转染SiHa细胞,Blasticidin筛选3~4 w后于荧光倒置显微镜下观察表达GFP的阳性克隆(图1)。挑取阳性克隆大量培养后用qRT-PCR验证稳转细胞中miR-886-5p的表达差异,每组3个复孔,实验重复3次,差异显著(P<0.05)。见图1。
3 讨 论
众所周知,高危型HPV感染是宫颈癌发病的主要原因,其分子机制也成为人们研究的焦点。然而HPV感染并不能为宫颈癌的恶变过程提供足够的证据,目前其他因素对宫颈癌的影响也受到了关注〔14〕。
研究报道显示不同miRNAs的异常表达在不同的癌症中起着不同的作用〔16~18〕。miRNAs表达分析显示miR-143和miR-145在宫颈癌组织及宫颈癌相关细胞系中表达下调,它们起着抑制宫颈癌相关细胞的生长作用;而miR-146a在宫颈癌组织及宫颈癌相关细胞系中表达上调,能促进宫颈癌相关细胞的增殖〔12〕。
目前关于miRNAs与宫颈癌细胞的凋亡之间的关系研究很少,有研究发现miR-886-5p在宫颈癌的含量明显高于癌周及癌旁组织。
4 参考文献
1Bosch FX,de Sanjose S.Chapter 1:Human papillomavirus and cervical cancer-burden and assessment of causality〔J〕.J Natl Cancer Inst Monogr,2003;31(1):3-13.
2Thomison J 3rd,Thomas LK,Shroyer KR.Human papillomavirus:molecular and cytologic/histologic aspects related to cervical intraepithelial neoplasia and carcinoma〔J〕.Hum Pathol, 2008;39(12):154-66.
3Chen CY,Liu TZ,Tseng WC,etal.Anonaine induces apoptosis through Bax-and caspase-dependent pathways in human cervical cancer(HeLa) cells〔J〕.Food Chem Toxicol, 2008;46(8):2694-702.
4Martin CM,Astbury K,O'Leary JJ.Molecular profling of cervical neoplasia〔J〕.Expert Rev Mol Diagn, 2006;6(2):217-29.
5Liu N,Okamura K,Tyler DM,etal.The evolution and functional diversification of animal microRNA genes〔J〕.Cell Res, 2008;18(10):985-96.
6Lu J,Getz G,Miska EA,etal.MicroRNAs expression profiles classify human cancers〔J〕.Nature, 2005;435(204):834-8.
7Esquela-Kerscher A,Slack FJ.Oncomirs-microRNAs with a role in cancer〔J〕.Nat Rev Cancer, 2006;6(4):259-69.
8Croce CM.Causes and consequences of microRNA dysregulation in cancer〔J〕.Nat Rev Genet,2009;10(10):704-14.
9Yanaihara N,Caplen N,Bowman E,etal.Unique microRNA molecular profiles in lung cancer diagnosis and prognosis〔J〕.Cancer Cell, 2006;9(3):189-98.
10Calin GA,Ferracin M,Cimmino A,etal.A microRNA signature associated with prognosis and progression in chronic lymphocytic leukemia〔J〕.N Engl J Med,2005;353(17):1793-801.
11Yao Q,Xu H,Zhang QQ,etal.MicroRNA-21 promotes cell proliferation and down-regulates the expression of programmed cell death 4(PDCD4) in HeLa cervical carcinoma cells〔J〕.Biochem Biophys Res Commun, 2009;388(3):539-42.
12Wang X,Tang S,Le SY,etal.Aberrant expression of oncogenic and tumor-suppressive microRNAs in cervical cancer is required for cancer cell growth〔J〕.PLoS ONE 2008;3(7):e2557.
13Lee JW,Choi CH,Choi JJ,etal.Altered microRNA expression in cervical carcinomas〔J〕.Clin Cancer Res, 2008;14(9):2535-42.
14Li JH,Xiao Xue,Zhang YN,etal.MicroRNA miR-886-5p inhibits apoptosis by down regulating Bax expression in human cervical carcinoma cells〔J〕.Gynecologic Oncology,2011;120(1):145-51.
15Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method〔J〕.Methods, 2001;25(4):402-8.
16Volinia S,Calin GA,Liu CG,etal.A microRNA expression signature of human solid tumors defines cancer gene targets〔J〕.Proc Natl Acad Sci USA, 2006;103(7):2257-61.
17Cummins JM,He Y,Leary RJ,etal.The colorectal microRNAome〔J〕.Proc Natl Acad Sci USA,2006;103(10):3687-92.
18马 博,郑建忠.microRNA-146a基因多态性与胃癌的相关性分析〔J〕.中国老年学杂志,2012;32(15):3150-2.
