年龄和性别对羟甲基戊二酸-辅酶A还原酶基因型多态性同血清脂类关系的影响
2014-09-12张玉国
张玉国 李 锐
(青海省中医院医疗服务监管科,青海 西宁 810000)
冠心病(CHD)也是一种重要的遗传性疾病,因此鉴定参与CHD病理过程的相关基因是目前研究的热点问题之一〔1〕。目前已经证实降低血清总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)已成为防治心血管疾病有效手段之一〔2〕。细胞内胆固醇动态平衡的维持主要依赖两种调节机制:细胞外LDL受体摄取外源性胆固醇和内源性胆固醇合成,后者由羟甲基戊二酸-辅酶A还原酶(HMGCR)催化完成〔3〕。HMGCR是胆固醇合成的限速酶,受甲羟戊酸代谢产生的甾醇和非甾醇调控。在正常哺乳动物细胞中,该酶主要受到LDL受体活化过程中分解成的胆固醇的抑制,可引起血浆LDL浓度上升。他汀类药物是HMGCR的竞争性抑制剂,能够通过胆固醇调节元件结合蛋白(SREBP)调控血浆胆固醇的水平,从而降低心血管病的发病率和死亡率。但是,不同个体对他汀药物的反应不一,关于HMGCR基因多态性的研究已有一些报道〔4,5〕。本研究旨在探讨HMGCR-911多态性的对不同年龄和性别的CHD病人及健康人群对照血清胆固醇水平的影响。
1 对象和方法
1.1病例选择 365例在我院心内科就医的CHD病人,纳入标准为:通过血管造影术对CHD明确诊断,根据WHO的诊断标准:粥样硬化造成至少其中一支冠状动脉狭窄50%。排除标准为,有心肌损伤病史,做过经皮腔内血管成形术及冠状动脉旁路移植术的患者,有严重的肝硬化、肾功能不全,代谢综合征、恶性肿瘤及精神疾病的患者。选择体检健康无心血管病史的365人为对照(未进行冠状动脉造影,因此不能排除部分人有粥样动脉硬化)。进行问卷调查,主要是冠状动脉风险因子,包括吸烟、冠状动脉家族史、高血压、糖尿病、高血脂等。经我院伦理委员会通过,所有步骤都符合赫尔辛基宣言关于“人体医学研究伦理守则”的相关规定,所有参与者在采血前都签署了知情同意书。TC/HDL-C比值作为评估心血管病风险因子比TC更为有效(TC/HDL-C男性≤4.5,女性≤4.0)。
1.2基因型检测 用EDTA抗凝的采血管采集受试对象的血样,然后用SDS醋酸裂解乙醇沉淀商业试剂盒(Roche Diagnositic,美国)提取白细胞基因组DNA,样品存于4℃,用Tris-EDTA溶解。采用聚合酶链式反应(PCR)以及限制片段长度多态性(RFLP)分析-911C>A多态性。引物为5′-TTGAGTGAAATACAGATCCTGTCC-3′/5′-CCATAGACCTGCATCAGCGT-3′。PCR反应体系:PCR缓冲液10 mmol/L,dNTP 0.2 mmol/L,MgCl21.5 mmol/L,引物(0.8 pmol/μl)和1 U Taq酶。循环参数:96℃,5 min;96℃,45 s;56℃,45 s;72℃终止;30个循环。随后,用BsuRI消化(MBI Fermentas,意大利; 10 U/样品)。2%琼脂糖凝胶电泳,溴乙啶染色,紫外光下对凝胶图像拍照记录。根据以下片段分析基因型:长片段261和139 bp(AA基因型);261,70,69 bp(CC基因型),261,139,70,69 bp(AC基因型),采用实时PCR检测20个代表性样本的HMGCR-911多态性。
1.3统计学分析 采用SPSS13.0软件进行t或Mann-WhitneyU、χ2检验。采用基因计数法计算等位基因频率,χ2检验分析Hardy-Weinberg平衡分离度。应用二元逻辑回归(LR)进行多因素分析,通过优势比(OR)和置信区间(CI)计算相对危险度。
2 结 果
2.1患者一般情况 对照组和CHD组年龄、性别无显著差异(P>0.05)。CHD组高血压31例(85.4%),无糖尿病患者,两组家族史无显著差异(P>0.05)。与对照组比较,CHD组患动脉粥样硬化的风险相关因子显著升高,包括体重指数(BMI)、收缩压(SBP)、舒张压(DBP)、TC,极低密度脂蛋白胆固醇(VLDL-C)、吸烟比例均高、高密度脂蛋白胆固醇(HDL-C)水平低(P均<0.001)。女性CHD组平均年龄大于男性CHD组(P<0.001),SBP水平升高(P<0.01),吸烟比例较少(P<0.001)。女性对照组年龄也明显大于男性组(P<0.001),BMI(P<0.001),SBP(P<0.01),DBP(P<0.05)明显高于男性组(表1)。
2.2HMGCR-911C>A基因型和等位基因分布 两组HMGCR-911C>A多态性有显著差异(P<0.05)。对照组CA频率明显高于CHD组(OR:0.650,95%CI:0.435~0.970,P=0.034)。对照组HMGCR-911符合Hardy-Weinberg平衡(HWE);而CHD组HWE发生偏移。见表2。
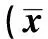
表1 各组基本信息、生化指标和临床特征±s)

表2 HMGCR基因型以及等位基因在人群中的分布〔n(%)〕
女性CHD组HMGCR-911同源CC基因型频率显著高于女性对照组,而A等位基因频率低于女性对照组(OR:3.169,95%CI:1.468~6.842,χ2=9.226,P=0.002,统计效能=92.4%)。女性对照组中CA基因频率显著高于女性CHD组(OR:0.283,95%CI:0.122~0.652,P=0.002)。男性HMGCR-911多态性基因频率无显著差异(P>0.05)。男性CHD组A等位基因(CA+AA基因型)频率是女性的2.3倍(OR:2.322,95%CI:1.132~4.764,χ2=5.511,P=0.019),而对照组中男性和女性无差异。见表3。
2.3HMGCR -911C>A多态性同脂质及代谢参数的关系 男性CHD组CC基因型患者血清TC和LDL-C水平高于CA+AA基因型(P=0.003,统计效能=95%;P=0.018,统计效能=83%)。男性HMGCR-911CC基因型CHD组同HMGCR-911CA+AA基因型相比,TC/HDL-C比值高(5.33±1.58 vs.4.63±1.50,P=0.004),而女性CHD组HMGCR-911基因型该比值无差异(4.95±1.60 vs.4.97±1.77,P=0.976)。对照组男性和女性HMGCR-911基因型无差别(男性CC:4.10±1.53 vs. CA+AA: 4.47±1.74,P=0.171;女性CC:4.19±2.05 vs. CA + AA: 3.58±1.28,P=0.140),HMGCR-911C>A多态性对TC无影响。CHD家族史同HMGCR-911多态性无关。见表4。
2.4多因素回归分析 多因素逻辑回归分析评估CHD患病组中HMGCR-911多态性与性别、年龄(<55岁,>55岁)、TC(血清胆固醇>5.18 mmol/L,<5.18 mmol/L)的关系。在多因素回归模型中,男性中,因变量HMGCR CC 基因型同年龄<55岁〔OR=3.832;95%CI=1.898~7.734;P=0.000〕和TC≥ 5.18 mmol/L〔OR=3.001;95%CI=1.486~6.06;P=0.002〕显著相关,但在女性中则无相关性(P>0.05)。逻辑回归分析表明,在年龄<55岁的CHD患者HMGCR-911 CC基因型同TC升高显著相关。

表3 不同性别HMGCR -911 C>A多态性〔n(%)〕
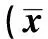
表4 HMGCR -911 C>A多态性对两组不同性别脂类代谢的作用±s)
3 讨 论
HMGCR是一种由888个氨基酸组成的膜糖蛋白,是体内胆固醇合成的限速酶,其抑制剂(如他汀类药物)能降低其活性,诱导LDL受体基因表达,有效地使血浆胆固醇水平下降。研究〔6〕发现在HMGCR基因存在的多个多态性位点中,HMGCR rs3846662单核苷酸多态性(SNP)对血清LDL-C水平影响较大,而且也会影响到血清脂类物质水平对普伐他汀的反应。Freitas等〔7〕进行了大范围的调查研究(包括597例亚裔美国人,627例华裔美国人,612例欧裔美国人,608例西班牙裔美国人),分析不同种族在使用了他汀类药物后对脂质和脂蛋白吸收的反应,结果发现:HMGCR基因多态性对甘油三酸酯、LDL、HDL-C有明显影响。研究还发现〔8〕,HMGCR-911启动子区多态性也是发生急性心肌梗死(AMI)的一种危险因素,Jawaid等〔9〕报道了HMGCR-911 CC基因型同AMI及复发有关,同时观察到老年人BMI值高及TC含量高同HMGCR CC基因型有关。
本调查发现CC基因型等位基因的分布和意大利人(11.0%)〔10〕和瑞士人群(10.23%)〔11〕基本一致。本研究表明HMGCR-911 CC基因型与男性CHD患病风险增加有关,受年龄和性别的影响。雌激素对胆固醇代谢有明显影响,男性中雌激素受体少于女性,因此HMGCR -911多态性对细胞蛋白固醇的水平可能有不同影响。女性雌激素随着年龄的增长而降低,由于55岁以上的女性雌激素受水平基本不变,因此HMGCR-911多态性可能还会受到年龄的影响。目前多数学者认为HMGCR基因启动子区受雌激素调控,已鉴定到多个HMGCR转录因子结合位点〔12〕。其中之一是位于293区(Red-ERE)雌激素反应性原件相似序列。Medina等〔13〕推测该组织HMGCR受雌激素特异性调控,可能会对心脏病的发生有预防作用。因为男性患者中没有雌激素,因此对于胆固醇受HMGCR基因-911启动子区多态性的影响很小。而女性患者CC基因型则可保护机体免受高胆固醇的损伤,因而可减少CHD的发生。
HMGCR酶是他汀类药物的作用靶点,因此不同HMGCR-911 C>A多态性对他汀类药物个体化用药有一定的指导作用〔14〕。本研究表明HMGCR-911多态性对不同性别和年龄患者的血清TC水平及发生CHD风险有不同影响,但该基因多态性同血清中雌激素水平、脂质谱、HMGCR和SNP功能的关系〔15〕还需长期研究。
4 参考文献
1Burg JS, Espenshade PJ.Regulation of HMG-CoA reductase in mammals and yeast〔J〕. Prog Lipid Res,2011;50 (4):403-10.
2Akadam Teker B, Kurnaz O, Coskunpinar E,etal.The effects of age and gender on the relationship between HMGCR promoter-911 SNP (rs33761740) and serum lipids in patients with coronary heart disease〔J〕.Gene,2013;528(2):93-8.
3Chung JY. Effect of HMGCR variant alleles on low-density lipoprotein cholesterol-lowering response to atorvastatin in healthy Korean subjects〔J〕. J Clin Pharmacol,2012;52(3):339-46.
4Chen X, Wang X, Li Z,etal.Molecular cloning, tissue expression and protein structure prediction of the porcine 3-hydroxy-3-methylglutaryl-Coenzyme A reductase (HMGR) gene〔J〕.Gene,2012;495(2):170-7.
5Dendramis G.Interindividual differences in the response to statin therapy and gene polymorphisms related to myopathy during statin therapy〔J〕.G Ital Cardiol (Rome),2011;12(3):182-5.
6Poduri A, Khullar M, Bahl A,etal.Common variants of HMGCR, CETP, APOAI, ABCB1, CYP3A4, and CYP7A1 genes as predictors of lipid-lowering response to atorvastatin therapy〔J〕.DNA Cell Biol,2010;29(10):629-37.
7Freitas R. HMGCR gene polymorphism is associated with stroke risk in the EPIC-Norfolk study〔J〕. Eur J Cardiovasc Prev Rehabil,2010;17(1):89-93.
8Hibbitt O.RNAi-mediated knockdown of HMG CoA reductase enhances gene expression from physiologically regulated low-density lipoprotein receptor therapeutic vectors in vivo〔J〕.Gene Ther,2012;19(4):463-7.
9Jawaid S, Gertz M, Corsino C,etal. Human hydroxymethylglutaryl-coenzyme A reductase (HMGCR) and statin sensitivity〔J〕. Indian J Biochem Biophys,2010;47(6):331-9.
10Keller L.A functional polymorphism in the HMGCR promoter affects transcriptional activity but not the risk for Alzheimer disease in Swedish populations〔J〕. Brain Res,2010;1344:185-91.
11Lipkin SM . Genetic variation in 3-hydroxy-3-methylglutaryl CoA reductase modifies the chemopreventive activity of statins for colorectal cancer〔J〕. Cancer Prev Res(Phila),2010;3(5):597-603.
12Mangravite LM. Combined influence of LDLR and HMGCR sequence variation on lipid-lowering response to simvastatin〔J〕.Arterioscler Thromb Vasc Biol,2010;30(7):1485-92.
13Medina MW, Sangkuhl K, Klein TE,etal.PharmGKB: very important pharmacogene-HMGCR〔J〕.Pharmacogenet Genomics, 2011;21(2):98-101.
14Persson L, Henriksson P, Westerlund E,etal.Endogenous estrogens lower plasma PCSK9 and LDL cholesterol but not Lp(a) or bile acid synthesis in women〔J〕. Arterioscler Thromb Vasc Biol,2012;32(3):810-4.
15Freitas RN, Khaw KT, Wu K,etal.A single nucleotide polymorphism in the 3-hydroxy-3-methylglutaryl-coenzyme A reductase gene( HMGCR) influences the serum triacylglycerol relationship with dietary fat and fibre in the European Prospective Investigation into Cancer and Nutrition in Norfolk (EPIC-Norfolk) study〔J〕.Br J Nutr,2010;104(5):765-72.
