不同产地大血藤药材指纹图谱研究及红景天苷和绿原酸的含量测定
2014-09-11李宛蓉桂双英王举涛陶曜天施伶俐
李宛蓉 ,桂双英,2,3 ,王举涛 ,陶曜天 ,施伶俐
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽省中药制剂工程技术研究中心,安徽 合肥 230012;3.安徽省“115”新安医药研究与开发创新团队,安徽 合肥 230012)
不同产地大血藤药材指纹图谱研究及红景天苷和绿原酸的含量测定
李宛蓉1,桂双英1,2,3,王举涛1,陶曜天1,施伶俐1
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽省中药制剂工程技术研究中心,安徽 合肥 230012;3.安徽省“115”新安医药研究与开发创新团队,安徽 合肥 230012)
目的建立不同产地大血藤药材的高效液相色谱指纹图谱,同时测定红景天苷和绿原酸2种成分的含量。方法采用高效液相色谱法,色谱柱为Phenomenex-C18(250 mm×4.6 mm,5 μm);以乙腈-0.05%磷酸水溶液为流动相进行梯度洗脱;检测波长:280 nm;流速:1.0 mL/min;进样量:15 μL;柱温:30 ℃。结果10个产地的大血藤药材指纹图谱相似度达0.9以上,共标定14个共有峰,可确认红景天苷和绿原酸两个峰。红景天苷和绿原酸含量在不同产地大血藤中差异很大,以安徽产大血藤药材中含量为最高。结论所建立的高效液相色谱指纹图谱测定方法准确可靠,重现性好,可作为大血藤药材的鉴别和内在质量评价的依据。
大血藤;指纹图谱;红景天苷;绿原酸;高效液相色谱法
大血藤又名红藤、血藤,为木通科植物大血藤Sargentodoxacuneata(Oliv.) Rehd. Et Wils的干燥藤茎,归大肠、肝经,具有清热解毒、活血、袪风止痛之功效[1]。大血藤作为一种传统中药,为第三纪古热带植物区系的孑遗植物,目前主要分布在江西、湖北、四川、云南、安徽等地。大血藤中主要含有蒽醌类、黄酮类、酚类、挥发油类化合物等[2-4]。现代药理研究表明,大血藤具有抗炎、抗癌、止痛、抗辐射、抗菌及心血管系统活性等作用[5-7]。临床多以其复方用于治疗慢性盆腔炎、肠痈腹痛、风湿痹痛、跌打扑痛、阑尾炎等[8]。目前,《中华人民共和国药典》尚无大血藤成分含量测定的记载。因此,对大血藤药材进行鉴别与测定,进一步完善大血藤药材质量控制方法尤为重要。中药指纹图谱能比较全面地反映中药所含化学成分,本研究采用高效液相色谱法,以红景天苷、绿原酸为指标性成分,对不同产地大血藤药材进行指纹图谱研究,并对其成分进行含量测定,以期为大血藤药材质量评价及其进一步开发利用提供参考依据。
1 仪器与试药
1.1 仪器与试剂 Agilent 1260高效液相色谱仪:包括在线真空脱气机、四元梯度泵、自动进样器、柱温箱、DAD检测器;万分之一分析天平:梅特勒-托利多仪器上海有限公司;KQ2200型超声波清洗器:江苏省昆山市仪器有限公司。乙腈、甲醇均为色谱纯;水为超纯水,使用前经0.45 μm滤膜滤过;其他试剂均为分析纯。
1.2 对照品与样品 红景天苷:成都曼斯特生物科技有限公司,批号 MUST-12102401;绿原酸:中国食品药品检定研究院,批号110753-200413;不同产地大血藤药材样品来源见表1。
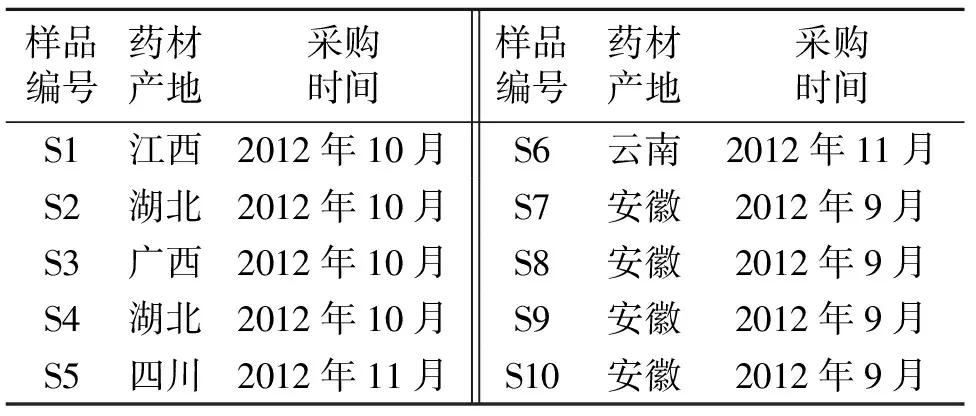
表1 大血藤药材来源
2 方法与结果
2.1 色谱条件 Phenomenex-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙睛-0.05%磷酸水,梯度洗脱条件见表2;流速:1.0 mL/min;检测波长:280 nm;进样量:15 μL;柱温:30 ℃。
2.2 对照品溶液的制备 分别精确称取红景天苷对照品、绿原酸对照品适量,加甲醇配成含红景天苷和绿原酸分别为0.160、0.189 mg/mL的混合对照品溶液,备用。
2.3 供试品溶液的制备 称取样品粉末(过60目筛)0.5 g,精密称定,置50 mL具塞三角烧瓶中,精密加入25 mL甲醇,超声30 min,冷却过滤,补质量,取续滤液20 mL至50 mL容量瓶中,定容,制得供试品溶液。
2.4 指纹图谱研究
2.4.1 精密度试验:取S1号大血藤样品,精密称定,按照“2.2”项下方法操作,连续进样6次,测得共有峰面积的RSD为2.01%,说明仪器精密度良好。
2.4.2 稳定性试验:取S1号大血藤样品,精密称定,按照“2.2”项下样品制备方法操作,分别在0、3、6、9、12 h进样,测得各共有峰相对峰面积的RSD为2.47%,表明样品在12 h内稳定。
2.4.3 重复性试验:精密称取S1号大血藤样品6份,按照“2.2”项下样品制备方法操作,分别测得各共有峰面积的RSD为2.19%,表明该方法重复性良好。
2.4.4 大血藤共有指纹峰的建立:获得10批不同产地大血藤样品的高效液相色谱图,采用国家药典委员会开发的《中药色谱指纹图谱相似度评价系统》2004A版相似度软件进行处理,得到10批大血藤样品的高效液相色谱指纹图谱的叠加图(见图1)。以S1为参照图谱,经过多点校正,自动匹配,以平均数法,生成对照图谱R,由匹配数据的输出结果得到共有峰14个。经过与对照品的紫外图谱及保留时间的比较,确认6号峰为红景天苷,7号峰为绿原酸。由于6号峰峰面积适中,且分离度与峰形较好,因此选作参照色谱峰。设其保留时间和峰面积分别为1,其他各共有峰的保留时间和峰面积分别与参照峰的保留时间和峰面积相比,计算各样品指纹图谱中共有峰的相对保留时间和相对峰面积,结果分别见表3、表4,并且建立大血藤的高效液相色谱指纹图谱共有模式,结果见图2。
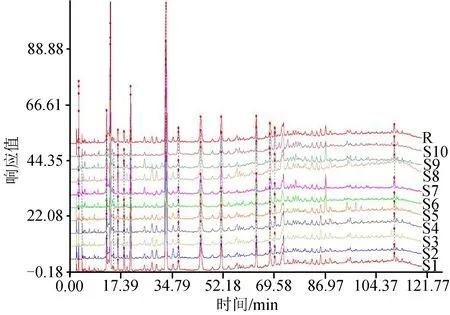
图1 10批不同产地大血藤药材的高效液相色谱叠加图

图2不同产地大血藤的高效液相色谱指纹图谱共有模式
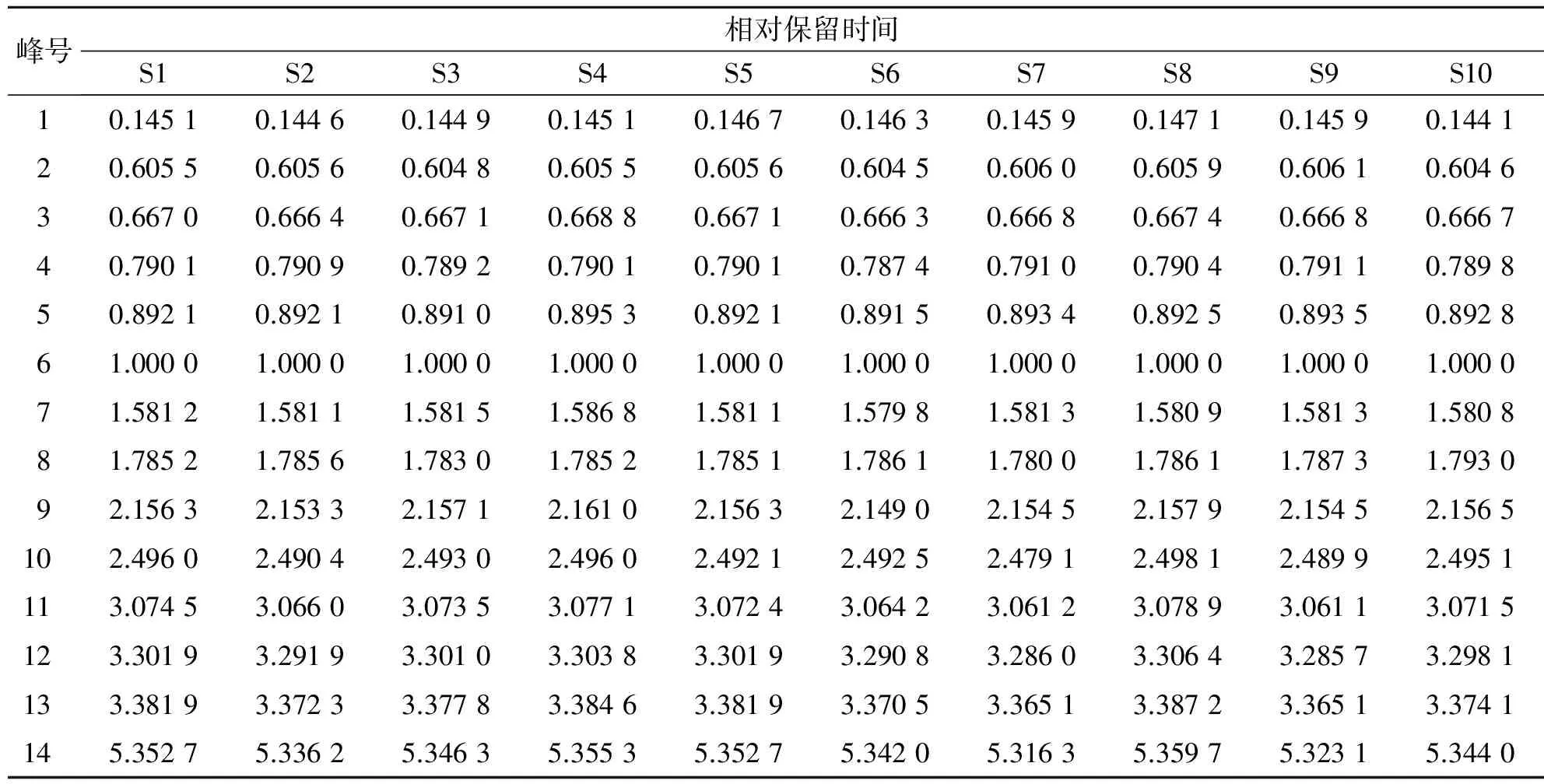
表3 不同产地大血藤药材指纹图谱各共有峰的相对保留时间
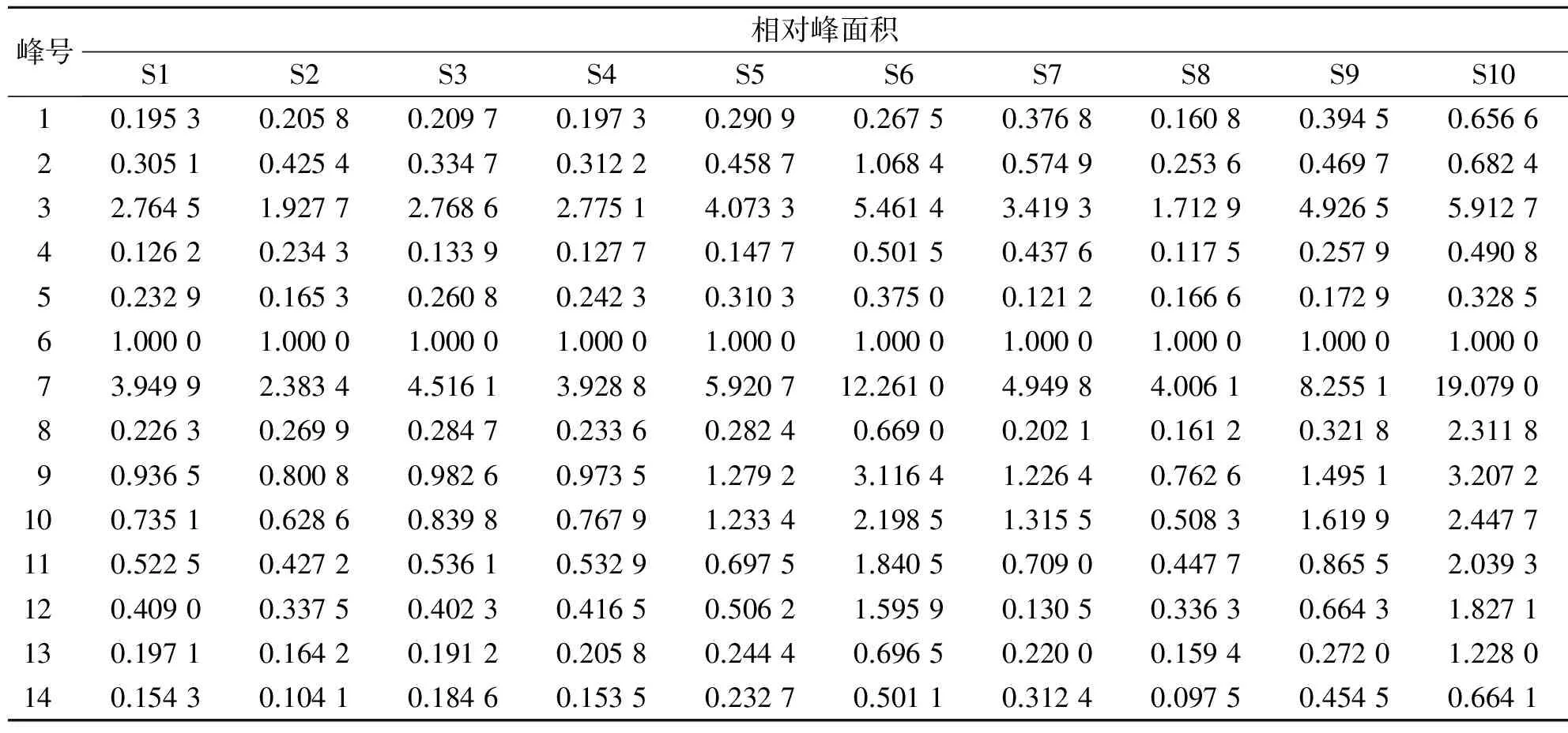
表4 不同产地大血藤药材指纹图谱各共有峰的相对峰面积
2.4.5 不同产地大血藤药材的相似度比较:将10批不同产地大血藤样品的色谱数据导入《中药色谱指纹图谱相似度评价系统》2004A版相似度软件,考察色谱峰相似度的一致性,进行相似度的评价。结果10批不同产地大血藤样品图谱相对于对照指纹图谱的相似度分别为0.989、0.959、0.994、0.991、0.987、0.990、0.987、0.986、0.996、0.969。
2.4.6 指纹图谱相似度评价:对10批样品的指纹图谱分析结果表明,产地不同的大血藤高效液相色谱指纹图谱各共有峰相似度很高,相似度范围为0.959~0.996。表4表明,10批样品的色谱图中,峰面积最大的色谱峰均为7号峰绿原酸,其次为3号峰。而S10、S6、S9的绿原酸相对峰面积分别达到19.079、12.261、8.255,是其他各批次绿原酸均值(4.236 4)的4.5倍,2.89倍和1.95倍。同时S6、S9、S10三批样品的各峰相对峰面积明显高于其他批次。结果表明,10批不同产地大血藤的化学成分相似,但各化学成分含量有一定的差异。
2.5 含量测定
2.5.1 系统适用性试验:按“2.1”项下色谱条件进行检测,以红景天苷峰计算理论塔板数大于3 000,分离度大于1.5。对照品溶液及供试品溶液的色谱图见图3。

图3对照品溶液(A)与供试品溶液(B)的高效液相色谱图(1.红景天苷;2.绿原酸)
2.5.2 线性关系考察:分别精密吸取上述混合对照品溶液1、2、5、8、12、15 μL注入液相色谱仪,记录峰面积,以峰面积为纵坐标,进样量为横坐标进行线性回归,得到红景天苷回归方程y=612.51x+35.61,r=0.999 2,绿原酸回归方程y=1 556.2x,r=0.999 1。红景天苷、绿原酸进样量分别在0.160~2.400、0.189~2.835 μg时与峰面积的线性关系良好。
2.5.3 精密度试验:精密吸取S1大血藤供试品溶液15 μL,重复进样6次,记录峰面积,结果表明,红景天苷和绿原酸峰面积的RSD分别为1.9%、2.2%。
2.5.4 重复性试验:精密称取S1号大血藤样品6份,按照“2.2”项下样品制备方法制样,各取15 μL进样,结果红景天苷与绿原酸含量的RSD分别为1.8%、1.9%。
2.5.5 稳定性试验:取S1号大血藤样品,精密称定,按照“2.2”项下方法操作,分别在0、3、6、9、12 h进样,测得红景天苷与绿原酸峰面积RSD分别为2.5%和2.1%,表明样品在12 h内稳定性良好。
2.5.6 回收率试验:精密称取已知含量的S1大血藤样品6份,分别精密加入一定量的红景天苷与绿原酸对照品溶液,按“2.2”项下方法制备样品溶液。依法测定,结果红景天苷与绿原酸的平均回收率分别为98.4%、98.1%,RSD分别为2.3%、2.6%。
2.5.7 含量测定:分别精密吸取各批药材的供试品溶液15 μL,按“2.1”项下色谱条件进行测定,计算红景天苷与绿原酸的含量,见表5。
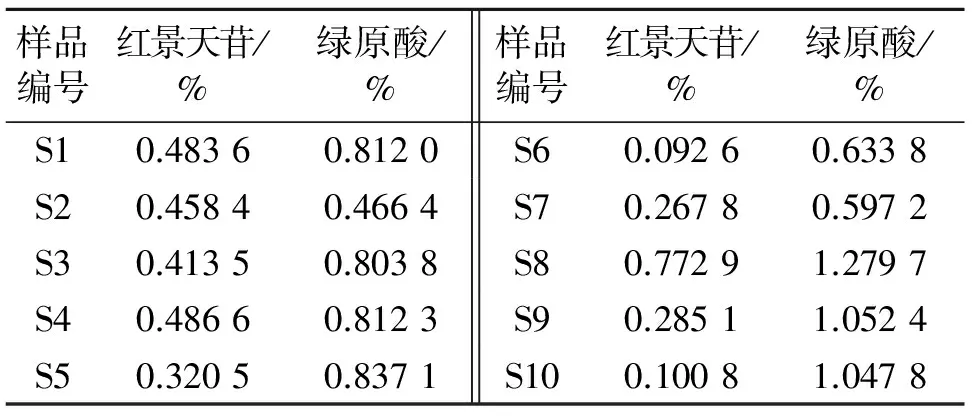
表5 不同产地大血藤药材中红景天苷和绿原酸含量
3 讨论
3.1 超声时间的考察 对S6大血藤样品不同超声时间的高效液相色谱图谱进行考察,发现超声15 min样品成分溶出不完全;而超声45 min样品中较多低含量成分溶出,影响高效液相色谱图谱各峰分离度;30 min样品成分溶出较完全且分离度较好。因此,本实验样品溶解的超声时间确定为30 min。
3.2 流动相的考察 流动相条件优化时试验了4种流动相系统:甲醇-水﹑乙腈-水﹑乙腈-0.05%磷酸水和乙腈-0.01%磷酸水,并尝试这4种流动相系统的多种梯度洗脱程序。结果显示,以甲醇-水线性梯度洗脱时,基线不稳,且各色谱峰分离效果不好;采用乙腈-水、乙腈-0.01%磷酸水线性梯度洗脱时,色谱峰分离效果不理想;而采用乙腈-0.05%磷酸水线性梯度洗脱时,各色谱峰分离度和峰形都较好,且分离峰数多,分离效果好。
3.3 检测波长的考察 本研究采用二极管阵列检测器对190~400 nm扫描的各波长下的色谱图进行分析比较,结果显示280 nm波长下的色谱图色谱峰形和分离度较好,色谱信息较丰富,因此选择280 nm为检测波长。
3.4 流速的考察 本研究分别比较流速在0.8、1.0、1.2 mL/min的色谱图,结果流速为0.8、1.0 mL/min时图谱分离度较好,但0.8 mL/min图谱分析时间较长,1.2 mL/min图谱分离度不佳。结果表明,流速在1.0 mL/min时分离效果较好。
4 结语
本实验建立大血藤药材的高效液相色谱指纹图谱,并对红景天苷和绿原酸进行含量测定。结果表明,产地不同的大血藤高效液相色谱指纹图谱各共有峰相似度很高,但各成分含量差别很大,以S8安徽产大血藤药材的红景天苷与绿原酸含量最高。该方法具有很好的稳定性、重复性和可行性,为大血藤药材的质量评价及质量控制提供了科学依据,对保证大血藤药材及其制剂的临床疗效具有重要意义。
本课题组前期研究[9-10]建立了大血藤中红景天苷的含量测定方法,并采用正交试验优选了大血藤的最佳提取工艺,后期研究表明大血藤水提部位和正丁醇萃取部位对盆腔炎有一定的治疗作用。据文献[11-12]报道,大血藤中大黄素、β-谷甾醇和绿原酸等均具有较强的抗菌活性。绿原酸是一种重要的生物活性物质,具有抗菌、抗病毒、升高白细胞、保肝利胆和兴奋中枢神经系统等作用[13]。本研究标定了大血藤指纹图谱中6号峰为红景天苷,7号峰为绿原酸,并对其进行含量测定,14个共有峰中绿原酸含量最高。因此,绿原酸极有可能是大血藤主要抗炎活性物质之一。深入明确大血藤抗炎活性化合物或化合物群,指认图谱中各指纹峰的归属并对其进行含量测定,有针对性地对指纹图谱的研究方法进行优化,是今后有待解决的问题。
[1]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:19.
[2]田瑛,张慧娟,屠爱萍,等.中药大血藤的酚性化合物[J].药学学报,2005,40(7):628-631.
[3]高玉琼,赵德刚,刘建华,等.大血藤挥发性成分研究[J].中成药,2004,26(10):843-845.
[4]葛明菊,金则新,李钧敏,等.大血藤黄酮类化合物组成的初步研究[J].浙江林学院学报,2002,19(4):382-386.
[5]李钧敏,金则新,陈彤,等.红藤饮片提取物抑菌活性与次生代谢产物含量的相关性[J].浙江大学学报:医学版,2006,35(3):273-280.
[6]王宇歆,李惠芬,周静,等.大血藤有效部位含量测定及对腹腔感染细菌的抑制活性的研究[J].中成药,2008,30(8):1230-1232.
[7]冯改利,宋小妹,邓翀,等.DPPH法筛选大血藤抗氧化活性有效部位[J].陕西中医,2011,32(9): 1233-1235.
[8]倪士峰,傅承新,吴平.大血藤化学成分及药学研究进展[J].中国野生植物资源,2004,23(4): 8-10.
[9]施伶俐,桂双英,周金凤.HPLC法测定大血藤中红景天苷的含量[J].安徽医药,2011,15(4):441-442.
[10]陶曜天,施伶俐,储晓琴,等.正交试验法优选大血藤提取工艺[J].安徽中医学院学报,2012,31(1):71-73.
[11]毛水春,崔承彬,顾谦群.中药大血藤化学成分和药理活性的研究进展[J].天然产物研究与开发,2003,15(6):559-562.
[12]马瑞丽,于小凤,徐秀泉,等.大血藤的化学成分及药理作用研究进展[J].中国野生植物资源,2012,31(6):1-5.
[13]赵金娟,戴雪梅,曲永胜,等.绿原酸药效学研究进展[J].中国野生植物资源,2013,32(4):1-5.
StudyonFingerprintofSargentodoxacuneatafromDifferentHabitatsandDeterminationofSalidrosideandChlorogenicAcidasTwoComponents
LIWan-rong1,GUIShuang-ying1,2,3,WANGJu-tao1,TAOYao-tian1,SHILing-li1
(1.SchoolofPharmacy,AnhuiUniversityofChineseMedicine,AnhuiHefei230012,China; 2.AnhuiEngineeringResearchCenterforChineseMedicinePreparation,AnhuiHefei230012,China; 3.Anhui"115"Xin’anTraditionalChineseMedicineResearch&DevelopmentInnovationTeam,AnhuiHefei230012,China)
ObjectiveTo establish the high-performance liquid chromatography (HPLC) fingerprint ofSargentodoxacuneatafrom different habitats and to determine the content of salidroside and chlorogenic acid as two components inSargentodoxacuneata.MethodsHPLC was performed on a Phenomenex-C18column (250 mm × 4.6 mm, 5 μm) with a mobile phase of acetonitrile-0.05% phosphoric acid for gradient elution at a detection wavelength of 280 nm, a flow rate of 1.0 mL/min, a sample size of 15 μL, and a column temperature of 30 ℃.ResultsSargentodoxacuneatafrom 10 habitats had a fingerprint similarity above 0.9; there were 14 common peaks, and the peaks of salidroside and chlorogenic acid were identified. The content of salidroside and chlorogenic acid varied significantly betweenSargentodoxacuneatafrom different habitats, highest inSargentodoxacuneatafrom Anhui Province.ConclusionThe established HPLC fingerprint is accurate, reliable, and reproducible and can be used as a basis for the identification and inherent quality evaluation ofSargentodoxacuneata.
Sargentodoxacuneata;fingerprint; salidroside; chlorogenic acid; high-performance liquid chromatography
安徽省科技攻关项目(12010402094);安徽省高等学校省级自然科学研究项目(KJ2013Z181);康缘中医药科技创新基金项目(KYCX201004)
李宛容(1990-),女,硕士研究生
桂双英,guishy0520@126.com
R284.1
A
10.3969/j.issn.2095-7246.2014.06.025
2014-6-20)
