高血压实验动物模型的研究进展
2014-09-11沈智洁张志辉综述杨侃审校
沈智洁、张志辉综述,杨侃审校
高血压实验动物模型的研究进展
沈智洁、张志辉综述,杨侃审校
高血压是常见的心血管系统疾病,其患病率高,控制率低,严重威胁人类健康。为了更好地探究其发病机制及治疗方法,人们构建了多种高血压实验动物模型,主要分为基因相关模型与非基因相关模型,前者包括遗传性和基因工程动物模型,后者包括环境性、手术性、药物性动物模型。本文就各种模型的建模方法、发病机制、应用范围及优缺点作一综述。
高血压;动物模型
高血压是常见的心血管系统疾病,我国高血压患病率为18.8%,影响心、脑、肾等重要脏器的结构与功能,最终可导致这些器官的功能衰竭。为了更好地探究其发病机制及治疗方法,人们构建了各种高血压实验动物模型,尤其近几年高血压治疗领域热点经导管射频消融去肾神经术治疗顽固性高血压的有效性、安全性及作用机制研究更需要利用高血压动物模型。本文就目前国内外高血压实验动物模型的最新进展作一综述。
高血压动物模型可分为基因相关模型与非基因相关模型(图1),前者包括遗传性和基因工程动物模型。非基因相关模型指在相同或相似的遗传背景下,通过环境、手术、药物等各因素诱导得到的动物模型。
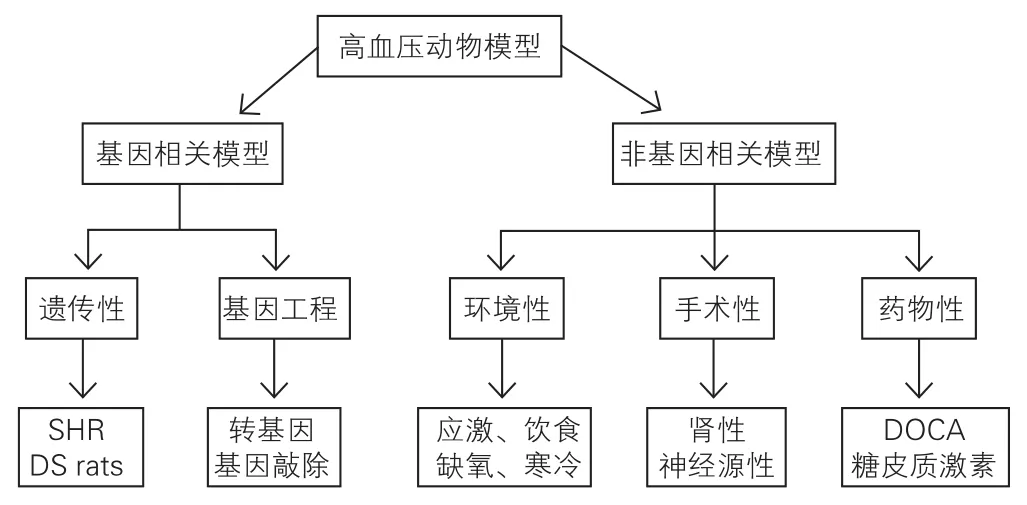
图1 高血压动物模型分类
1 基因相关模型
1.1 遗传性高血压模型
遗传性高血压模型可以模拟人类的遗传现像,其中以自发性高血压大鼠(SHR)最为常用。SHR成鼠血压水平一般>200 mmHg(1 mmHg=0.133 kPa),初期并没有明确的病理性紊乱证据,后期出现高血压靶器官损害[1],是目前国内外公认的最接近人类原发性高血压的动物模型,其亚群包括易卒中型、抗卒中型等。SHR缺乏严格的血压对照[2],血压正常的Wistar大鼠遗传差异程度与SHR有很大不同,使得SHR在高血压遗传背景的研究中有所限制。Dahl 盐敏感性大鼠(DS rats)由对盐敏感的Sprague-Dawley(SD)大鼠培育而来,并在此基础上培育出SS/Jr盐敏感性大鼠,其所有遗传基因组几乎为100%纯合子,摄入不同浓度的含盐食物(8%或0.4% 氯化钠)均可使其产生高血压,并伴发血管和肾脏损害。DS大鼠在揭示盐敏感高血压的发病机制方面具有重要作用,遗传连锁分析发现盐敏感基因连锁位点靠近血管紧张素转化酶基因和鸟苷酸环化酶偶联受体A/心房利钠因子受体基因[1,3],提示这可能与高血压的形成有关。此类模型遗传背景较为明确,性状稳定,但与人类的种属差异较大。目前缺乏遗传性大动物模型,无论是宾夕法尼亚高血压犬还是转基因高血压幼猪(未公开报道)遗传背景均不清楚,如能证实其可靠性及稳定性,其在高血压的发病机制研究等诸多领域将有广泛的应用前景。
1.2 基因工程高血压动物模型
基因工程动物是指某些遗传性状通过基因工程手段而被人为改造的动物,包括转基因及基因敲除动物模型。转基因小鼠同时含有大鼠或人类的血管紧张素原基因和肾素基因,含有人类基因的小鼠血压明显增高。转基因大鼠由SD大鼠培育而来,TGR (mREN2)27即为其中一种,是研究正常或低肾素型高血压的较好模型。另外,敲除血管紧张素转化酶或血管紧张素Ⅱ1型受体基因的小鼠血压降低,提示血管紧张素转化酶及血管紧张素Ⅱ1型受体在高血压发病中有重要作用。光传感因子基因是应激性高血压的候选基因[4],其敲除后小鼠血压升高,同时伴有周围交感神经兴奋性的改变[5],提示其可能作为应激性高血压治疗的潜在靶点。此类模型具有适宜的对照组,在绵羊、奶牛、山羊等大动物研究中亦有所应用,适宜探究特定基因在高血压发病中的机制,但该模型仅能研究单基因或双基因的影响,所需的技术要求较高,国内尚无高血压基因工程大鼠模型制备成功和应用的报道,因此,此模型应用到人体还有待时日。
2 非基因相关性模型
2.1 环境诱导高血压动物模型
环境因素在高血压的发生发展中具有重要作用,人们通过将动物暴露于各种不同的环境诱导产生高血压,主要包括以下类型:
应激性高血压动物模型:应激性高血压动物模型多利用足底电击、噪音、震荡笼等作为应激原建模,我国学者金荫昌等[6]早在上世纪60年代即通过铃声、电光等刺激建立了应激性犬模型。此类模型机制与交感神经系统(SNS)、肾素-血管紧张素系统(RAS)、延髓腹外侧区胆碱能系统相关[2]。Porter等[7]发现空气喷射压力刺激亦可使SHR血压升高,其机制与杏仁核中央核团、蓝班功能调节及皮质激素释放激素阳性神经元的作用有关(图2)。此类方法建模时间较长,成模率低,使其应用受到一定限制。
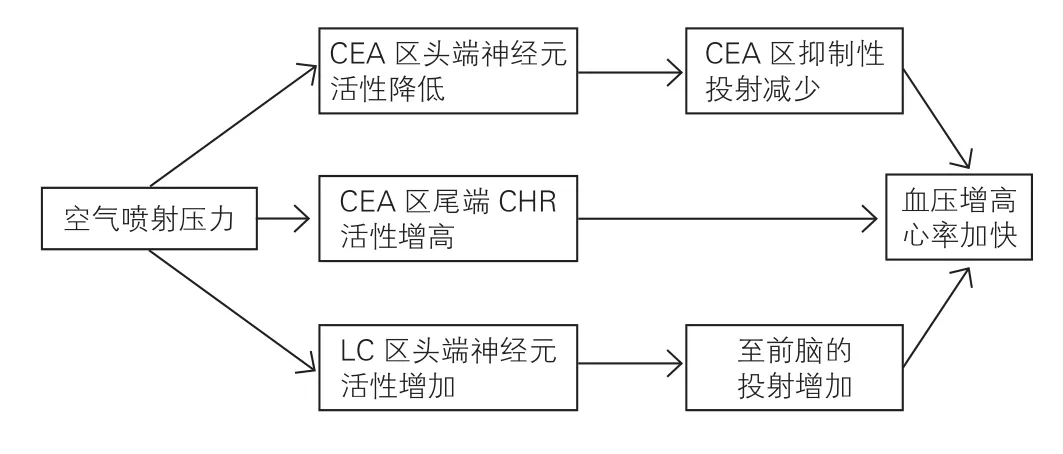
图2 空气喷射压力致自发性高血压大鼠血压升高机制
饮食性高血压动物模型:研究显示长期给予特殊饮食可诱导动物产生高血压。在实验犬正常饮食中加入牛油或猪油,喂食5~6周后血压明显增高,血浆肾素活性及去甲肾上腺素浓度增加,伴有高血脂、高血糖、胰岛素抵抗等代谢综合征表现。喂养大鼠富含果糖的饮食亦能使血压升高,SNS、RAS激活及水钠潴留在这类模型中可能发挥一定作用[2]。高盐饮食也可建立高血压动物模型,Denton等[8]逐渐增加黑猩猩饮食中的含盐量,观察到实验组动物血压平均增高33/10 mmHg。此类模型建模时间较长,血压升高程度有限,停止特殊饮食后,血压不能长期维持。目前国内多采用不同饮食混合喂养以提高成模率,已有大动物(犬)的相关研究,其在代谢综合征方面有着广泛的应用前景。
另外,低氧及寒冷环境亦可使实验动物血压升高。研究者通过周期性改变大鼠饲养舱中氧浓度建立慢性间歇低氧高血压动物模型。该模型中动物血压升高有低氧程度、低氧时间依赖性[9],伴有血管内皮功能障碍及结构改变[10],中枢交感调节位点直接作用增强[11]。冷环境中大鼠血浆和尿液中儿茶酚胺浓度增高,提示血压升高可能与SNS激活有关[2],亦有研究认为其与一氧化氮水平、内皮素系统、炎症途径、氧化应激等相关[12]。此类模型需对环境进行严格控制,在大动物饲养中较难做到,因此在某种程度上限制了此类模型的研究和应用。
2.2 手术性高血压动物模型
肾性高血压动物模型:肾性高血压动物模型包括肾血管性和肾实质性高血压模型。前者通过钳夹肾动脉致肾动脉狭窄建模,主要包括一肾一夹、两肾一夹、二肾二夹法。二肾二夹法保留动物双侧肾脏,钳夹双侧肾动脉,两肾一夹法钳夹单侧肾动脉,一肾一夹法切除一侧肾脏,钳夹另一侧肾动脉。此类模型可用于大动物,可靠性高,重复性好,部分可用于房颤的相关研究[13,14],肾脏在该模型中免除了高血压的作用,故不适宜研究其功能及结构损害。肾实质性高血压模型通过手术切除动物的部分肾脏(超过85%)、增加饮水或食物中盐含量来使血压升高[15]。该模型对肾功能影响较大,术后6月~1年观察到蛋白尿进展,提示血压增高可能与肾功能下降有关[16]。此外还可通过肾缺血、肾纤维化建立该模型。肾实质性高血压模型改变实验动物正常生理机能,对肾脏损伤较大,血压升高程度有限,需要饮食因素辅助干预,目前在国内应用较少。
神经源性高血压动物模型:Jannetta在上世纪70年代提出“神经源性高血压”假说,通过外科手术搏动性刺激延髓左侧腹外侧Ⅸ、Ⅹ对脑神经入脑干区建立狒狒高血压模型。此类模型中实验动物SNS活性增加、血浆肾上腺素和去甲肾上腺素水平显著升高,但机制仍不明确,可能与延髓腹外侧区增加的血管紧张素Ⅱ与血管紧张素Ⅱ1型受体结合后致谷氨酸释放增加有关。目前该模型主要用于犬、猫、灵长类等大动物,实验成本较高,对手术操作及饲养环境要求严格,围术期死亡风险大,在我国仅有个别报道,并未广泛开展。
2.3 药物性高血压动物模型
经典药物致高血压动物模型:在药物性高血压模型中,去氧皮质酮醋酸纤维素(DOCA)、辣椒辣素、亚硝基左旋精氨酸甲酯(L-NAME)应用最多。DOCA、辣椒辣素可致盐敏感性高血压。DOCA模型通过摄入高剂量DOCA [300~1000 mg/(kg.d)]及 NaCl、切除部分肾实质或单侧肾脏建模,不依赖RAS[3],表现为高容量负荷高血压,与抗利尿激素、SNS、内皮系统、氧化应激等作用相关[2],多用于原发性醛固酮增多所致高血压的研究。辣椒辣素模型通过给实验动物注射辣椒辣素,损伤感觉神经,使其对血浆肾素活性及醛固酮的抑制性降低,从而增加盐敏感性,其机制还与脊髓背根神经降钙素基因相关肽减少、水钠潴留、局部组织血管紧张素转化酶作用有关。L-NAME是一氧化氮合酶竞争性抑制剂,阻碍内皮舒张因子一氧化氮生成。腹腔内注射或溶于水中喂食L-NAME均可使血压升高,同时伴有心脏指数、心肌细胞直径、小动脉管径、管壁厚度的明显改变。该模型需长期给药维持血压,药物过量可致动物体重下降过快而死亡,因此应用受限。目前国内外此类模型多见于大鼠,大动物相关研究较少。
RAS成分、糖皮质激素致高血压模型:RAS成分能成功诱导动物发生高血压,给实验犬、羊静脉注射血管紧张素Ⅱ或醛固酮均可观察到血压升高,其机制与外周血管收缩有关,与中枢RAS或SNS作用可能并无关联。此类模型建模时间短,但停药后血压恢复正常,如何建立长期给药的方法有待探索。给予孕期母羊糖皮质激素[17,18]可观察到胎羊在成年后平均动脉压增高,机制可能与血管紧张素Ⅱ与血管紧张素(1-7)比例失衡有关[19]。但这一方法在灵长类动物中并未得到相同结论[20],具体原因仍不明确。该模型目前多用于研究动物产前糖皮质激素使用与产后血压、肾功能、内皮功能的相关关系,但由于其实验成本较高,国内外应用相对较少。
另外,其他多种药物均可用于高血压建模,如丁硫氨酸亚砜胺[21]、维生素D和尼古丁、苯酚、氯化镉[22]等,其机制可能包括细胞内钙超载、脂质过氧化、水钠潴留等多个方面。在其他疾病模型如肾衰模型、多囊卵巢综合征模型中,亦可观察到实验动物血压升高。研究者可根据研究目的选用不同高血压动物模型,研究其与高血压的关系。
综上所述,基因相关性高血压模型中,SHR最接近人类原发性高血压,因此应用最多;基因工程动物基于单基因或双基因的研究,为高血压的治疗提供了潜在靶点。非基因相关模型中,环境性高血压主要与SNS、RAS激活有关,提示其在高血压发病机制中的关键作用;神经源性高血压可避开药物干扰,在经导管射频消融去肾神经术治疗高血压的研究方面具有广泛的应用前景;药物性高血压建模方法相对简单,有利于研究不同因素致高血压的相关机制。
目前,国内外对于高血压动物模型的研究多集中于小动物,这与实验成本较低,前期研究结果稳定可靠有关。国内仅有个别中心开展了大动物的相关研究,在大动物饲养条件、技术支持、指标检测方面还有待改进。在国外,关于大动物模型的研究较多,建模方法日趋成熟。但目前仍缺乏国际公认的原发性高血压大动物模型,推测可能与大动物遗传背景复杂,环境因素控制难度较大有关。另外,由于人类疾病的复杂性及特异性,动物模型并不能模拟人类高血压疾病的所有特质,因此人们必须彻底理解动物模型并经过严格的分析才能将结果应用于人类身上。高血压动物模型在研究高血压发病机制及并发症方面起着关键的作用,相信随着相关研究的不断深入,其将进一步揭示高血压发生、发展的规律,并为高血压的治疗提供帮助。
[1]王文, 刘力生. 原发性高血压的实验模型. 高血压杂志, 1997, 5:266.
[2]Sun ZJ, Zhang ZE. Historic perspectives and recent advances in major animal models of hypertension. Acta Pharmacol Sin, 2005, 26: 295-301.
[3]Sarikonda KV, Watson RE, Opara OC, Experimental animal models of hypertension. J Am Soc Hypertens, 2009, 3: 158-165.
[4]Grassi G. Phosducin - a candidate gene for stress-dependent hypertension. J Clin Invest, 2009, 119: 3515-3518.
[5]Beetz N, Harrison MD, Brede M, et al. Phosducin influences sympathetic activity and prevents stress-induced hypertension in humans and mice. J Clin Invest, 2009, 119: 3597-3612.
[6]徐丽娜, 曾贵云, 金荫昌. 利血平对正常狗的条件反射和血压的影响. 生理学报, 1961, 24: 151-160.
[7]Porter K, Hayward LF. Stress-induced changes in c-Fos and corticotropin releasing hormone immunoreactivity in the amygdala of the spontaneously hypertensive rat. Behav Brain Res, 2011, 216: 543-551.
[8]Denton D, Weisinger R, Mundy NI, et al. The effect of increased salt intake on blood pressure of chimpanzees. Nat Med, 1995, 1: 1009-1016.
[9]Wan NS, Chen BY, Feng J, et al. The effects of chronic intermittent hypoxia on blood pressure and sympathetic nerve activity in rats.Zhonghua Jie He He Hu Xi Za Zhi, 2012, 35: 29-32.
[10]Totoson P, Fhayli W, Faury G, et al. Atorvastatin protects against deleterious cardiovascular consequences induced by chronic intermittent hypoxia. Exp Biol Med (Maywood). 2013, 238: 223-232.
[11]Sunderram J, Androulakis IP. Molecular mechanisms of chronic intermittent hypoxia and hypertension. Crit Rev Biomed Eng, 2012,40: 265-278.
[12]王青梅, 郭宏, 田野. 寒冷暴露与高血压. 中华高血压杂志, 2013,21: 21-24.
[13]Lau DH, Mackenzie L, Rajendram A, et al. Characterization of cardiac remodeling in a large animal "one-kidney, one-clip" hypertensive model. Blood Press, 2010 , 19: 119-125.
[14]Lau DH, Mackenzie L, Kelly DJ, et al. Hypertension and atrial fibrillation: evidence of progressive atrial remodeling with electrostructural correlate in a conscious chronically instrumented ovine model. Heart Rhythm, 2010, 7: 1282-1290.
[15]Singh RR, Denton KM, Bertram JF. Reduced nephron endowment due to fetal uninephrectomy impairs renal sodium handling in male sheep.Clin Sci (Lond), 2010, 118: 669-680.
[16]Singh RR, Denton KM, Bertram JF, et al. Development of cardiovascular disease due to renal insufficiency in male sheep following fetal unilateral nephrectomy. J Hypertens, 2009, 27: 386-396.
[17]Shaltout HA, Figueroa JP, Rose JC, et al. Alterations in circulatory and renal angiotensin-converting enzyme and angiotensin-converting enzyme 2 in fetal programmed hypertension. Hypertension, 2009, 53:404-408.
[18]Moritz KM, Dodic M, Jefferies AJ, et al. Haemodynamic characteristics of hypertension induced by prenatal cortisol exposure in sheep. Clin Exp Pharmacol Physiol, 2009, 36: 981-987.
[19]Shaltout HA, Rose JC, Chappell MC, et al. Angiotensin-(1-7)deficiency and baroreflex impairment precede the antenatal Betamethasone exposure-inducedelevation in blood pressure.Hypertension, 2012, 59: 453-458.
[20]Bramlage CP, Schlumbohm C, Pryce CR, et al. Prenatal dexamethasone exposure does not alter blood pressure and nephron number in the young adult marmoset monkey. Hypertension, 2009, 54: 1115-1122.
[21]Vargas F, Rodríguez-Gómez I, Pérez-Abud R, et al.Cardiovascular and renal manifestations of glutathione depletion induced by buthionine sulfoximine. Am J Hypertens, 2012, 25: 629-635.
[22]Donpunha W, Kukongviriyapan U, Sompamit K, et al. Protective effect of ascorbic acid on cadmium-induced hypertension and vascular dysfunction in mice. Biometals, 2011, 24: 105-115.
410013 湖南省长沙市,中南大学湘雅三医院 心内科
沈智洁 硕士研究生 主要从事于高血压发病机制的研究 Email:847417001@qq.com 通讯作者:杨侃 Email: kanyang0731@163.com
R54
A
1000-3614(2014)03-0232-03
10.3969/j.issn.1000-3614.2014.03.020
2013-11-14)
(编辑:王宝茹)
