主动脉瓣置换术后再发主动脉夹层的外科治疗
2014-09-11张良常谦于存涛孙晓刚钱向阳
张良,常谦,于存涛,孙晓刚,钱向阳
主动脉瓣置换术后再发主动脉夹层的外科治疗
张良,常谦,于存涛,孙晓刚,钱向阳
目的:回顾性分析25例患者主动脉瓣术后再发主动脉夹层的外科治疗,提高对主动脉瓣术后主动脉夹层病变的防治认识。
方法:收集2003-06至2012-06我院主动脉瓣术后再发主动脉夹层患者25例,其中男20例,女5例,再次手术间隔时间(4.79±2.73)年。行主动脉根部替换4例,升主动脉替换6例,升主动脉+全弓替换+象鼻支架植入13例,全胸腹主动脉替换2例。对所有出院患者均进行了门诊复查和电话随访。
结果:在本组中,25例患者均为A型夹层,急性主动脉夹层10例(40%),慢性主动脉夹层15例(60%);原发破口位置:窦管交界处8例,升主动脉前壁7例,后壁6例,弓部小弯侧4例。体外循环时间平均(181±61)min;住院时间(22±10)天。术中死亡1例;术后肾功能不全5例,经血滤治疗后好转;神经功能障碍7例,包括一过性神经功能障碍4例,局灶性脑梗塞3例,无轻瘫、截瘫等脊髓功能不全发生。马凡综合征患者升主动脉直径年增长值(4.3±3.3)mm(P<0.05)。术后随访100%,平均随访时间(52.32±26.23)个月,3年生存率85%。
结论:主动脉瓣置换术后夹层再手术风险是可以接受的,再手术死亡率较初次手术没有明显增加。
主动脉瓣置换术;主动脉夹层 ;再次手术
(Chinese Circulation Journal, 2014,29:224.)
主动脉瓣病变术后继发主动脉夹层在临床并不多见,但后果却是严重而致命的。随着心脏外科技术的进步,主动脉夹层的手术死亡率仍然高达9%~24%[1,2]。主动脉瓣初次手术后并发主动脉夹层,更是增加了手术死亡及术后并发症率[3],因为初次手术造成胸骨后广泛粘连,对原先心脏人工植入物的处理等均增加了手术难度。主动脉瓣置换术后继发主动脉夹层,再次行外科手术风险增加,因此,本研究通过本中心25例临床总结,提高了对主动脉瓣术后再发主动脉夹层及外科手术结果的认识。
1 资料和方法
收集我院2003-06至2012-06行主动脉瓣置换术后继发主动脉夹层并再次接受外科手术的患者25例。男性20例,女性5例,年龄24~70岁,平均(45±12)岁。其中合并高血压的共10例,纽约心功能分级(NYHA)心功能Ⅱ级 19例,Ⅲ级 6例。初次主动脉瓣置换术在我院完成的共8例(32%),外院17例(68%)。再次手术前主动脉病变均经过心脏超声和主动脉计算机断层摄影术确诊。本组患者中,初次入院手术病因:风湿性主动脉瓣病变14例,主动脉瓣二瓣化畸形6例,马凡综合征主动脉瓣反流5例;主动脉瓣病理改变,单纯主动脉瓣狭窄3例,主动脉瓣狭窄合并主动脉瓣关闭不全22例。初次手术方法:患者均接受了主动脉瓣置换,其中4例同期行升主动脉成形术,2例同期行二尖瓣置换术。
25例患者再次手术行主动脉根部替换4例,升主动脉+全弓替换+象鼻支架植入术13例,升主动脉替换6例,全胸腹主动脉替换2例(表 1)。对所有出院患者均进行了门诊复查和电话随访。
统计学方法:本组计量资料以均数±标准差表示,术后生存时间采用Kaplan-Meier生存分析。P<0.05 为差异有统计学意义。
2 结果
25例患者行主动脉瓣术后再次入院行主动脉外科手术间隔时间为0.8~10年,平均(4.79±2.73)年。25例患者均为A型夹层,急性主动脉夹层10例(40%),慢性主动脉夹层15例(60%);原发破口位置窦管交界处8例,升主动脉前壁7例,后壁6例,弓部小弯侧4例。20例因明显胸痛就诊(胸痛至就诊最短6小时,最长6个月),5例为复查时发现。25例患者体外循环时间 52~323 min,平均(181±61)min;主动脉阻断 30~155 min,平均(81±35)min;行主动脉弓部替换时,全身停循环(17±15)min。术中死亡1例,其余患者术后均康复出院,住院及出院30天内死亡率4%。术后早期并发症包括:再次开胸止血3例;术后肾功能不全5例,经血滤治疗后好转;神经功能障碍7例(包括一过性神经功能障碍4例,局灶性脑梗塞3例,无轻瘫、截瘫等脊髓功能不全发生);术后肺部并发症4例(包括3例因肺部感染及肺不张二次气管插管,1例术后自发性气胸);肠道并发症3例,均为术后肠麻痹,治疗后康复。(表1)
表1 25例主动脉瓣置换术后患者再次手术资料(±s)
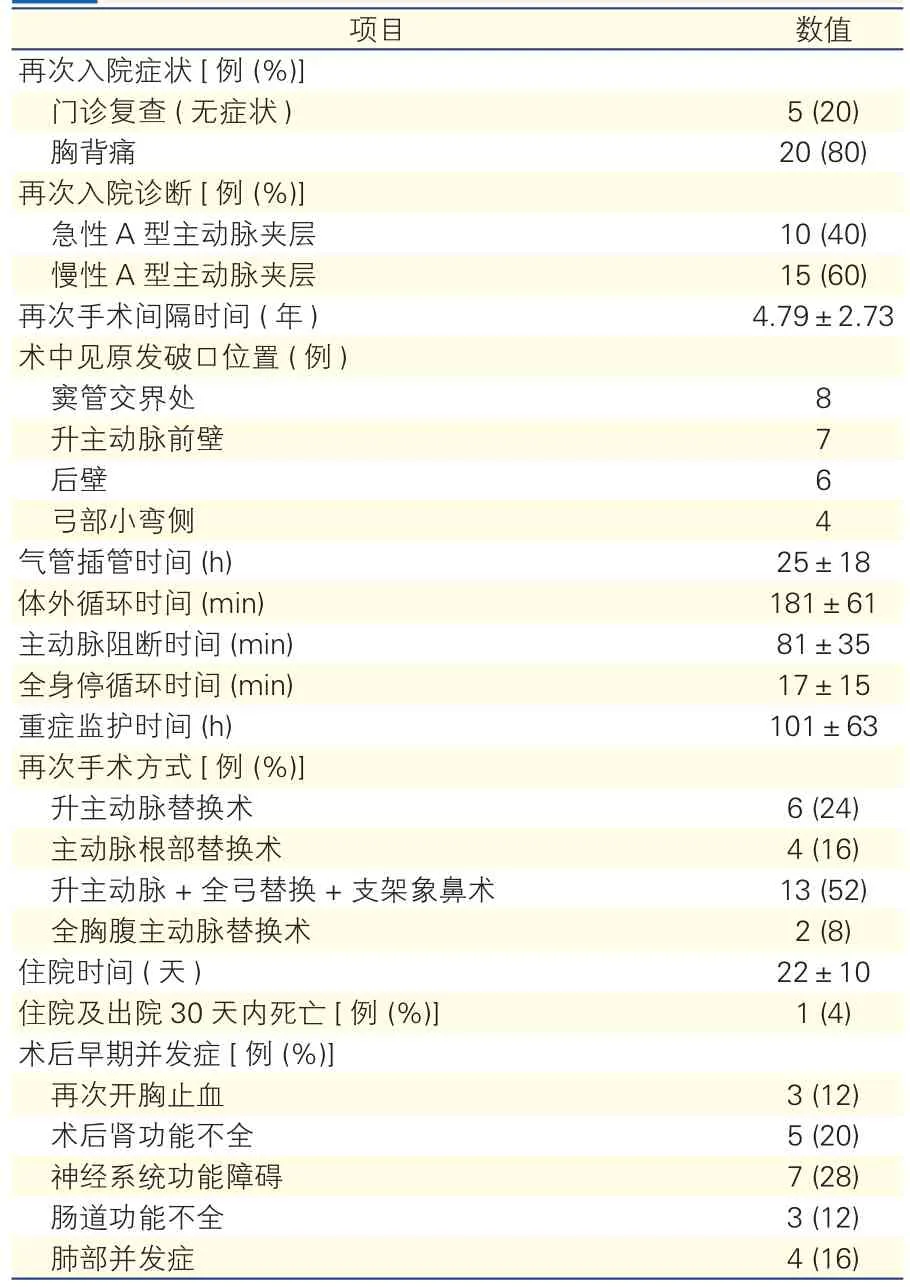
表1 25例主动脉瓣置换术后患者再次手术资料(±s)
项目 数值再次入院症状[例 (%)]门诊复查 (无症状) 5 (20)胸背痛 20 (80)再次入院诊断[例 (%)]急性A型主动脉夹层 10 (40)慢性A型主动脉夹层 15 (60)再次手术间隔时间 (年) 4.79±2.73术中见原发破口位置 (例)窦管交界处8升主动脉前壁 7后壁 6弓部小弯侧 4气管插管时间 (h) 25±18体外循环时间 (min) 181±61主动脉阻断时间 (min) 81±35全身停循环时间 (min) 17±15重症监护时间 (h) 101±63再次手术方式[例 (%)]升主动脉替换术 6 (24)主动脉根部替换术 4 (16)升主动脉+全弓替换+支架象鼻术 13 (52)全胸腹主动脉替换术 2 (8)住院时间 (天) 22±10住院及出院30天内死亡[例 (%)]1 (4)术后早期并发症[例 (%)]再次开胸止血3 (12)术后肾功能不全 5 (20)神经系统功能障碍 7 (28)肠道功能不全 3 (12)肺部并发症 4 (16)
25例主动脉瓣置换术后患者不同病因升主动脉直径年增长值中,马凡综合征患者升主动脉直径再次手术前与初次手术前比,差异具有统计学意义(P<0.05);其他病因再次手术前与初次手术前比,差异无统计学意义(P>0.05)。(表 2)
表2 25例主动脉瓣置换术后患者不同病因升主动脉年增长值(±s)

表2 25例主动脉瓣置换术后患者不同病因升主动脉年增长值(±s)
注:与初次手术前比*P<0.05。
病因 例数 间隔时间 (年) 升主动脉直径 (mm)初次手术前 再次手术前 年增长值风湿性心脏病 14 5.3±3.1 44.3±8.4 49.4±24.3 3.2±4.6二瓣化畸形 6 4.4±4.3 42.5±6.2 50.2±17.0 4.5±4.0马凡综合征 5 4.3±2.9 40.4±4.6 55.4±11.5* 4.3±3.3
术后随访率100%,平均随访时间6~112个月,平均(52.32±26.23)个月。随访期间3例死亡,1例死于脑卒中,1例死于夹层破裂,1例死于心功能衰竭。3年生存率85%,随访期间无患者因主动脉病变再次行外科治疗。
3 讨论
Matthew研究组通过大样本的数据荟萃分析显示,主动脉术后再发夹层的患者外科手术死亡率可高达50%,是初次主动脉夹层手术死亡率的2倍[4,5],高手术风险与原发心脏疾病类型、手术方式的选择、主动脉插管、心脑保护及手术时间等密切相关。为能更彻底的消除主动脉夹层,本组52%患者接受了全弓替换加象鼻支架技术,并为远期可能出现的主动脉再次手术置留了空间[6]。3例患者因年龄大及主动脉弓分离困难,只接受了单纯升主动脉替换,另3例患者在开胸时心脏破裂,心肌保护不佳,为了减少手术时间,我们选择了单纯升主动脉替换。
Standford A型夹层发病48小时内,死亡率高达40%,大多是因为夹层破裂和心包填塞,主动脉瓣病变术后再发夹层病例中,夹层破裂和心包填塞明显较低,得益于初次手术后胸骨后广泛粘连,术前死亡率并不高于初次主动脉夹层患者。Gillinov等[7]对比两组术前死亡率,再次夹层术前死亡率是3.2%,明显低于初次原发主动脉夹层组的16.1%。相反,主动脉术后再次夹层患者手术死亡率,不同中心却又明显不同。Collins等[8]和Von等[9]报道显示,再次主动脉夹层手术的死亡率(31%:16%),正中切口行全弓替换是独立风险因素。再次正中开胸时,心脏及主动脉广泛粘连,心脏破裂明显增加。Svensson等[10]认为,随着手术技术的提高、深低温体循环保护措施、脑保护措施等技术改进,再次主动脉夹层手术较初次主动脉夹层手术,没有增加手术死亡率。在本组病例中,所有病人先经股动脉插管,3例患者开胸时右心室破裂,均在迅速建立体外下得到修补,无开胸和游离时主动脉破裂发生,有效降低了开胸时的手术风险。本组仅1例患者术中死亡(4%),因主动脉A型夹层累及长段右冠状动脉,术毕心脏无法复苏而死亡。
不同外科中心,随着经验不同,结果有明显差异,但可以明确一致的是,再次行主动脉夹层手术的患者,术后并发症却无明显差异[8,10]。本组研究也证实,虽然手术时间和输血量增加,但术后并发症并无明显增加,可能与本组患者年龄年轻(平均45岁),术前脏器功能良好有关。本组患者脑部并发症出现率高,达28%,但无器质性损伤,多为一过性脑功能障碍,局灶性脑梗塞,均在治疗后平稳出院。Hitoshi等[11]临床总结显示,心脏术后再次夹层手术1年生存率93%,5年生存率74%,较初次手术,没有明显增加。在我们平均随访52月中,3年生存率85%,无主动脉病变再手术,中期效果与其他外科中心一致。良好的外科治疗效果,增加了外科医师积极处理复杂主动脉病变的信心。
医源性主动脉夹层是夹层病因之一,占所有夹层的5%,其中69%有既往心脏手术史,而亚洲人种,周围血管疾病,年龄大于60岁及主动脉中层改变是再发主动脉夹层的危险因素[12]。Kodolitsch等[13]研究发现,主动脉瓣手术后约0.6%患者术后继发主动脉夹层,而夹层患者中,9%曾经既往行主动脉瓣手术,薄或脆的主动脉壁、主动脉瓣反流是主动脉夹层的高危因素。主动脉瓣手术时增粗的升主动脉长期困扰着外科医师对于手术方式的的选择,初次手术主动脉直径大于50 mm,术后再发主动脉夹层的机率明显增加[14],直径低于50 mm的升主动脉与术后再发夹层的相关程度如何却争论不已。但Borger等[15]强烈认为,升主动脉直径45 mm是手术干预的分界线,直径大于45 mm时,需要积极处理。本组马凡患者中再手术间隔最短,为4.3年,初次手术前升主动脉直径40.4 mm,升主动脉的年增长直径是4.3 mm,高于风心病组和二瓣化组,具有统计学意义,和其他中心报道相似[16],马凡综合征患者行主动脉瓣置换术后更易出现升主动脉扩张。本组病例为回顾性研究,病例总数少,难以定论初次手术升主动脉直径和夹层发生相关性,但马凡综合患者术后升主动脉更易扩张,需要术后严密随访。
术后夹层的发生也与主动脉操作有关,原发破口常在原主动脉切口附近,通常伴有内膜长段撕裂和血栓形成。本组8例(32%)原发破口位于窦管交界,7例(28%)位于升主动脉前壁,其余10例(40%)均远离原主动脉切口,但仅通过肉眼病理观察,我们没法确定原发破口与初次主动脉切口直接相关。同部分外科组报道相似,Anthony等[17]发现51%原发破口靠近原主动脉操作口,如主动脉切口和搭桥近端吻合口,主动脉夹层与原操作是紧密相关的。同样薄而脆的主动脉壁,特别是有中层改变的主动脉壁,容易出现术后夹层。本组中11例(44%)初次手术明确主动脉壁病变(6例为二瓣化畸形,5例为马凡综合征),马凡综合征患者主动脉中层弹力纤维减少断裂及囊性病变增加了夹层发生,这一点已达成共识[18]。Parai等认为[19-21],主动脉瓣二瓣化合并主动脉疾病,与主动脉中层囊性坏死相关,是一种先天性主动脉遗传性疾病。部分研究者认为,单纯主动脉瓣置换能降低二瓣化患者主动脉的扩张速度,但不能预防术后远期主动脉不良事件的发生,增加了再次主动脉手术干预的风险,特别是主动脉夹层的发生[22]。此外,本组约60%患者初次手术为病因为风湿性改变,是风湿性病变继续侵犯了主动脉壁,抑或是主动脉操作导致了术后夹层,或是多种因素的共同作用的结果,目前仍无法明确。因此,初次手术时必须注意手术中操作的细致,特别对于主动脉壁薄、伴有钙化及明确主动脉壁中层病变的患者。
本研究为回顾性研究,大部分患者初次手术在院外完成,初次术前信息不全面,无法精确评价术后主动脉夹层发生的风险因素;其次,夹层发病急,死亡率高,能到我院手术的患者,已经存在一定的选择性偏奇;同时,术后主动脉夹层的发生率本身很低,为小概率事件,以至本组样本量小,我们无法全面确定主动脉瓣置换术后继发主动脉夹层的真实发病率和死亡率。
主动脉夹层是主动脉瓣术后严重并发症,是临床预防和治疗的难点之一。主动脉瓣置换术后夹层再手术风险是可以接受的,再手术死亡率较初次手术没有明显增加,长期结果仍在继续观察中。完善术前风险因素分析,细致的术中操作和严格术后随诊,均有利于防止和减少术后主动脉夹层的发生。
[1]Bavaria JE, Brinster DR, Gorman RC, et al. Advances in the treatment of acute type A dissection: an integrated approach. Ann ThoracSurg,2002, 74: S1848-1852.
[2]Rampoldi V, Trimarchi S, Eagle KA, et al. Simple risk models to predict surgical mortality in acute type A aortic dissection:the International Registry of Acute Aortic Dissection score. Ann ThoracSurg, 2007, 83: 55-61.
[3]Demirtas S, Osken A, Vatan MB, et al. Asymptomatic aorticdissection late after aortic valve replacement. Maedica (Buchar), 2012, 7: 177-179.
[4]Matthew LW, Shubin S, James S. Aortic Dissection as a complication of cardiac surgery: Report From The Society of Thoracic Surgeons Database. AnnThoracSurg, 2010, 90: 1812-1817.
[5]Hagan PG, Nienaber CA, Isselbacher EM, et al. The International Registry of Acute Aortic Dissection (IRAD): new insightsinto an old disease. JAMA, 2000, 283: 897-903.
[6]Sun LZ, Qi RD, Chang Q, et al. Surgery for acute type A dissection using total arch replacement combined with stented elephant trunk implantation: Experience with 107 patients. J Thorac Cardiovasc Surg,2009, 138: 1358-1362.
[7]Gillinov AM, Lytle BW, Kaplon RJ, et al. Dissection of the ascending aorta after previous cardiac surgery: differences in presentation and management. J ThoracCardiovascSurg, 1999, 117: 252-260.
[8]Collins JS, Evangelista A, Nienaber CA, et al. Differences in clinical presentation, management, and outcomes of acute type a aortic dissection in patients with and without previous cardiac surgery.Circulation, 2004, 110(11 suppl 1): II237-242.
[9]Von KY, Simic O, Schwartz A, et al. Predictors of proximal aortic dissection at the time of aortic valve replacement. Circulation, 1999,100(19 suppl): II287-294.
[10]Svensson LG, Crawford ES, Hess KR, et al. Dissection of the aorta and dissecting aortic aneurysms. Improving early and long-term surgical results. Circulation, 1990, 82(Suppl 4): 24-38.
[11]Hitoshi H, Lars GS, Bruce WL. Aortic Dissection After Previous Cardiovascular Surgery. Ann ThoracSurg, 2004, 78: 2099-2105.
[12]Januzzi JL, Sabatine MS, Eagle KA, et al. Iatrogenic aortic dissection.Am J Card, 2002, 89: 623-626.
[13]vonKodolitsch Y, Loose R, Ostermeyer J, et al. Proximal aortic dissection late after aortic valve surgery: 119 cases of a distinct clinical entity. ThoracCardiovascSurg, 2000, 48: 342-346.
[14]Pieters FA, Widdershoven JW, Gerardy AC, et al. Risk of aortic dissection after aortic valve replacement. Am J Cardiol, 1993, 72:1043-1047.
[15]Borger MA, Preston M, Ivanov J, et al. Should the ascending aorta be replaced more frequently in patients with bicuspid aortic valve disease? J ThoracCardiovascSurg, 2004, 128: 677-683.
[16]vanKarnebeek CD, Naeff MS, Mulder BJ, et al. Natural history of cardiovascular manifestations in Marfan syndrome. Arch Dis Child,2001, 84: 129 -37.
[17]Anthony LE, Charles CM, Tsuyoshi K. Outcomes of Acute Type A Aortic Dissection After Previous Cardiac Surgery. Ann ThoracSurg,2010, 89: 1467-1474.
[18]Schoenh FS, Jungi S, Czerny M, et al. Acute aortic dissection determines the fate of initially untreated aortic segments in Marfan syndrome. Circulation, 2013, 16, 127: 1569-1575.
[19]Parai JL, Masters RG. Aortic medial changes associated with bicuspid aortic valve: myth or reality? Can J Cardiol, 1999, 15: 1233-1238.
[20]易定华, 段维勋. 中国主动脉夹层诊疗现状与展望. 中国循环杂志,2013 , 28: 1-2.
[21]蒙延海, 常谦. 升主动脉瘤中细胞外基质与信号调节研究进展. 中国循环杂志, 2011, 26: 235-236.
[22]Sutsch G, Jenni R, von Segesser L, et al. Predictability of aortic dissection as a function of aortic diameter. Eur Heart J, 1991, 12:1247-1256.
Surgical Treatment for Recurrence of Aortic Dissection in Patients After Aortic Valve Replacement
ZHANG Liang, CHANG Qian, YU Cun-tao, SUN Xiao-gang, QIAN Xiang-yang.
State Key Laboratory of Cardiovascular Disease, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC,Beijing (100037), China
CHANG Qian, Email: chqfw@yahoo.com
Objective: To analyze the surgical treatment for recurrence of aortic dissection in patients after aortic valve replacement (AVR) in order to improve the clinical practice for treating such patients.
Methods: We retrospectively studied 25 patients who
reoperation for aortic dissection after AVR in our hospital from 2003-06 to 2012-06. The interval time between 2 operations was (4.79±2.73) years. There were 4 patients received Bentall’s procedure, 6 received ascending aortic replacement, 13 received ascending aortic arch + total aortic arch replacement + elephant trunk procedure and 2 received total thoracic and abdominal aorta replacement. All patients were recorded by off i ce visit and telephone interview.
Results: All 25 patients suffered from type A dissection including 10 (40%) acute and 15 (60%) chronic aortic dissection. There were 8 patients with the original rupture at the border of sinus and tubing, 7 at the front wall of ascending aorta, 6 at the back wall of ascending aorta and 4 at aortic arch. The average extracorporeal circulation time was (181±61) min and the in-hospital time was (22±10) days. There were 1 patient died during the operation, 5 with post operative renal insuff i ciency and they were improved by hemof i ltration, 7 with neurological complication including 4 transient brain dysfunction and 3 local brain infarction. No post operative spinal cord def i cits occurred. The patients with Marfan syndrome had the ascending aorta growth at (4.3±3.3) mm per year, P<0.05. All patients were followed-up for(52.32±26.23) months and the 3-year survival rate was at 85%.
Conclusion: The re-operative risk was acceptable in patients with aortic dissection after AVR, the mortality for reoperation was not obviously higher than the fi rst operation.
Aortic valve replacement; Aortic dissection; Reoperation
100037 北京市,中国医学科学院 北京协和医学院 心血管病研究所 阜外心血管病医院 心血管疾病国家重点实验室
张良 主治医师 博士 从事主动脉外科临床研究 Email:bjkmy2013@163.com 通讯作者:常谦 Email:chqfw@yahoo.com
R54
A
1000-3614(2014)03-0224-04
10.3969/j.issn.1000-3614.2014.03.017
2013-10-21)
(编辑:王宝茹)
