棘球蚴抗原B对小鼠1型糖尿病拮抗作用研究
2014-09-10阿依甫汗阿汗吐尔干艾力阿吉邵英梅哈丽娅新疆医科大学第一附属医院肝胆包虫外科新疆乌鲁木齐830000
阿依甫汗·阿汗,吐尔干艾力·阿吉,邵英梅,温 浩,哈丽娅 (新疆医科大学第一附属医院肝胆包虫外科,新疆乌鲁木齐 830000)
1型糖尿病是一种由T淋巴细胞介导、多种免疫机制共同参与的器官特异性自身免疫性疾病[1],发病机制复杂,迄今尚未完全明了。多种免疫细胞参与1型糖尿病的发病过程,包括T淋巴细胞(Th2和Th1)。在此过程中,Th1/Th2平衡向左移动,抑制细胞免疫反应,使得胰岛β细胞破坏。研究表明,细粒棘球蚴抗原B使Th1/Th2向Th2状态偏移,导致Th1/Th2的平衡紊乱[2-4]。因此,本研究旨在用细粒棘球蚴抗原B干预BALB/C小鼠免疫状态,观察小鼠糖尿病患病情况,分析棘球蚴抗原B对BALB/C小鼠1型糖尿病有无拮抗作用。
1 材料与方法
1.1 实验动物:6~8周龄雄性BALB/c小鼠(清洁级),体重(23±2)g。购于新疆医科大学第一附属医院动物中心,饲养于新疆医科大学第一附属医院动物房内(SPF级),自由饮食。
1.2 主要试剂和耗材:小鼠IL-4、IFN-γ试剂盒:武汉博士德公司;链脲佐菌素(STZ):美国sigma公司;细粒棘球蚴抗原B:新疆医科大学第一附属医院包虫病研究所;柠檬酸、柠檬酸钠:武汉市瑞特化学用品有限公司;血糖仪:德国罗氏卓越型血糖仪;血糖试纸:德国罗氏公司卓越型血糖试纸。
1.3 实验动物分组与处理
1.3.1 实验动物分组:将30例BALB/c小鼠,随机分为A组:肌内注射细粒棘球蚴抗原B加糖尿病成模组;B组:肌内注射生理盐水加糖尿病成模组;C组:正常对照组。每组各10只。购得小鼠后于动物房内常规条件下饲养1周使其适应环境,1周后A组给予浓度为0.54 mg/L的细粒棘球蚴抗原B,100 μg/10 g经肌肉注射,连续5 d。同时B组给予相同剂量(100 μg/10 g)的生理盐水经肌肉注射,连续5 d,观察2天(有无瘙痒、烦躁等)后,A组和 B组均给予小剂量 STZ 40 mg/(kg·d),连续5 d腹腔内注射,C组小鼠未给予任何处理。
1.3.2 指标测定:开始注射STZ后第3天和第7天,测量全部小鼠的血糖、体重,并观察每天饮水量、尿量等情况,血糖≥16.7 mmol/L且次日复测仍为此水平,提示1型糖尿病模型建成[5],于用药后1周、2周、3周测量所有成模小鼠的体重、血糖水平。成模3周后,摘眼球取血法,留取成模小鼠血液标本,10 min离心分离血清,存于-70℃冰箱,以备以后使用,即用ELISA法检测细胞因子。颈椎脱臼处死所有小鼠,分离胰腺组织,置于10%的中性甲醛缓冲液中固定24 h,常规脱水,透明及石蜡包埋,切片,苏木素-伊红染色,光镜下观察胰岛炎,评价胰岛淋巴细胞浸润或胰岛炎的严重程度。
2 结果
2.1 各组实验动物体重变化:A组和B组小鼠初始、成模1周及成模2周时体重分别比较差异无统计学意义(P>0.05),但均轻于C组(P<0.05)。而在成模后3周时,B组小鼠轻于A组(P<0.05)。见表1。
表1 各组小鼠体重变化( ± s,g)
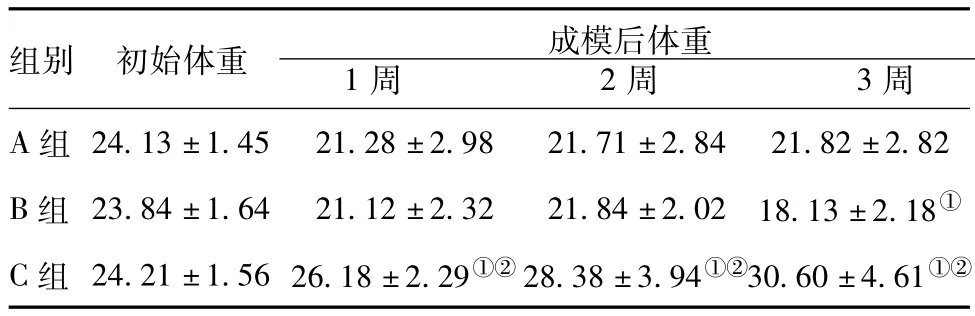
表1 各组小鼠体重变化( ± s,g)
注:与A组相比,①P<0.05;与 B组相比,②P<0.05
组别 初始体重 成模后体重1周 2周 3周A组 24.13±1.45 21.28±2.98 21.71±2.84 21.82±2.82 B组 23.84±1.64 21.12±2.32 21.84±2.02 18.13±2.18①C组 24.21±1.56 26.18±2.29①②28.38±3.94①②30.60±4.61①②
2.2 各组实验动物血糖变化:在注射STZ成模1周、成模2周、成模3周时,A组与B组和C组比较血糖变化差异有统计学意义(P<0.05),表明B组血糖上升水平较A组高;B组和C组血糖之间有明显差异(P<0.05)。见表2。
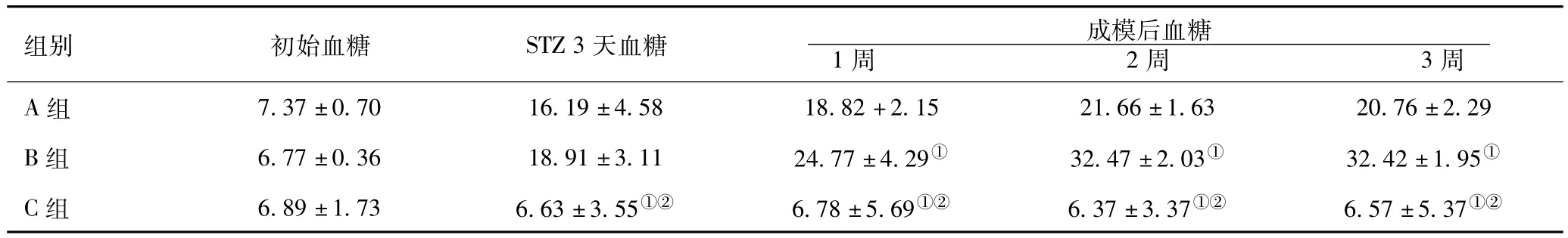
表2 各组小鼠血糖变化(x ± s,mmol/L)
2.3 实验动物血清免疫学指标测定:在糖尿病模型建立后3周,A组小鼠血清IL-4含量高于B组和C组,差异有统计学意义(P<0.05);B组小鼠血清IFN-γ含量高于A组和C组,差异有统计学意义(P<0.05)。

表3 小鼠血清中IL-2和IL-10 ELISA检测(x ± s,ng/ml)
2.4 实验动物胰腺组织的病理学变化:造模后3周,观察小鼠胰腺及胰岛组织的病理变化。B组小鼠胰岛可见大量淋巴细胞浸润,胰岛细胞数量减少,并可见胰岛结构被破坏;A组小鼠胰岛虽也见淋巴细胞浸润,但其结构大多保持完整,多为圆形或椭圆形的细胞团,数量多,均匀分布,分散于胰腺腺泡之间,胰岛界限清楚,未见胰岛内部有大量淋巴细胞浸润。C组小鼠胰岛未见淋巴细胞浸润。
3 讨论
糖尿病已经成为威胁我国人群健康的主要疾病之一[6]。其中,1型糖尿病,占糖尿病的10% ~20%,是一种病因尚待阐明的自身免疫疾病。患者多为青少年,发病时年龄不到20岁。1型糖尿病主要表现为胰岛β细胞明显减少,血中胰岛素含量明显降低,易发生酮血症甚至昏迷,治疗依赖胰岛素。1型糖尿病早期可见胰岛炎,胰岛内及其周围有大量淋巴细胞浸润。胰岛细胞逐渐被破坏、消失,进而导致胰岛变小,数目减少,甚至胰岛纤维化。研究证实,在1型糖尿病的发病过程中,Th1亚群主要介导致病性的免疫反应,而Th2亚群主要介导保护性的免疫反应。
多次低剂量STZ(MLD-STZ)注射诱导的小鼠糖尿病模型最早是在1976年建立的[7-8]。在实验中发现给易感小鼠小剂量连续5次腹腔注射STZ能激活小鼠体内淋巴细胞,在1周后即可产生与人类1型糖尿病完全相似的伴有胰岛炎性反应的病理改变,导致胰岛β细胞大量的破坏以及糖尿病的发生。β细胞损伤的同时伴有明显的胰岛炎发生表明STZ的致糖尿病的作用可能是通过激发了免疫应答来介导的,自身免疫机制可能在诱导该模型中起到重要的作用[8]。因此,MLD-STZ方法诱导的模型可作为一种很好的1型糖尿病的研究模型。
Rigano等研究发现用B抗原刺激后[9],患者的外周血单核细胞分泌IL-4及IL-13,而非IL-12,可见B抗原可使外周血单个核细胞产生Th1/Th2细胞因子比值改变,使宿主的免疫倾向于病理免疫相关的Th2反应,在进展期的病例中更为明显,说明在早期的免疫应答过程中,虫体可通过分泌B抗原抑制多型核细胞的趋化来逃避宿主的免疫攻击。因此,可认为细粒棘球蚴病,作为一种寄生虫病,对人体亦有有利的一面。寄生虫感染通过调节免疫可改变某些自身免疫性疾病的免疫反应形式,某种程度上可起到治疗的作用。那么是否能利用细粒棘球蚴B抗原的免疫偏移机制来调节1型糖尿病体内的Th1/Th2反应之间的失衡,有待探讨。
本实验显示,各组小鼠在给予STZ连续腹腔内注射后血糖水平均升高,但肌内注射生理盐水组血糖水平,与肌内注射细粒棘球蚴抗原B组相比,上升更明显,组间差异有统计学意义,提示细粒棘球蚴抗原B组血糖上升缓慢,表明细粒棘球蚴抗原B对小鼠糖尿病早期具有拮抗作用。监测小鼠体重发现,各注射药物组体重在成模前、成模后1周及成模后2周无明显变化,差异无统计学意义。在第3周时,肌内注射细粒棘球蚴抗原B组小鼠重于生理盐水组,差异有统计学意义,表明细粒棘球蚴抗原B对糖尿病小鼠体重有保护作用。国内外多项研究显示[10-12],曼氏或日本血吸虫感染无论对MLD-STZ诱导的1型糖尿病模型还是非肥胖性糖尿病(NOD)小鼠均具有很好的拮抗和保护作用。在本研究中,注射生理盐水的糖尿病模型组可见较多的胰岛有淋巴细胞浸润,而在细粒棘球蚴抗原B组少数胰岛可见淋巴细胞浸润。胰岛炎是自身免疫性1型糖尿病小鼠最明显的病理损伤,胰岛炎的减轻在一定程度上反映了免疫反应受到抑制。根据上述结果,可认为细粒棘球蚴抗原B对小鼠实验性自身免疫性1型糖尿病具有明显的保护作用和拮抗作用。
本研究结果显示,在细粒棘球蚴抗原B组,由于Th2细胞分泌的IL-4水平显著升高,拮抗Th1细胞释放的致炎性细胞因子IFN-γ等的作用,减轻了胰岛炎性损害,胰岛细胞得到保护。而在糖尿病模型对照组,由于浸润的Th1细胞释放的致炎性细胞因子的作用,分泌胰岛素的胰岛β细胞被大量破坏,最终发展为糖尿病。
1型糖尿病发病机理复杂,Th1、Th2免疫调节只是其中的一个环节,尚有更多的未知因素有待进一步了解。而包虫病作为新疆地区的多发病和特色病,因此研究细粒棘球蚴抗原B对1型糖尿病的保护作用以及机理,不仅在1型糖尿病的防治上具有重要意义,而且可以为利用细粒棘球蚴B抗原对1型糖尿病进行免疫调节治疗提供新的理论基础。
[1] Roep BO,De Vries RR.T - lymphocytes and the pathogenesis of type 1(insulin dependent)diabetes mellitus[J].Eur J Clin Invest,1992,22(11):697.
[2] Piccoli L,Meroni V,Genco F,et al.Serum cytokine profile by ELISA in patients with echinococcal cysts of the liver:a stagespecific approach to assess their biological activity[J].Clin Dev Immunol,2012,2012:1.
[3] Mejri N,Müller J,Gottstein B.Intraperitoneal murine Echinococcus multilocularis infection induces differentiation of TGF-β - expressing DCs that remain immature[J].Parasite Immunol,2011,33(9):471.
[4] Vuitton DA,Gottstein B.Echinococcus multilocularis and its intermediate host:a model of parasite - host interplay[J].J Biomed Biotechnol,2010,2010:923193.
[5] 裴剑浩,周智广,罗建华,等.吡格列酮对非肥胖性糖尿病小鼠糖尿病的预防作用及机理探讨[J].中华医学杂志,2004,84(5):411.
[6] 马红娥.32例糖尿病患者采用不同方法治疗的效果对比分析[J]. 吉林医学,2011,32(29):6104.
[7] Like AA,Rossini AA.Streptozotocin - induced pancreatic insulitis:new model of diabetes mellitus[J].Science,1976,193(4251):415.
[8] Like AA,Appel M C,Williams RM.Streptozotocin - induced pancreatic insulitis in mice.Morphologic and physiologic studies[J].Lab Invest,1978,38(4):470.
[9] Rigano R,Buttari B,Profumo E,et al.Echinococcus granulosus antigen B impairs human dendritic cell differentiation and polarizes immature dendritic cell maturation towards a Th2 cell response[J].Infec Immun,2007,75(4):1667.
[10] EI- Wakil HS,Aboushousha TS,EI Haddad O,et al.Effect of schistosoma mansoni egg deposition on multiple low doses streptozotocin induced insulin dependent diabetes[J].J E-gypt Soc Parasitol,2002,32(3):987.
[11] Cooke A,Tonks P,Jones FM,et al.Infection with Schistosoma mansoni prevents insulin dependent diabetes mellitus in non- obese diabetic mice[J].Parasite Immunol,1999,21(4):169.
[12] 邹玖明,刘文琪,雷家慧,等.慢性日本血吸虫感染对小鼠实验性1型糖尿病的影响[J].中国病原生物学杂志,2006,1(3):186.
