高效光合细菌菌剂对番茄品质、土壤肥力及微生物特性的影响
2014-09-10杨芳田俊岭杨盼盼冯宏贺广生陈旭东卢钰升谭志远彭桂香
杨芳,田俊岭,杨盼盼,冯宏,贺广生,陈旭东,卢钰升,谭志远,彭桂香
(1广东省微生物信号与作物病害防控重点实验室/华南农业大学资源环境学院,广东广州, 510642; 2中国烟草总公司广东省公司,广东广州 510610;3华南农业大学农学院,广东广州 510642)
高效光合细菌菌剂对番茄品质、土壤肥力及微生物特性的影响
杨芳1,田俊岭1,杨盼盼1,冯宏1,贺广生2,陈旭东1,卢钰升3,谭志远3,彭桂香1
(1广东省微生物信号与作物病害防控重点实验室/华南农业大学资源环境学院,广东广州, 510642; 2中国烟草总公司广东省公司,广东广州 510610;3华南农业大学农学院,广东广州 510642)
【目的】为了验证高效光合细菌菌剂对番茄品质的使用效果和对土壤肥力的影响.【方法】试验设3个处理和1个对照,3个重复,共12个小区随机排列,分析了在大田条件下,施用高效光合细菌菌剂对番茄品质、土壤肥力及微生物学特性的影响.【结果和结论】施入高效光合细菌菌剂能够显著增加番茄株高、地径、植株鲜质量和干质量,提高番茄抗坏血酸和番茄红素的含量,但对可溶性糖的含量无显著影响;高效光合细菌菌剂的施用能够有效调节土壤pH,使土壤pH趋于中性;土壤有机质和速效钾含量显著降低,速效磷含量显著提高,对碱解氮无显著影响;高效光合细菌菌剂的施用可以提高土壤基础呼吸强度,显著提高土壤中细菌和放线菌的数量,降低土壤中真菌数量.高效光合细菌菌剂可以作为一种环境友好肥料应用于作物生产和土壤培肥.
光合细菌菌剂;番茄品质;土壤肥力;土壤微生物
番茄Lycopersicon esculentumMill.果实富含Va、Vb、抗坏血酸和无机盐类,不但可直接食用还是重要的加工原料,是我国栽培面积最大的蔬菜之一[1].近年来,由于化学肥料和化学农药的大量不合理施用,不仅耗费了大量不可再生的资源,而且破坏了土壤结构,污染了环境,影响了人类的健康生存.微生物自身含有一定的C、N、P和S,并参与土壤C、N、P和S等元素的循环过程和土壤矿物的矿化过程,常被用于评价土壤的生物学特性[2-3].因此,土壤微生物在土壤肥力和农业生产上的重要性逐渐凸显,无公害生物肥料必将会在未来农业生产中发挥重要作用[4-5].光合细菌(Photosynthetic bacteria,PSB)是一类能进行光合作用而不产氧的特殊生理类群的原核生物的总称,广泛存在于自然界的水田、湖泊、江河、海洋、活性污泥及土壤中[6-7].光合细菌是细菌中特殊的生理类群,能够合成糖类、氨基酸类、维生素类及其他生物活性物质[8],具有固氮、固碳及氧化分解硫化物和胺类物质等多种有毒物质的生理生态特性[9-11].已有研究结果表明,光合细菌可促进蔬菜幼苗的发育[12],提高蔬菜的产量和抗病能力[13-14],改善番茄、黄瓜和辣椒等的品质[15].光合细菌菌剂(简称:光合菌剂)对土壤肥力及土壤微生物学特性的研究还相对滞后,制约了对光合菌剂的推广.本试验检测了光合菌剂对番茄品质的影响,并分析了光合菌剂对土壤肥力及微生物学特性的影响.
1 材料与方法
1.1 材料
番茄种子(金褔,以色列硬果番茄F1,无限生长类型)由广东省农业科学院蔬菜研究所提供,光合细菌(胶状红长命菌Rubrivivax gelatinosus)菌剂由华南农业大学农学院分子遗传实验室提供.本试验在华南农业大学农场进行,土壤常规指标:pH 8.53,有机质6.029 g·kg-1,碱解氮18.592 mg·kg-1,全氮0.411 g·kg-1,速效磷8.486 mg·kg-1,全磷0.417 g·kg-1,速效钾22.340 mg·kg-1,全钾22.316 g·kg-1.
光合细菌培养基:KH2PO41.8 g,K2HPO42.7 g,(NH4)2SO43.96 g,MgSO4·7H2O 0.6 g,CaCl2·H2O 0.225 g,EDTANa 2 0.06 g,FeSO4·7H2O 0.011 8 g,乙酸钠4.92 g,酵母粉3 g,微量元素溶液3 mL (H3BO30.28 g、Na2MoO40.075 g、CuSO40.004 g、MnSO40.21 g、ZnSO40.024 g),水1 000 mL,pH为7.2±0.2,培养温度为28℃.
1.2 试验设计
大田番茄试验设3个处理和1个对照,3个重复,共12个小区.随机排列,每个小区的面积为6 m2(5.0 m×1.2 m),每个小区种植30株番茄,土壤取样为一般土.3个处理分别为:菌液+化肥(T1),灭菌菌液+化肥(T2),化肥(T3);对照(CK)为清水.灭菌菌液采用湿热灭菌法制得,每次施肥前菌液和灭菌液用清水稀释至D600nm约为0.2,每株施入稀释后的光合菌剂10 mL.2011年7月10日育苗,8月12日移栽,12月16日拉秧.移栽10、25、40、55、70 d后各施肥1次,除CK外,每个小区施尿素90 g、过磷酸钙45 g、氯化钾45 g.
1.3 测定方法
土壤理化性质分析参照《土壤农化分析》[16];收获期分别测定株高、地径;盛果期测定番茄植株叶片的叶绿素含量、番茄果实的可溶性糖、可滴定酸、可溶性固形物、番茄红素、抗坏血酸含量.株高用卷尺测量;地径用游标卡尺测量;可溶性糖测定采用硫酸蒽酮比色法[17];可滴定酸测定采用氢氧化钠滴定法[18];番茄红素测定采用分光光度法(UV-1201)[19];抗坏血酸测定采用2,6-二氯靛酚钠盐滴定法[20];叶绿素测定采用分光光度法[21].
采用稀释涂平板法测定土壤中细菌、真菌、放线菌数量.细菌采用牛肉膏蛋白胨培养基,于25~28℃培养5 d;放线菌采用改良高氏一号培养基,于25~28℃培养7 d;真菌采用孟加拉红培养基,于25~28℃培养3 d.番茄生长期每隔15 d(每次施肥后5 d)采土样1次,采样深度为0~20 cm.
1.4 数据分析
用SAS V8软件对数据进行处理,采用Duncan’s法对数据进行差异显著性分析.
2 结果与分析
2.1 不同处理对番茄植株生物指标的影响
植物的株高、地径、鲜质量和干质量是反映植株生长势的重要指标,叶绿素含量的高低是反映叶片生理活性变化的重要指标之一[22].表1显示,T1(菌液+化肥)处理植株株高、地径、鲜质量、干质量均显著高于T2(灭菌菌液+化肥)、T3(化肥)和清水对照(CK)处理;T2处理植株株高、鲜质量、干质量与T3处理相比均无显著差异,但T2处理地径显著高于T3处理; T2、T3处理植株株高、地径、鲜质量和干质量均显著高于清水对照(CK),说明菌液+化肥处理能显著提高番茄植株生物量.在盛果期测叶片叶绿素的含量,由测定结果可知:T1处理植株叶片中叶绿素的含量显著高于T2和T3处理,但T2和T3处理无显著差异,说明菌液+化肥处理可有效促进番茄植株叶片的光合作用.
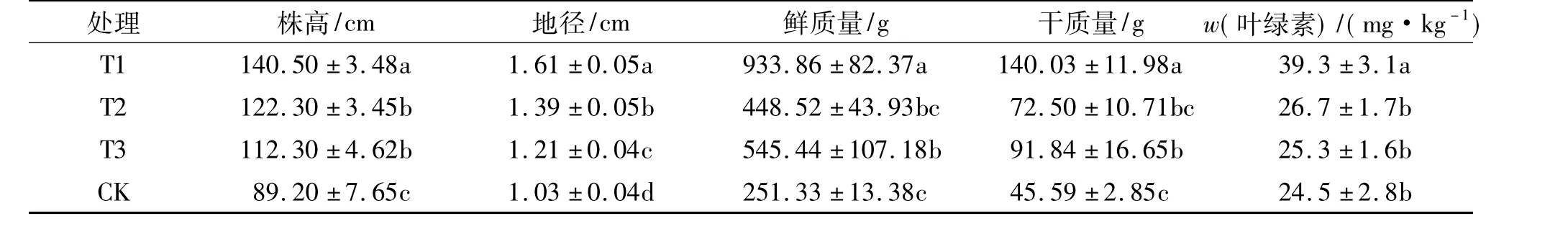
表1 不同处理番茄植株的生物量指标1)Tab.1 Biomass indexes of tomato plant of different treatments
2.2 不同处理对番茄品质的影响
随着生活水平的提高,人们对蔬菜的要求已经从单纯的追求高产转变为保证产量的同时提高蔬菜的营养价值.可溶性糖、可滴定酸、可溶性固形物、抗坏血酸和番茄红素等都是反映番茄品质的重要指标.由表2可知:CK可溶性糖含量显著低于T1、T2和T3处理,T1、T2和T3处理之间无显著差异;T1、T2处理中番茄果实可滴定酸的含量显著高于T3、CK,T1、T2处理之间无显著差异,T3、CK之间无显著差异;T1、T2、T3处理番茄果实可溶性固形物的含量没有显著性差异但都显著高于CK;T1、T2处理番茄果实抗坏血酸含量显著高于清水对照(CK),且T1处理番茄果实抗坏血酸含量显著高于T2处理;T1、T2、T3处理番茄果实番茄红素含量显著高于CK,且T1处理番茄果实番茄红素含量显著高于T2、T3处理.综上可知:与CK相比,T1处理番茄可滴定酸、可溶性固形物、抗坏血酸、番茄红素含量都有显著提高.说明菌液+化肥处理能够提高番茄果实的品质.
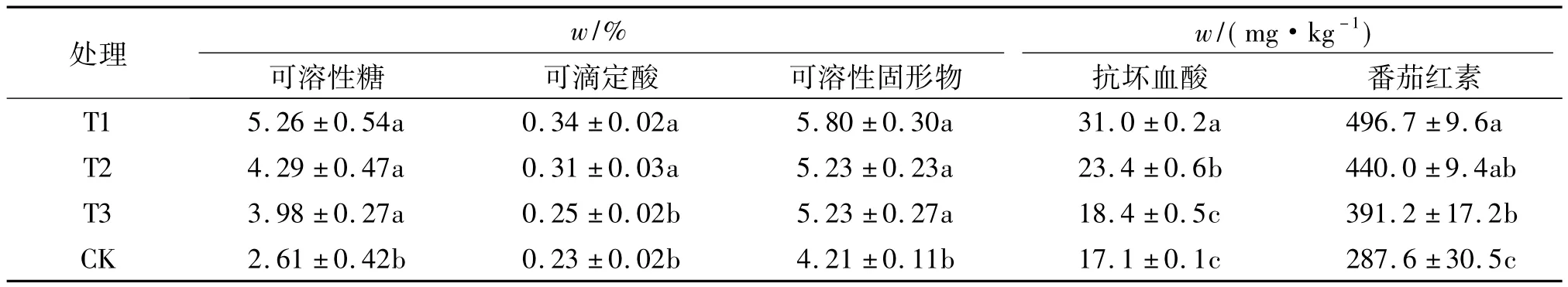
表2 不同肥料处理对番茄品质的影响1)Tab.2 Effects of different fertilizers on tomato quality
2.3 不同处理对土壤肥力的影响
由表3可知:T1处理土壤pH低于T2、T3、CK,T3和CK土壤pH非常接近,说明菌液+化肥和灭菌菌液+化肥这2个处理均能够降低土壤的pH,使其趋近于中性,但菌液+化肥处理效果更显著,菌液中光合细菌的代谢产物是影响土壤pH的主要因素.T1处理土壤有机质含量显著低于T2、T3、CK,其原因可能是试验前土壤中有机质匮乏而光合细菌的繁殖活动又消耗了土壤中部分有机质;也可能是T1处理番茄植株的生物量显著高于其余各处理,使得土壤中有机质的消耗量也高于其余各处理.T1、T2、T3处理土壤碱解氮含量高于CK,T1、T2、T3处理间无显著性差异,说明菌液+化肥处理对土壤中碱解氮的含量并没有显著的影响.T1、T2处理土壤速效磷的含量无显著差异,但均显著高于T3、CK,说明菌液+化肥、灭菌菌液+化肥处理能够增加土壤中速效磷的含量,可能是因为光合细菌培养液可以活化土壤中的磷元素.T1处理土壤中速效钾的含量显著低于T2、T3、CK,可能是番茄的生长需要大量的钾肥,菌液+化肥处理的番茄植株生物量显著高于其余各处理,本试验土壤比较贫瘠,使得番茄植株拉秧后土壤中速效钾的含量明显降低;也可能是菌液中的光合细菌能够促进植物对土壤中速效钾的利用.综上所述:光合细菌能够改善土壤的酸碱性.由于本试验土壤比较贫瘠,土壤中碱解氮、速效磷、速效钾含量变化可能与番茄植株的生物量有关,但并不能确定,需要进一步的研究.

表3 不同肥料处理对土壤肥力的影响1)Tab.3 Effects of different fertilizers on soil fertility
2.4 不同处理对土壤微生物特性的影响
土壤基础呼吸是表征土壤质量和肥力的重要生物学指标[23],它在一定程度上反映了微生物的整体活性[24].从图1可以看出,不同处理土壤基础呼吸强度在整个生长期的变化趋势相同,在番茄植株定植15 d后,T3处理土壤基础呼吸强度最低,说明单施化肥处理对土壤中微生物的代谢活动产生抑制作用.定植45 d后,T1处理土壤基础呼吸强度最高,可能是因为菌液中的光合细菌在土壤中经过一段时间的适应,大量地繁殖生长或激活土壤中土著微生物的代谢繁殖.定植60 d后,CK土壤基础呼吸强度最高,可能是因为CK土壤受外来刺激较少,土壤环境比较稳定.
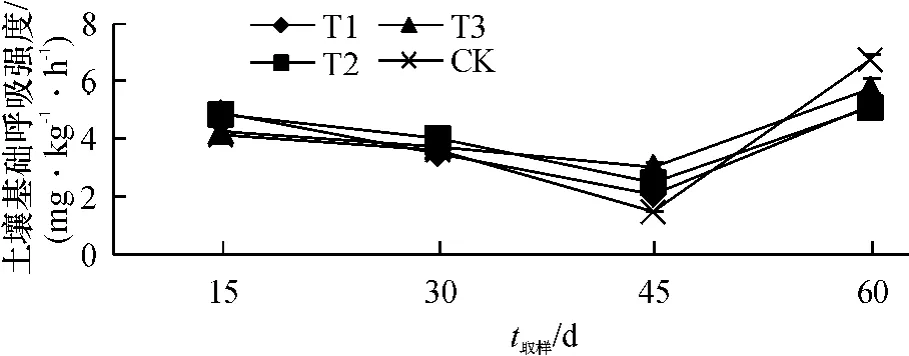
图1 高效光合菌剂对土壤基础呼吸的影响Fig.1 Effect of photosynthetic bacterial inoculant on soil basal respiration
从图2可以看出,在大田试验的各时期,T1处理土壤中细菌数量在植株定植15 d后显著高于CK,在定植30和45 d后T1处理土壤中细菌数量与CK无显著差异,在定植60 d后T1处理土壤中细菌数量显著高于CK,说明菌液中的光合细菌在土壤中经过一段时间,能够适应土壤环境并进行良好的生长繁殖,也有可能是菌液中光合细菌促进了土壤中其他细菌数量的增加.T3处理在植株定植30 d后,土壤中细菌数量显著低于CK,在定植60 d后,土壤中细菌数量显著低于T1处理,说明单施化肥处理对土壤中细菌数量有一定的抑制作用.
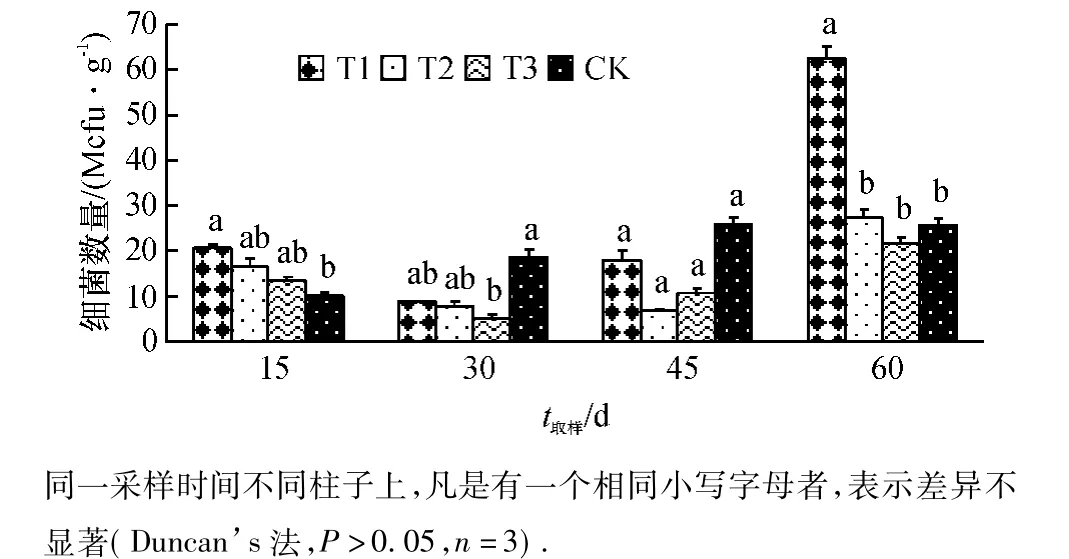
图2 高效光合菌剂对土壤细菌数量的影响Fig.2 Effect of photosynthetic bacterial inoculant on the number of bacteria in the soil
从图3可以看出,不同施肥处理土壤中T1处理土壤中真菌数量在植株定植15和30 d后与T2处理没有显著性差异,但显著高于T3和CK;在定植45 d后,T1处理土壤中真菌数量显著高于T2、T3和CK;在定植60 d后,T1处理土壤中真菌数量与T3和CK没有显著差异,但显著低于T2处理,说明菌液中的光合细菌经过一段时间的适应期后能够有效抑制土壤中真菌的数量.T2处理在番茄植株定植15 d后土壤中真菌数量显著高于T3处理,与CK没有显著差异;在定植30、45和60 d后,T2处理土壤中真菌数量与T3、CK均无显著性差异且数量稳定,说明真菌不易受外界环境变化的影响,这与胡宇等[25]的研究结果相似.
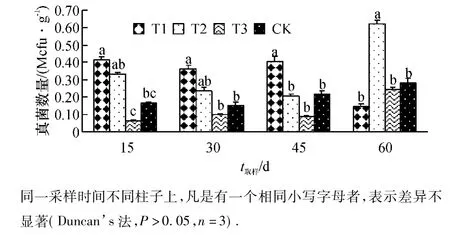
图3 高效光合菌剂对土壤真菌数量的影响Fig.3 Effect of photosynthetic bacterial inoculant on the number of fungi in the soil
从图4可以看出,不同施肥处理土壤中T1处理土壤中放线菌数量在植株定植15 d后显著低于T2处理,与T3、CK无显著差异;在定植30、45和60 d后,T1处理土壤中放线菌数量与T2、T3和CK均无显著性差异,说明高效光合菌剂对土壤中放线菌的含量无显著性影响.
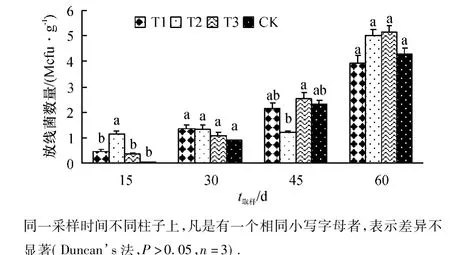
图4 高效光合菌剂对土壤放线菌数量的影响Fig.4 Effect of photosynthetic bacterial inoculant on the number of actinomyces in the soil
3 讨论与结论
光合细菌的代谢产物营养丰富,富含各种B族维生素、促生长因子、辅酶Q和抗病毒因子等生理活性物质,能激活蔬菜细胞的活性,提高光合作用能力[15,26].前人研究结果指出,有益微生物能促进植物营养的吸收[27],增强植株的生长势[28].叶绿素含量是衡量叶片衰老的关键指标,且与植株N、P和K水平密切相关[29],光合菌剂能够提高番茄叶片中叶绿素和果实可溶性固形物含量[30];与对照相比光合菌剂使黄瓜可溶性糖和抗坏血酸的含量分别提高了126.5%和138.85%[31].本试验结果显示,高效光合菌剂的施入使番茄植株的株高、地径、鲜质量、干质量和叶片中叶绿素的含量显著高于灭菌菌液+化肥、化肥和清水对照处理;对番茄果实中抗坏血酸和番茄红素含量也有显著地提高作用,这与前人的研究结果[31]一致.高效光合菌剂对番茄果实可溶性糖和可溶性固形物的含量有提高但效果不显著,这一结果与前人的研究结果[30-31]不一致,有待进一步研究.
微生物肥料可以改善土壤环境,提高土壤肥力[32-33],光合菌剂降低土壤酸碱度,提高土壤速效磷的含量[34].番茄需钾量很大,是需氮量的1.5~2.0倍[35].本试验结果显示,高效光合菌剂明显降低了土壤pH使其趋于中性,提高了速效磷的含量,速效钾的含量在番茄拉秧后最低,这与前人的研究结果[35]一致.施用高效光合菌剂的土壤中有机质的含量在番茄拉秧后最低,碱解氮含量无显著差异.这与前人的研究结果[32-33]不一致,可能是因为试验地土壤肥力贫瘠,而高效光合菌剂中的光合细菌又加快了土壤中有机质的分解;高效光合菌剂处理的番茄植株生物量显著高于其余各处理,那么植株从土壤中吸收的氮素也相应的增加,4个处理土壤中碱解氮的含量无显著差异,说明高效光合菌剂中光合细菌能促进土壤中碱解氮的含量.由于大田试验受外部复杂环境的影响较大,今后准备继续进行高效光合菌剂效果的试验,探索其应用方法,如施入量及施入时间等,为其合理开发与应用提供科学依据[36].
土壤微生物是土壤生态系统的重要组成部分[37-38],在土壤物质和能量的转化中起重要作用.土壤-作物系统与土壤微生物之间存在相互作用、互为条件的关系[33-39].已有研究表明,光合细菌显著提高土壤中细菌、放线菌数量,抑制真菌的数量[40].本试验结果显示,高效光合菌剂可以提高土壤基础呼吸强度,显著提高土壤中细菌、放线菌的总量,抑制真菌的数量,为作物提供健康的生活环境.
[1]徐立功.生物有机肥对番茄生长发育及产量品质的影响[D].泰安:山东农业大学,2006.
[2]FRANKENBERGER W T,DICK W A.Relationships between enzyme activities and microbial growth and activity indices in soil frankenberger[J].Soil Sci Soc Am J.1983,47(5):945-951.
[3]DORAN J W,COLEMAN D C,BEZDICEK D F,et al.Defining soil quality for a sustainable environment[M].[S.l.]:SSSA Special Publication,1994:3.
[4]王彦飞,曹国璠.不同生物肥料对辣椒产量和品质的影响研究[J],北方园艺,2010(17):13-15.
[5]LYNETTE K A.Soil biological fertility:A key to sustain-able land use in agriculture[M].Boston:Kluwer Academic Publishers,2003.
[6]揭晶,赵越.光合细菌应用的研究进展[J],广东药学院学报,2006,22(1):113-115.
[7]WU J,BAUER C E.RegB/RegA:A global redox-responding two-component system[J].Adv Exp Med Biol,2008 (631):131-148.
[8]PFENNING N.General physiology and ecology of photosynthetic bacteria in the photosynthetic bacteria[M].New York:Plenum Press,1978.
[9]王秋菊,崔战利.光合细菌在番茄上的应用研究[J].黑龙江八一农垦大学学报,2005,17(6):13-17.
[10]周茂洪,邹邻邻,陈再廖.水稻根系血色红假单胞菌的分离及生理生态特性研究[J].浙江农业学报,2002,14(1):30-35.
[11]杨官娥,张肇铭.光合细菌转化槲寄生制剂抗肿瘤活性初步研究[J].微生物学通报,2006,33(2):40-43.
[12]张德咏,刘勇.光合细菌PSB-1对几种蔬菜种子发芽及成苗的作用[J].湖南农业科学,2001(1):31-32.
[13]郭旭耀,赵彩霞.光合细菌对水培番茄生长性状影响的研究[J].山西农业科学,2007,35(8):38-41.
[14]徐燕,王辉,赵春燕,等.光合微生态菌剂对种子萌芽及幼苗生长的影响[J].微生物学杂志,2006(3):111-112.
[15]谷军,杨旭.光合细菌菌肥在番茄、黄瓜上的应用[J].安徽农业科学,2002,30(4):592-593.
[16]鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,1981.
[17]魏晓明,符红,万幼平.硫酸蒽酮比色法测定鹿龟酒中多糖的含量[J].中成药,2000(5):62-64.
[18]韩冬芳,马书尚,王鹰,等.1-MCP对新红星苹果乙烯代谢和贮藏品质的影响[J].园艺学报,2003,30(1):11-14.
[19]胡晓波,俞方圆,刘建兵,等.番茄红素含量测定[J].食品科学,2005,26(9):566-569.
[20]白宝璋,王景安,孙玉霞,等.植物生理学测试技术[M].北京:中国科学技术出版社,1993.
[21]郑炳松.现代植物生理生化研究技术[M].北京:气象出版社,2006.
[22]郑光华.植物栽培生理[M].济南:山东科学技术出版社,1980.
[23]杨晶,李凌浩.土壤呼吸及其测定法[J].植物杂志,2003(5):36-37.
[24]朱海平,姚槐应,张勇勇,等.不同培肥管理措施对土壤微生物生态特征的影响[J].土壤通报,2003,34 (2):140-142.
[25]胡宇,蒋先军,田波,等.稻田垄作免耕对土壤真菌多样性分布的影响[J].土壤,2007,39(6):964-967.
[26]ZHAO Zhiping,HU Zonglin,NIE X,et al.A novel rhodobacter sphaeroides expression system for real-time evaluation of heterologous protein expression leves[J].Protein Pept Lett,2011,18(6):568-572.
[27]YAN Peisheng,XU Huilian.Influence of EM Bokashi on nodulation,physiological characters and yield of peanut in nature farming fields[J].J Sustain Agr,2002,19(1):105-112.
[28]谢晚彬.生物菌肥在番茄种植中的应用研究[J].湖北农业科学,2011,50(11):2198-2199.
[29]MOCHIZUKI T,NOGUCHI Y,SONE K,et al.Aroma components of amphiploid strawberries derived from interspecific hybrids ofFragaria×Ananassaand diploid wild species[C]∥VAN DER SCHEER H A TH,LIETEN F,DIJKSTRA J.ⅢInternational Strawberry Symposium.Veldhoven,Netherlands:International Society for Horticultral Science,1997:75-80.
[30]夏宏,夏青,许建香.光合细菌及复配剂在番茄上的应用研究[J].山西农业科学,1999,27(4):47-49.
[31]赵贞,杨延杰,林多,等.微生物菌肥对日光温室黄瓜生长发育及产量品质的影响[J].中国蔬菜,2012 (18):149-153.
[32]BAJWA R,JAVAID A,RABBANI N.EM and VAM technology in Pakistan:VII:Effect of organic amendments and effective microorganisms(EM)on VA mycorrhiza,nodulation and crop growth inTrifolium alexandrinumL.[J].Pak J Biol Sci,1999,2(2):590-593.
[33]王超,吴凡,刘训理,等.不同肥力条件下烟草根际微生物的初步研究[J].中国烟草科学,2005,26(2):12-14.
[34]曹恩珲,侯宪文,李广义,等.复合菌剂对盆栽番茄土壤理化性质及微生物活性的影响[J].生态环境学报,2011,20(5):875-880.
[35]唐玉霞,孟春香.不同钾肥品种对番茄产量和品质的影响[J].土壤肥料,1996(3):46-47.
[36]谷军,杨旭,堀内勲.光合细菌菌肥在蔬菜种植上的应用[J].黑龙江农业科学,2002(6):4-6.
[37]陈文新,胡正嘉.土壤和环境微生物学[M].2版.北京:北京农业大学出版社,1990.
[38]骆世明,彭少麟.农业生态系统分析[M].广州:广东科学技术出版社,1997.
[39]贾志红,孙敏,杨珍平,等.施肥对作物根际微生物的影响[J].作物学报,2004,30(5):491-495.
[40]张信娣,史永军,陈银科.光合细菌和有机肥对土壤主要微生物类群的影响[J].中国土壤与肥料,2007 (3):59-62.
【责任编辑周志红】
Effects of inoculant of photosynthetic bacteria on tomato quality,soil fertility and soil microbial characteristics
YANG Fang1,TIAN Junling1,YANG Panpan1,FENG Hong1,HE Guangsheng2,CHEN Xudong1,LU Yusheng3,TAN Zhiyuan3,PENG Guixiang1
(1 Guangdong Province Key Laboratory of Microbial Signals and Disease Control/College of Natural Resources and Environment,South China Agricultural University,Guangzhou 510642,China; 2 Branch of Guangdong,China National Tobacco Corporation,Guangzhou 510610,China; 3 College of Agriculture,South China Agricultural University,Guangzhou 510642,China)
【Objective】To verify the effect of high efficient photosynthetic bacterial inoculant on tomato quality and effects on soil fertility.【Method】Three treatments and one control,three repeats,a total of 12 random field trials were designed.Effects of photosynthetic bacterial inoculant on tomato quality,soil fertility and soil microbial characteristics were studied by field trial.【Result and conclusion】The results showed that significant increases were observed in the height and diameter,the fresh mass and dry mass of tomato plant,the content of chlorophyll,lycopene and vitamin C,but there were no remarkable effects on sugar of tomato fruit with photosynthetic bacterial inoculant.Photosynthetic bacterial inoculant reduced pH of soil tending to be neutral.Available potassium in the soil significantly reduced,while availablephosphorus significantly increased.There were only slight effects on organic matter and available nitrogen in the soil.Photosynthetic bacterial inoculant could strengthen soil basal respiration and affect the number of the main microorganisms in the soil,which was presented by the number of fungi in the soil,while the number of bacteria and actinomyces in the soil increased evidently.As an environmental-friendly fertilizer,this study confirms the promise of photosynthetic bacterial inoculants on crop production and soil fertilization.
inoculant of photosynthetic bacteria;tomato quality;soil fertility;soil microbe
S154.36
A
1001-411X(2014)01-0049-06
杨芳,田俊岭,杨盼盼,等.高效光合细菌菌剂对番茄品质、土壤肥力及微生物特性的影响[J].华南农业大学学报,2014,35(1):49-54.
2013-02-21优先出版时间:2013-11-07
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20131107.1501.009.html
杨芳(1985—),女,硕士研究生,E-mail:yangfang850212@126.com;通信作者:彭桂香(1968—),女,副教授,博士,E-mail:gxpeng@scau.edu.cn
“973”计划项目(2010CB126502);农业部南方植物营养与肥料重点实验室和广东省养分资源循环利用与耕地保育重点实验室开放基金资助项目(TFS2011-04);广东省科技计划项目(2010B060200017,2010B090400450);广东省烟草专卖局资助项目(粤烟科[2012]26号)
