响应面曲线法优化超声辅助茶多酚提取工艺研究
2014-09-10陶阿丽余大群
陶阿丽,余大群
(安徽新华学院药学院,安徽 合肥 230088)
响应面方法 ( Response Surface Methodology,RSM )是利用合理的试验设计并通过实验得到的一定数据,采用多元二次回归方程来拟合因素与响应值之间的函数关系,通过对回归方程的分析来寻求最优工艺参数,解决多变量问题的一种统计方法。 随着计算机技术的发展,它已成为精度高、应用广并具有实用价值的优化技术[1]。采用响应面法优化工艺过程主要涉及3步:试验设计——建立数学模型评估相关性——预测响应值考察模型的准确性[2]。
茶多酚( Tea Polyphenol,TP) 是茶叶中的有效成分,又名茶单宁、茶鞣质,茶多酚由约30 多种含酚基的物质组成,是茶叶中所含的多羟基酚类化合物的总称。现代医学研究发现,茶多酚抗氧化性能比维生素的抗氧化效价高1倍,而且无毒,因此是一种理想的食品天然抗氧化剂。茶多酚还具有抗癌治病、防衰老、抗辐射、消除人体自由基、降血糖、防治心血管疾病、抑菌抑酶、沉淀重金属等一系列特殊的药理功能[3-6]。
由于超声波辅助提取法操作简便、溶剂用量少,能够较大限度地保留提取组分的天然活性,利用其产生的空化、机械扰动等物理作用的原理,粉碎植物细胞壁使目标物大量的浸出,故本研究采用超声波技术辅助来提取茶多酚。同时,采用Design-Expert 7.1.6软件对这几个因素进行响应面优化,以进一步确定优化工艺。
1 材料与方法
1.1 材料、仪器与试剂
试验所用茶叶采用绿茶黄山毛峰;试剂茶多酚纯品、硫酸亚铁、酒石酸钾钠、磷酸氢二钠、磷酸二氢钾、乙酸乙酯、硫酸、氨水均为分析纯。
主要仪器有721E型紫外分光光度计、KQ118超声波清洗器、FA2004型电子天平、HH数显恒温水浴锅、SHZ-D循环水式真空泵、DHG-9023型电热恒温鼓风干燥箱、低速自动平衡离心机。
1.2 试验方法
1.2.1 茶叶的前处理
用研钵将茶叶碾碎,过60目筛备用。
1.2.2 超声法提取茶多酚的单因素试验
(1)提取时间对茶多酚提取率的影响 精密称取1.000g茶叶末于烧杯中,加入20ml沸水,分别采用超声提取10、20、30、40、50、60min,测定抽滤的滤液的光密度,计算茶多酚的提取率[7]。
(2)料液比对茶多酚提取率的影响 精密称取1.000g茶叶末于烧杯中,按照料液比(g/ml)1∶10、1∶15、1∶20、1∶25、1∶30、1∶35分别加入沸水,采用超声提取40min,测定抽滤的滤液的光密度,计算茶多酚的提取率。
(3)提取次数对茶多酚提取率的影响 精密称取1.000g茶叶末于烧杯中,加入30ml沸水,采用超声提取40min,按上述方法反复提取5次,测定抽滤的滤液的光密度,计算茶多酚的提取率。
1.2.3 响应面曲线优化试验
以茶多酚提取率为评价指标,通过单因素试验确定范围,应用Design-Expert 7.1.6软件,选取提取时间(A)、料液比(B)、提取次数(C)为考察因素,各因素设置3水平。根据响应面试验结果,确定茶多酚最佳提取工艺条件。
1.3 茶多酚的纯化
沉淀茶多酚:准确移取一定量茶多酚粗提液,在一定酸度条件下加入适量钙盐,离心分离,即得茶多酚-钙盐沉淀[8]。
沉淀转溶:向茶多酚钙盐沉淀物中加入一定量的硫酸溶液,搅拌,并在一定温度下放置,使之溶解。
乙酸乙酯萃取:将转溶后得到的清液,用适量的乙酸乙酯进行萃取可进一步纯化茶多酚。最后在60℃真空干燥即得茶多酚成品。
1.4 茶多酚含量测定
采用酒石酸亚铁比色法[9]测定茶多酚的含量,具体操作如下。
(1)按照文献[10]的方法配制茶多酚标准溶液、酒石酸亚铁溶液以及pH7.5磷酸盐缓冲液。
(2)分别精密移取茶多酚标准溶液1.0、2.0、3.0、4.0、5.0ml于25ml容量瓶中,加水4ml与5ml酒石酸亚铁溶液充分混合,再加入pH7.5的缓冲溶液至刻度,用1cm比色皿,在波长540nm处,以试液空白溶液做参比溶液,测定光密度。以茶多酚浓度为横坐标x,光密度为纵坐标y,绘制出标准曲线。
(3)准确称取茶多酚提取液1ml,注入25ml容量瓶中,加水4ml,与5ml酒石酸亚铁溶液充分混合,再加入pH7.5的缓冲溶液至刻度,用1cm比色皿,在波长540nm处,以试液空白溶液做参比溶液,测定光密度,根据标准曲线计算茶多酚的提取率。
1.5 加样回收率测定
精密移取茶多酚标准溶液1.0、2.0、3.0ml分别于9只25ml容量瓶中,各加入精密吸取的样品溶液1.0ml,按照标准曲线制备过程操作,在540nm波长处测光密度值,计算加样回收率。
2 结果与分析
2.1 茶多酚的标准曲线

图1 茶多酚标准曲线
茶多酚标准曲线见图1,其回归方程为y=8.1575x+0.0383(R2=0.9990),可知茶多酚浓度与光密度呈良好线性关系。
2.2 提取时间对茶多酚提取率的影响
由图2可知,随着提取时间的增长,茶多酚的提取率发生先增后减的变化。在提取40min时茶多酚的提取率达到最高值,时间过长茶多酚提取率反而下降,可能是由于长时间超声提取导致茶多酚发生氧化所致[11]。
2.3 料液比对茶多酚提取率的影响
由图3可知,当料液比(g/ml)为1∶30时,茶多酚的提取率达到最高。

图2 不同提取时间下的茶多酚提取率图3 不同料液比下的茶多酚提取率

图4 不同提取次数下的茶多酚提取率
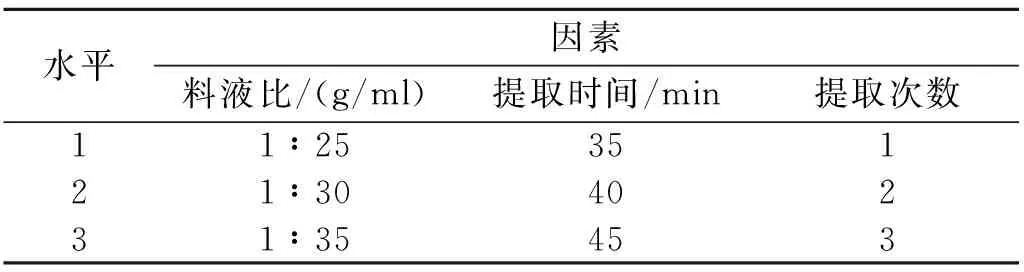
水平因素料液比/(g/ml)提取时间/min提取次数11∶2535121∶3040231∶35453

表2 响应面试验结果
2.4 提取次数对茶多酚提取率的影响
由图4可知,随着提取次数的增加,茶多酚的提取率先增后减。当提取次数为3次时,茶多酚的提取率达到峰值,因此最佳提取次数为3次。
2.5 茶多酚提取的最佳条件
根据单因素试验结果,选择提取条件为料液比(g/ml)1∶25、1∶30、1∶35,提取时间35、40、45min,提取次数1、2、3次,作为自变量设计响应面分析试验,以茶多酚提取率为响应值[12],因素和水平取值如表1。
根据 Box-Behnken的中心组合设计原理[13],设计了3因素 3水平共 17个实验点( 5个中心点,每个实验点重复 2 次) 的响应分析试验,试验结果见表2。
响应面分析方法的图形是特定的响应面对应的因素A、B、C构成的一个三维空间,可以直观反映各因素对响应值的影响,从试验所得的响应分析图上可以分析出它们之间的相互作用。从响应面分析图5、图6、图7中可以看出响应值与3个影响因素料液比、提取时间和提取次数的关系。
综合上述试验,采用Design-Expert 7.1.6软件对表2结果进行响应面回归分析,得拟合方程:
Y=18.98+0.82A+0.083B+3.70C-0.09AB-0.13AC+0.2BC-0.92A2-0.62B2-0.93C2,其中Y为提取率,A为料液比,B为提取时间,C为提取次数。回归方程显著性检验及方差分析结果见表3。

图5 料液比与提取时间响应图图6 料液比和提取次数响应图

图7 提取时间和提取次数响应图
由表3可知,模型P<0.05,回归方程具有显著性,由响应面分析法对茶多酚提取率的ANOVA分析结果可以得出,液料比(A)、提取次数(C)对茶多酚的提取率有显著影响,而提取时间(B)则无显著影响。对试验结果进一步分析得,最佳提取工艺条件为提取时间40.99min、料液比(g/ml)1∶31.84、提取次数为3次。在此条件下绿茶中茶多酚的提取率为21.91%。
2.6 加样回收率测定
将绿茶中提取液稀释后测定其光密度,并计算稀释后茶多酚的含量,结果见表4。
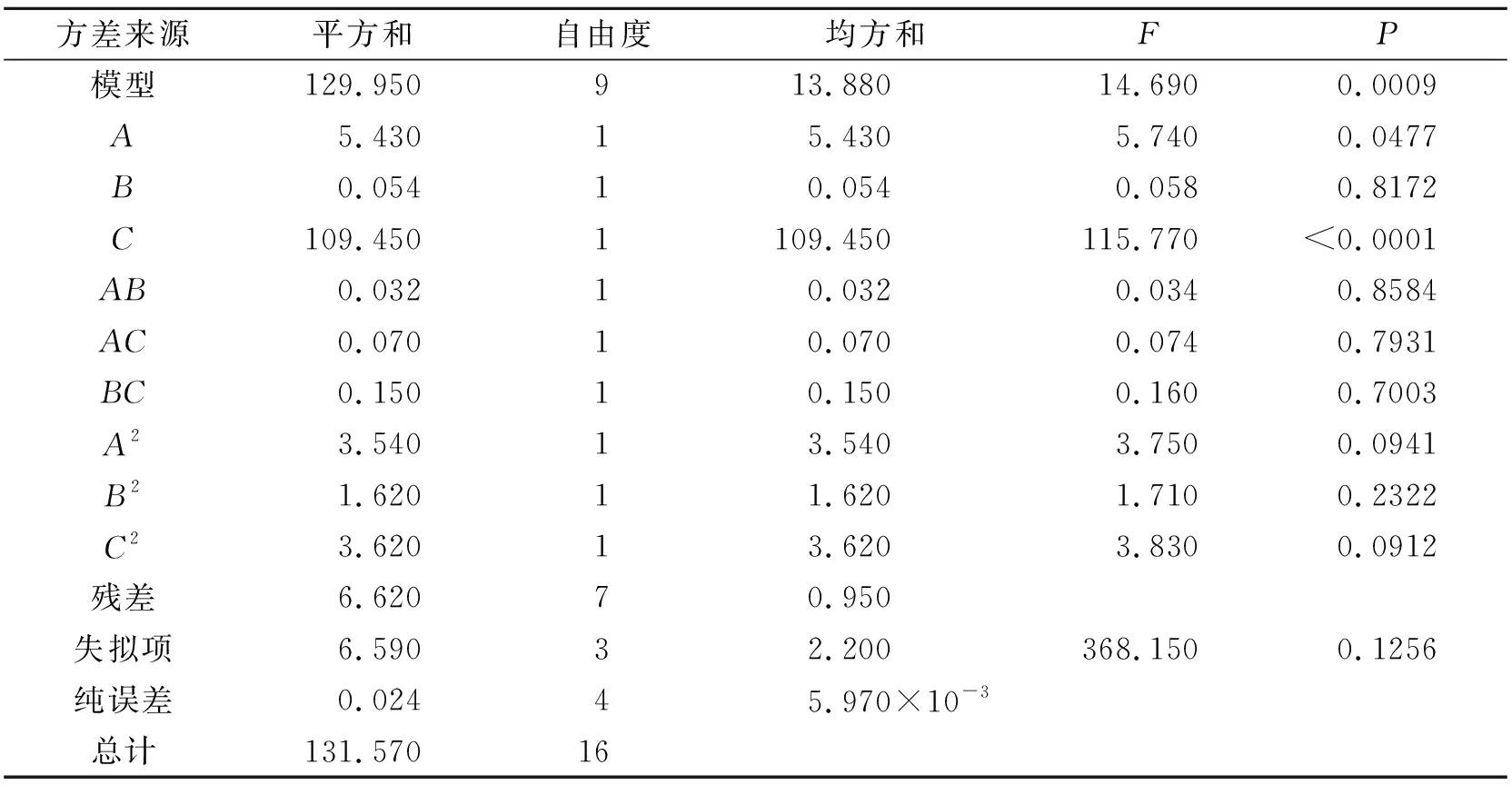
表3 响应面分析法对茶多酚提取率的ANOVA分析结果
表4 绿茶提取物中茶多酚的含量
以茶多酚纯品为标准,测定绿茶提取液中茶多酚的回收率,结果见表5。
加样回收率的RSD为0.59%,说明该工艺稳定,方法可靠[14]。
3 结论
本研究以水溶液做溶剂,超声辅助提取茶叶中的多酚类物质,在确定了最佳工艺条件后,根据单因素试验得出影响茶多酚提取率的各因素的范围,据此进行响应面分析试验,由响应面分析法对茶多酚提取率的ANOVA分析结果得出,料液比和提取次数的影响尤为显著,根据单因素试验以及响应面试验的结果,进一步确定了茶多酚提取的最佳工艺条件为:料液比(g/ml)为1∶31.84,提取时间 40.99min ,提取次数 3 次。
[参考文献]
[1]慕运动.响应面方法及其在食品工业中的应用[J].郑州工程学院学报,2001,22(3):91-94.
[2]Ashima V,Nathalie G.Statistical optimization of the medium components by response surface methodology to enhance phytase production byPichiaanomala[J].Process Biochemistry,2002,37:999-1004.
[3]宋冠群,林金明.茶多酚分析方法研究与进展[J].世界科技研究与发展,2004,26(1):41-51.
[4]Wiley B,Sun Y G,Xia Y N.Synthesis of Silver Nanostructures with Controlled Shapes and Properties [J].Acc Chem Res,2007,40:1067-1076.
[5]Sakanaka S,Aizawa M,Kim M.Inhibitory efforts of green tea polyphenols on growth and cellular adherence of an oral bacterium [J].Biosci Biotechnol Biochem,1996,60:745 - 749.
[6]Rai M,Yadav A,Gade A.Silver nanoparticles as a new generation of antimicrobials.[J].Biotechnol Adv,2009,27:76-83.
[7]徐芳,赵春,张雪辉,等.沱茶中茶多酚水提取工艺研究[J].昆明医学院学报,2009,(8):145-147.
[8]刘焕云,李慧荔,邵伟雄,等.绿茶中茶多酚的提取工艺研究[J].山西食品工业,2004,(2):23-25.
[9]曾光远,王飞.影响酒石酸铁比色法测定结果的因素[J].食品质量安全与检测,2008,(Z1):67-69.
[10]李春燕,成浩,杨晓丽,等.单因素实验设计在茶多酚水提取工艺研究中的应用[J].昭通师范高等专科学校学报,2012,(5):11-12.
[11]刘佳,焦士蓉,唐远谋,等.苦丁茶多酚的提取及抗氧化活性[J].食品科学,2011,(14):134-138.
[12]刘渠道,王建中,许诺.响应面法优化超声波辅助提取茶多酚的工艺研究[J].中国食物与营养,2008,(9):42-44.
[13]BOX G E P,HUNTER W G.Statistics for experiments:An introduction to design,data analysis and model building [M].New York:John Wiley & Sons Inc,1978.
[14]隋焕平,夏薇,张玉梅.芹菜提取物中总黄酮含量测定[J].中国公共卫生,2001,(4):332-333.
