新城疫病毒V和W基因真核表达产物对DF-1细胞凋亡的影响
2014-09-10汪招雄康银峰孙敏华高诗敏谢鹏任涛
汪招雄,康银峰,孙敏华,高诗敏,谢鹏,任涛
(长江大学动物科学学院,湖北 荆州 434025)(农业部兽用疫苗重点创造实验室,华南农业大学兽医学院,广东 广州510642)
新城疫(Newcastle Disease,ND)是由新城疫病毒(Newcastle Disease Virus,NDV)引起的一种以呼吸道、消化道粘膜出血为典型病变的高度接触性、急性败血性禽类传染病,是危害养禽业最严重的传染病之一。世界动物卫生组织(OIE)将其列为必须报告的动物疫病,我国农业部将其列为一类传染病[1]。
NDV属于副粘病毒科副粘病毒亚科腮腺炎病毒属有囊膜的负链RNA病毒。病毒基因组主要编码RNA依赖的RNA聚合酶(RNA dependent RNA polymerase,L)、磷蛋白(phosphate protein,P)、血凝素神经氨酸酶(haem-agglutinin neuraminidase protein,HN)、细胞融合蛋白(fusion protein,F)、核衣壳蛋白(nucleocapsid protein,NP)和膜蛋白(matrix,M)等6种结构蛋白以及P基因编辑产生的2种非结构蛋白如V、W蛋白。NDV通过在其P基因第484位保守的编辑位点上插入一个鸟嘌呤核苷酸G致使阅读框后移一位产生V基因,插入2个G则产生W基因,V、W蛋白与P蛋白具有共同的独特的N末端区域和各自高度保守的C末端区域[2]。近年来的研究表明,NDV V蛋白具有增强病毒复制的作用,不同的NDV V蛋白因为其C-端氨基酸存在差异,导致了病毒复制的差异,毒力强的病毒V蛋白能明显增强病毒的复制[3]。而目前对NDV W蛋白功能的研究较少。本研究旨在探讨不同毒力的NDV V和W蛋白对细胞凋亡的影响,为这2种蛋白的功能研究奠定基础。
1 材料与方法
1.1 质粒与试剂
pEGFP-N1由华南农业大学兽医学院禽病实验室保存,pEGFP-La V、pEGFP-La W、pEGFP-GM V、pEGFP-GM W由笔者自行构建,LipofectamineTM2000转染试剂购自Invitrogen公司,鸡胚成纤维细胞(DF-1)由华南农业大学兽医学院禽病实验室保存。
1.2 质粒转染
参照LipofectamineTM2000转染试剂说明将pEGFP-La V、pEGFP-La W、pEGFP-GM V、pEGFP-GM W和空载体pEGFP-N1转染DF-1细胞。设置不转染质粒的空白对照组。
1.3 荧光显微镜下观察 NDV V和W基因在DF-1细胞中真核表达产物
将质粒转染DF-1 24h后,将细胞置于荧光倒置显微镜下,观察GFP在细胞中的表达情况并拍照。
1.4 流式检测细胞凋亡
在质粒转染后24、36h和48h,用不含EDTA的胰酶消化收集细胞。先后应用7-AAD和Annexin V-PE作用细胞,在反应1h内,用流式细胞仪检测检测细胞凋亡情况。使用未经处理的正常细胞,作为对照进行荧光补偿调节去除光谱重叠和设定十字门的位置。
2 结果与分析
2.1 NDV V和W基因真核表达产物在DF-1细胞中的表达情况
利用荧光倒置显微镜对各组转染细胞进行观察,在转染后12h,可见pEGFP-La V 、pEGFP-La W、pEGFP-GM V、pEGFP-GM W和pEGFP-N1质粒转染的DF-1细胞发出绿色荧光,证明在转染阳性细胞克隆中有融合蛋白的表达。随着时间的推移,各组细胞荧光强度均有增强,图1为转染24h后各组细胞绿色荧光图片。
图1 转染24h后融合蛋白La V-GFP、La W-GFP、GM V-GFP和GM W-GFP在DF-1细胞中的表达
2.2 流式检测细胞凋亡情况
pEGFP-La V、pEGFP-La W、pEGFP-GM V、pEGFP-GM W和空载体pEGFP-N1质粒分别转染到DF-1 24、36h和48h后,收集各组细胞,用流式细胞仪检测。早期凋亡以Annexin V-PE染色为主,在流式细胞分析图(图2)中为右下区(F4)细胞簇,晚期凋亡为Annexin V-PE/7-AAD双染色,在流式细胞分析图中为右上区(F2)细胞簇。
检测结果表明,相对于空白细胞对照组,在质粒转染后24、36h和48h,所有转染组诱导的细胞凋亡均有明显的提高,并且随着转染时间的增加,细胞早期凋亡率逐渐上升。在质粒转染后24h,pEGFP-GM V、pEGFP-GM W、pEGFP-La V和pEGFP-La W真核表达产物诱导DF-1细胞的凋亡率在14.26%~17.09%之间,差异不大,但是都明显高于空载体组。而在质粒转染后36h,pEGFP-GM V、pEGFP-GM W真核表达产物诱导细胞凋亡率分别为45.05%和43.4%,明显高于pEGFP-La V和pEGFP-La W诱导的31.44%和38.64%的凋亡率。在质粒转染后48h,pEGFP-GM W和pEGFP-La W真核表达产物诱导细胞凋亡率均超过50%,pEGFP-GM W真核表达产物诱导细胞凋亡率达到了43.4%,而pEGFP-La V真核表达产物诱导细胞凋亡率最低,为33.44%。结果表明,来源于不同毒力NDV毒株非结构蛋白 V和W均能诱导细胞的早期细胞凋亡,但是诱导细胞凋亡能力存在一定的差异(图2和表1)。

图2 NDV V和W基因真核表达产物对DF-1细胞凋亡影响(转染48 h)
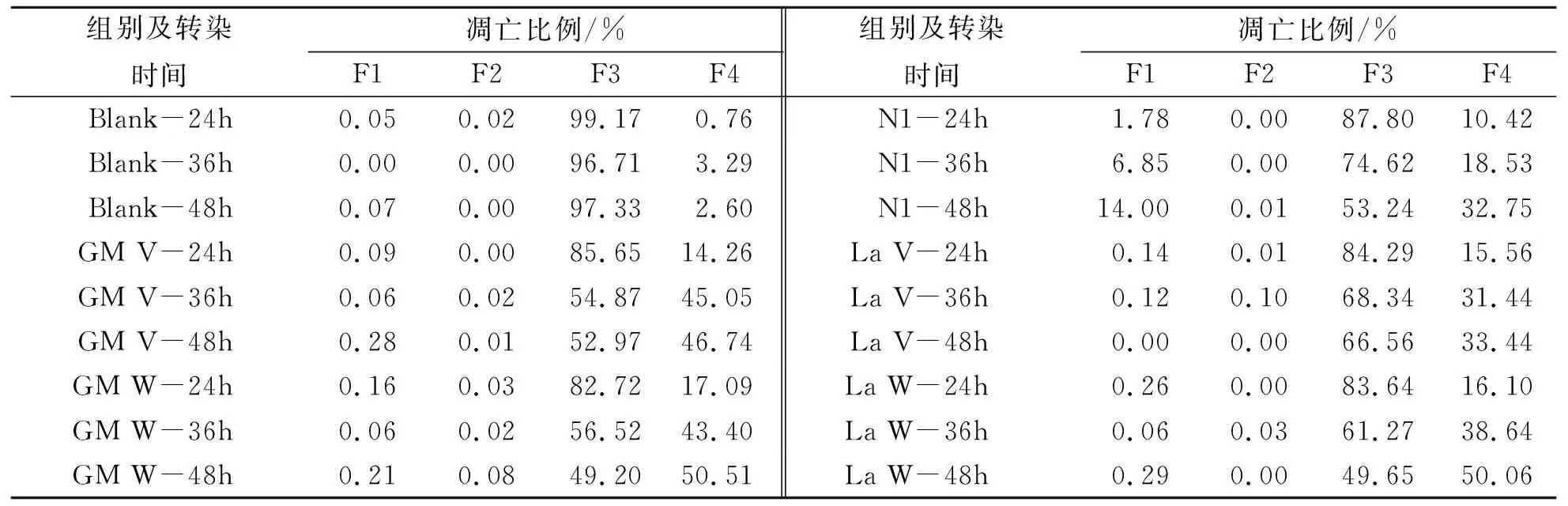
组别及转染时间凋亡比例/%F1F2F3F4组别及转染时间凋亡比例/%F1F2F3F4Blank-24h0.050.0299.170.76N1-24h1.780.0087.8010.42Blank-36h0.000.0096.713.29N1-36h6.850.0074.6218.53Blank-48h0.070.0097.332.60N1-48h14.000.0153.2432.75GM V-24h0.090.0085.6514.26La V-24h0.140.0184.2915.56GM V-36h0.060.0254.8745.05La V-36h0.120.1068.3431.44GM V-48h0.280.0152.9746.74La V-48h0.000.0066.5633.44GM W-24h0.160.0382.7217.09La W-24h0.260.0083.6416.10GM W-36h0.060.0256.5243.40La W-36h0.060.0361.2738.64GM W-48h0.210.0849.2050.51La W-48h0.290.0049.6550.06
注:1.Blank:正常细胞对照组;La V:pEGFP-La V质粒转染组;La W:pEGFP-La W质粒转染组;GM V:pEGFP-GM V质粒转染组;GM W:pEGFP-GM W质粒转染组;N1:空载体pEGFP-N1质粒转染组。2. F1:机械损伤细胞;F2:晚期细胞凋亡;F3:正常细胞;F4:早期凋亡细胞组。
3 讨论
机体正常的细胞凋亡对机体的正常发育和新陈代谢是必要的,有助于维持组织稳态,是宿主抵抗多种有害因素的一种有效防御机制。而病毒感染宿主细胞后,它需要利用宿主的物质和能量系统来完成病毒的复制过程。病毒感染后引起细胞凋亡,不利于病毒增殖而有利于病毒扩散;病毒进入细胞后表达的一些病毒蛋白将会引起细胞的凋亡过程。
近年来,很多学者对NDV诱导的细胞凋亡进行了广泛的研究。房慧伶等[4]和李翔等[5]应用NDV标准强毒F48E8株感染鸡,发现该毒株可以在体内诱导胸腺和法氏囊淋巴细胞凋亡,并认为由此所致的免疫抑制可能是NDV致病的重要原因。蒋丽娜等[6]用NDV感染体外培养S180肉瘤细胞发现,该病毒对S180细胞增殖有明显抑制作用,可诱导S180细胞凋亡。崔玉东等[7]应用研究发现新NDVⅠ系毒株能通过Caspase依赖性途径诱导鸡胚成纤维细胞(CEF)凋亡,其中Caspase28和Caspase29在凋亡中发挥重要作用,而Caspase23和Caspase210在凋亡中不发挥作用。Ravindra等[8-11]也研究发现,NDV 感染能够通过Caspase依赖性途径诱导细胞凋亡诱导细胞,在感染NDV的Vero细胞中,感染24h的Caspase 8 活性高于感染48h的活性,而Caspase 9活性表现在这2个时间点正好相反,Caspase 3在这2个时间点活性都比较高。基于此,笔者认为NDV感染48h 后诱导细胞凋亡主要是通过外源性凋亡途径。而且,病毒感染后增加Bax转化Bcl-2率,p53和Caspase 3、8、9表达。将NDV HN蛋白作用CEF显示,该蛋白能够通过提高Caspase 1、9、8、3活性,减损线粒体膜潜能和增加细胞氧化应激能力来诱导细胞凋亡。
然而,还没有发现NDVV和W蛋白诱导细胞凋亡的报道。在本研究中,将pEGFP-La V、 pEGFP-La W、pEGFP-GM V、pEGFP-GM W和pEGFP-N1质粒转染DF-1细胞中后,在不同时间点分别检测了各组DF-1细胞的凋亡情况,结果发现,NDV V和W基因的真核表达产物均能诱导很高比例的DF-1发生细胞凋亡。但是V和W蛋白是通过什么途径对DF-1细胞细胞造成凋亡的,尚需进一步研究。
[参考文献]
[1]王学理,武迎红,鲁金波,等.新城疫病毒分子生物学研究进展[J].内蒙古民族大学学报,2009,24(3):318-322.
[2]仇旭升,孟春春,于洋,等.新城疫病毒P/V/W基因编码产物功能结构域的分析及定位[J].生物技术通报,2011,(1):191-197.
[3]刘玉良,刘秀梵.新城疫病毒P基因的RNA编辑及其抗干扰素作用[J].动物医学进展,2004,25(6):1-3.
[4]房慧伶,李翔,曾芸,等.新城疫病毒F48E8体内诱导鸡胸腺淋巴细胞凋亡的研究[J].畜牧与兽医,2007,39(4):17-19.
[5]李翔,房慧伶,曾芸,等.城疫病毒人工感染鸡诱导胸腺和法氏囊细胞凋亡的初步研究[J].广西畜牧兽医,2005,21(2):51-53.
[6]蒋丽娜,孙黎,程建贞,等.新城疫病毒体外诱导S180细胞凋亡的实验研究[J].河北北方学院学报,2008,25(3):11-14.
[7]崔玉东,冉旭华,宋佰芬,等.新城疫病毒Ⅰ系毒株通过Caspase途径诱导鸡胚成纤维细胞凋亡[J].中国兽医学报,2006,26(3):254-256.
[8]Ravindra P V,Ashok K,Tiwari,et al.HN protein of Newcastle disease virus causes apoptosis in chicken embryo fibroblast cells [J].Arch Virol,2008,153:749-754.
[9]Ravindra P V,Ashok K,Tiwari,et al.Induction of apoptosis in Vero cells by Newcastle disease virus requires viral replication,de-novo protein synthesis and caspase activation[J].Virus Research,2008,133:285-290.
[10]Ravindra P V,Ashok K,Tiwari,et al.Newcastle disease virus-induced cytopathic effect in infected cells is caused by apoptosis[J].Virus Research,2009,141:13-20.
[11]Ravindra P V,Ashok K.Tiwari,et al.Time course of Newcastle disease virus-induced apoptotic pathways[J].Virus Research,2009,144:350-354.
