基因C型鸭甲肝病毒单克隆抗体制备及其抗原表位鉴定
2014-09-10程方明张焕容王远微
程方明,张焕容,2*,洪 杰,王远微,2,岳 华,2,汤 承,2
(1.西南民族大学生命科学与技术学院,四川成都 610041;2.西南民族大学动物医学四川省高等学校重点实验室,四川成都 610041)
基因C型鸭甲肝病毒单克隆抗体制备及其抗原表位鉴定
程方明1,张焕容1,2*,洪 杰1,王远微1,2,岳 华1,2,汤 承1,2
(1.西南民族大学生命科学与技术学院,四川成都 610041;2.西南民族大学动物医学四川省高等学校重点实验室,四川成都 610041)
为制备基因C型鸭甲肝病毒(DHAV-C)单克隆抗体(MAb),本研究根据DHAV-C ORF编码氨基酸序列与基因A型DHAV(DHAV-A)相应序列比对结果,利用生物信息学软件筛选位于DHAV-C ORF编码蛋白序列上的不同抗原表位,合成5条十肽表位序列,分别与KLH载体蛋白偶联后免疫BALB/c小鼠,经细胞融合筛选获得5株稳定分泌抗DHAV-C MAb杂交瘤细胞株。Western blot显示,5株MAb均能够与DHAV-C发生特异性反应,其中5H24-9、3E18-4和5E3-9 3株MAb不与DHAV-A、鸭瘟病毒、新城疫病毒和禽流感病毒反应,为DHAV-C的特异性MAb,同时也证明与这3株MAb结合的十肽序列为DHAV-C的抗原表位。这3株MAb亚类分别为IgG2b、IgG1和IgG2b。MAb的制备为建立DHAV-C的检测方法和致病机理奠定了基础。
基因C型鸭甲肝病毒;抗原表位;单克隆抗体;ELISA
鸭病毒性肝炎(Duck viral hepatitis,DVH)是由3种血清型的鸭肝炎病毒(Duck hepatitis virus,DHV)引起雏鸭的一种以肝脏病变为主的急性、高度致死性和接触性传染病[1-2]。自发现以来,在全世界养鸭地区广泛分布,是危害养鸭业最为严重的传染病之一[3]。3种血清型DHV之间互不发生交叉反应,临床上最常见的为血清Ⅰ型DHV(DHV type 1,DHV-1),DHV-1又称鸭甲肝病毒(Duck hepatitis A virus,DHAV)。DHV-1为小RNA病毒。根据基因组成差异,DHAV分为3种基因型,王丽艳等称之为基因A型、B型和C型,分别对应传统血清Ⅰ型DHAV、“台湾新型”和“韩国新型”DHAV[4-7]。目前在我国大陆流行的主要是基因A型和C型DHAV。本研究采用生物信息学分析筛选基因C型DHAV(DHAV-C)抗原表位并研究相应的特异性。
1 材料和方法
1.1 病毒株及实验动物 DHAV-C、DHAV-A、新城疫病毒(NDV)、禽流感病毒(AIV)和鸭瘟病毒(DPV)均由西南民族大学动物医学实验室保存。6周龄雌性SPF级BALB/c小鼠购自四川省医学科学院。
1.2 主要试剂 MAb亚类鉴定试剂盒购自Sigma公司;PVDF膜购自Bio-Rad公司;羊抗鼠IgG-HRP购自北京中杉金桥生物技术有限公司;TMB、双功能交联剂SMPH购自Thermo公司;谷氨酰胺购自Biosharp公司。
1.3 抗原位点的预测及十肽的合成 根据GenBank中登录的DHAV-C和DHAV-A ORF编码的氨基酸序列比对结果,采用DNAStar及Goldkey软件,分析其二级结构,对氨基酸序列的亲水性、抗原指数、表面可及性及可塑性等参数进行分析;预测信号肽切割位点,穿膜螺旋,并在NCBI中Blast确定抗原位点保守性,经过上述参数的综合得分确定特异性抗原表位。十肽由艾比玛特生物医药(上海)有限公司合成,并在十肽的C-端加上半胱氨酸残基。
1.4 动物免疫 采用SMPH将十肽与KLH载体蛋白通过半胱氨酸残基偶联后作为抗原,免疫6周龄BALB/c小鼠,免疫方法参照文献[8]。
1.5 杂交瘤细胞株的制备与筛选 按照文献[8]方法进行细胞融合。以合成的偶联蛋白作为包被抗原,采用间接ELISA方法和系列稀释法进行筛选,并进行阳性细胞的克隆及纯化,获得稳定分泌MAb的杂交瘤细胞株为止。
1.6 MA b腹水的制备 按照文献[9]进行并测定腹水ELISA效价。
1.7 MA b亚型鉴定 利用抗体亚型鉴定试剂盒,按说明书中Capture ELISA方法操作。
1.8 MA b活性鉴定 将DHAV-C经SDS-PAGE电泳后半干转印至PVDF膜上,以MAb为一抗(1∶200),以羊抗鼠 IgG-HRP为二抗(1∶5 000),western blot鉴定MAb的活性。
1.9 特异性鉴定 采用western blot鉴定MAb是否与DHAV-A、DPV、NDV和AIV反应,SDS-PAGE电泳后同1.8方法。
1.1 0 MA b杂交瘤细胞的稳定性 将阳性杂交瘤细胞体外连续传代培养,每隔3代检测细胞上清液的效价。将冻存的杂交瘤细胞复苏并多次传代,检测培养上清液的抗体效价,分析杂交瘤细胞分泌抗体的稳定性。
2 结 果
2.1 抗原表位预测及多肽合成 应用DNAStar、Goldkey分析DHAV-C ORF编码的氨基酸序列(图1),结果显示,预测的特异性抗原表位为:776NLFESKLTPY785,809PEIPKYDGPI818,1933MDQIQSPSTV1942,2230PVLEIQPWGV2239和2238GVARMRAYTA2247,每个抗原表位合成500 μg十肽。

图1 DHAV-C ORF氨基酸序列的亲水性、抗原性及表面可及性分析Fig.1 Hydrophilicity plot,antigen index and surface probability plot analysis of DHAV-C ORF
2.2 杂交瘤细胞株的建立 免疫的BALB/c小鼠脾细胞与SP2/0细胞融合后,经间接ELISA进行3次细胞阳性克隆株的筛选及纯化,最终获得5株稳定分泌抗DHVA-C MAb的杂交瘤细胞,分别命名为5H24-9、3E18-4、5E3-9、5C20-9 和 5N20-8,间接ELISA测定5株杂交瘤细胞上清液效价均为1∶3 200,腹水效价均为1∶128 000。
2.3 MA b的亚型 5株MAb与多肽的对应关系以及MAb的亚型鉴定结果如表1。

表1 MAb亚型鉴定结果Table 1 Identification results of subclasses of the MAbs
2.4 MA b的活性 Western blot显示,5株MAb均可以与DHAV-C发生特异性反应(图2)。
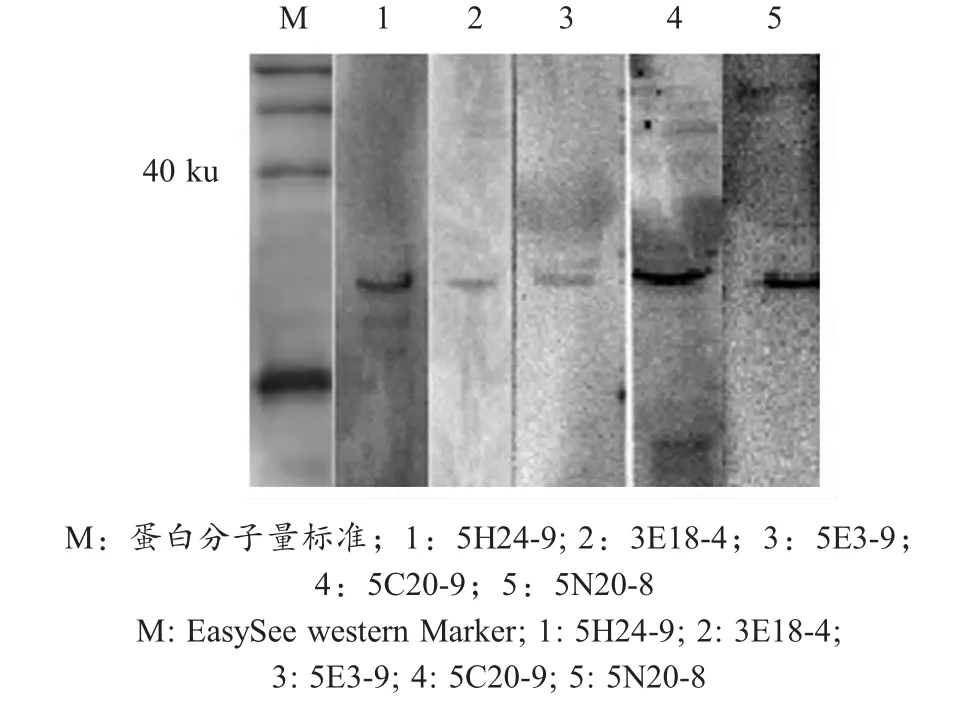
图2 5株MAb与DHAV-C反应的western blot鉴定Fig.2 Western blot identification of DHAV-C reacting with the 5 MAbs,respectively
2.5 MA b的特异性鉴定 采用western blot对5株MAb的特异性进行检测。结果显示,5H24-9、3E18-4和5E3-9 MAb均不与DHAV-A、NDV、AIV和 DPV反应,表明5H24-9、3E18-4和 5E3-9 3株MAb为DHAV-C的特异性MAb。5C20-9和5N20-8 MAb既与DHAV-C又与DHAV-A反应,与DPV、NDV和AIV不反应,为DHAV-C和DHAV-A共同的 MAb(图 3)。
2.6MA b的稳定性 在体外连续培养20代,5H24-9、3E18-4、5E3-9、5C20-9和5N20-8 5株杂交瘤细胞株均能够稳定分泌抗体,液氮冻存后复苏,细胞生长良好,并且上清液抗体效价无明显变化,表明细胞株的抗体分泌性能很稳定。
3 讨 论

图3 Western blot鉴定MAb的特异性结果Fig.3 Specific identification of the 5 MAbs by western blot
生物信息学分析对蛋白质的结构、功能的研究具有重要的作用,为研究目的蛋白的生物学特性提供了重要的辅助作用,并广泛应用于蛋白质抗原位点的预测[10]。抗原表位是抗原分子中决定抗原特异性的特殊化学基团。以往抗原表位的预测主要采用单参数预测,具有一定的局限性,随着生物信息学的发展,多参数的综合预测已成为当前抗原表位预测的主流,可以显著提高抗原表位预测的准确性[11]。通过合成抗原表位多肽与载体蛋白偶联,免疫制备相应的抗体已成功应用[12-13]。本研究应用DNAStar、Goldkey生物软件,以Kyke-Doolittle,Jameson-Wolf和Emini等参数预测了抗原位点,从信号肽切割位点,穿膜螺旋,磷酸化以及抗原位点的保守性和种属特异性来筛选特异性的抗原表位,显著提高了抗原位点选择的准确性。本研究对预测的特异性抗原表位先合成多肽,然后与KLH载体蛋白偶联作为免疫原,以常规的MAb杂交瘤细胞制备技术和筛选方法获得了DHAV-C的特异性MAb杂交瘤细胞株,并大量制备相应的MAb,经western blot检测,证明其确为DHAV-C的特异性MAb。
李晓军等利用纯化的病毒和提金凤等利用纯化的VP1蛋白制备的DHAV-A MAb的效价不高[14-15],杨萍萍等和潘朋朋等用纯化的病毒制备的DHAV-A MAb未检测其特异性,并且中和特性也较差[16-17]。姜畔等用纯化的病毒制备的DHAV-C MAb效价不高,腹水效价仅为1∶25 600,并且不能够区分DHAV基因型[9]。本研究制备的5株针对DHAV-C抗原表位的MAb杂交瘤细胞上清液和腹水的ELISA效价分别为1∶3 200和1∶128 000,显著高于国内已有文献报道制备的DHAV MAb的效价。通过western blot检测,其中3株MAb只与DHAV-C特异性反应,而均不与DHAV-A、DPV、NDV和AIV发生交叉免疫反应,证明其为DHAV-C的特异性MAb。本研究获得的3株DHAV-C MAb,以及2株DHAV-A和DHAV-C共同的MAb特异性好,分泌抗体能力稳定,抗体效价高,这些MAb为DHAV-A和DHAV-C抗原和相应抗体的检测技术研究和致病机理研究提供了重要材料。
[1]Ding Chun-yu,Zhang Da-bing.Molecular analysis of duck hepatitis virus type 1[J].Virology,2007,361(1):9-17.
[2]范书才,李虹,袁率珍,等.新型鸭肝炎病毒的分离鉴定[J].中国预防兽医学报,2009,31(10):770-775.
[3]Tseng C H,Tsai H J.Molecular characterization of a new sero-type of duck hepatitis virus[J].Virus Res,2007,126(2):19-31.
[4]Wang Li-yan,Pan Meng,Fu Yu,et al.Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J].Virus Genes,2008,37:52-59.
[5]Kim M C,Kwon Y K,Joh S J.Recent Korean isolates of duck hepatitis virus reveal the presence of a new geno-and serotype when compared to duck hepatitis virus type 1 type strains[J].Arch Virol,2007,152(11):2059-2072.
[6]皮晋魁,聂培婷,黄秋雪,等.基因C型鸭甲肝病毒VP1基因的克隆及原核表达[J].中国预防兽医学报,2012,34(9):740-742.
[7]何庆雄,程安春,汪铭书,等.Ⅰ型鸭病毒性肝炎诊断方法研究进展[J].中国预防兽医报,2009,31(8):664-666.
[8]Lia V Q F,Gubio S C,Patricia A B,et al.Precipitation of bovine rotavirus by polyethylene glycol(PEG)and its application to produce polyclonal and monoclonal antibodies[J].J Virol Methods,2005,123(2):147-153.
[9]姜畔.鸭肝炎病毒单克隆抗体的制备及ELISA病毒检测方法的建立[D].北京:中国兽医药品监察所,2011.
[10]Korber B,LaBute M,Yusim K.Immunoinformatics comes of age[J].PLoS Comput Biol,2006,2(6):484-492.
[11]Reuter S,Manfras B,Merkle M,et al.In vitro activities of itraconazole,methiazole,and nitazoxanide versus Echinococcus multilocularis larvae[J].Antimicrob Agents Chemother,2006,50(9):2966-2970.
[12]南文龙,金宁一,鲁会军,等.H5N1亚型禽流感病毒血凝素Th和B细胞表位预测及抗原性分析[J].中国免疫学杂志,2009,25(7):630-637.
[13]涂硕,陈柯,钟立鹏,等.蛇毒C型凝集素家族结构及抗原表位预测[J].中国免疫学杂志,2010,26(11):963-972.
[14]李晓军,张婷婷,孟凡依,等.抗Ⅰ型鸭肝炎病毒单克隆抗体的制备及其生物学特性鉴定[J].中国预防兽医学报,2011,33(6):487-489.
[15]提金凤,李志杰,王海燕,等.Ⅰ型鸭肝炎病毒VP1蛋白单克隆抗体的研制[J].中国动物传染病学报,2012,20(3):7-11.
[16]杨萍萍,宋敏训,艾武,等.鸭肝炎病毒单克隆抗体的研制[J].中国预防兽医学报,2006,28(2):212-216.
[17]潘朋朋,文力正,单振振,等.鸭肝炎病毒单克隆抗体的制备[J].中国农学通报,2011,27(1):415-418.
Monoclonal antibody preparation and the epitope identification of genotype C duck hepatitis A virus
CHENG Fang-ming1,ZHANG Huan-rong1,2*,HONG Jie1,WANG Yuan-wei1,2,YUE Hua1,2,TANG Cheng1,2
(1.College of Life Science and Technology,Southwest University for Nationalities,Chengdu 610041,China;2.Key Laboratory of Sichuan Institutes of Higher Learning,Southwest University for Nationalities,Chengdu 610041,China)
To identify antigen epitopes of genotype C duck hepatitis A virus(DHAV-C)and prepare corresponding monoclonal antibodies(MAbs),the potential antigen epitopes of DHAV-C were predicted by bioinformatic softwares according to its complete deduced amino acid sequences and artificially synthetized as different 10-amino-acid polypeptides to immune BALB/c mice for preparation of MAbs.In addition,five MAbs were prepared by cell fusion technique.Western blot results showed that three of the five MAbs reacted specifically with DHAV-C,but not with genotype A duck hepatitis A virus(DHAV-A),duck plaque virus,Newcasstle disease virus(NDV)and avian influenza virus(AIV).The MAb subclasses of the three specific MAbs were IgG2b,IgG1 and IgG2b,respectively.The preparation of MAbs and the verification of DHAV-C antigen epitopes provided the basis for the further development of detection method for DHAV-C.
genotype C duck hepatitis A virus(DHAV-C);antigen epitopes;monoclonal antibody(MAb);ELISA
S852.65
A
1008-0589(2014)04-0301-04
10.3969/j.issn.1008-0589.2014.04.12
*Correspondingauthor
2013-05-17
国家高技术研究发展计划(2012AA101304);西南民族大学研究生创新课题(CX2013SZ75)
程方明(1989-),男,河南信阳人,硕士研究生,主要从事畜禽传染病快速诊断与防制研究.
*通信作者:E-mail:zhrong05@163.com
(本文编辑:李 爽)
