miR-483-3p对结直肠癌DLC1基因表达的影响*
2014-09-08蒋菁蕊吴少亘曹望森崔恒宓于成功
蒋菁蕊 刘 媛 吴少亘 曹望森 崔恒宓,3# 于成功#
南京大学医学院附属鼓楼医院消化科1(210008) 南京大学医学院2 扬州大学表观遗传学及表观基因组学研究所3
Cell Proliferation
结直肠癌是常见且多发的消化道恶性肿瘤之一,近年来发病率呈上升趋势。抑癌基因表达抑制在肿瘤发生、发展过程中起重要作用,是结直肠癌的发病机制之一。肝癌缺失基因1(deleted in liver cancer 1, DLC1)于1998年首次被发现,该基因定位于8p21.3-22,编码1 091个氨基酸,与鼠源p122 Rho GAP有86%的同源性,在多种实体肿瘤中低表达或完全沉默[1-3]。Zhou等[4]的研究显示,DLC1可抑制肿瘤细胞生长,诱导细胞凋亡,并通过调节肌动蛋白细胞骨架结构和黏着斑影响细胞迁移。已知一些microRNAs可通过调节抑癌基因的表达影响肿瘤发生。miR-483位于肿瘤相关基因胰岛素样生长因子2(IGF2)的第7号内含子内,其前体发夹结构有2个亚单位,即3’端的miR-483-3p和5’端的miR-483-5p,研究[5]发现结直肠癌组织中的miR-483-3p表达水平明显高于正常结直肠组织。根据Targetscan数据库预测,miR-483-3p可与DLC1 3’非翻译区(3’UTR)的对应序列靶向结合,可能通过降解DLC1 mRNA或抑制其翻译而降低其蛋白水平,从而影响DLC1的抑癌作用。本研究通过检测结直肠癌组织中的DLC1和miR-483-3p表达水平,并探讨miR-483-3p对DLC1表达的靶向调节作用,以期阐明miR-483-3p在结直肠癌发生中的作用机制。
材料与方法
一、标本获取
纳入2012年10月~2013年4月南京大学医学院附属鼓楼医院收治的结直肠癌患者16例,其中男7例,女9例,年龄45~84岁,平均(64.1±13.9)岁。采集癌组织及其相应癌旁非癌组织(距癌组织边缘4~5 cm)标本,所有标本均经HE染色后由组织病理学检查确诊,病理类型均为腺癌,Dukes分期A期1例,B期2例,C期12例,D期1例。研究方案经南京大学医学院附属鼓楼医院医学伦理委员会批准,入选患者均签属知情同意书。
二、细胞株和主要试剂
人结肠癌细胞株HCT116、人胚肾细胞株HEK293T(南京大学医学院附属鼓楼医院消化科实验室保存)。鼠抗人DLC1单克隆抗体(美国BD公司),羊抗鼠IgG-HRP[生兴生物技术(南京)有限公司],Trizol试剂、microRNA逆转录试剂盒、Taqman探针试剂盒、Lipofectamine®2000转染试剂盒(美国Invitrogen 公司),q-PCR Mix(美国ABI公司),pmirGLO双荧光素酶报告基因载体(美国Promega公司),限制性内切酶XhoⅠ、XbaⅠ(美国Fermentas公司),miR-483-3p mimic、阴性对照mimic(广州锐博生物科技有限公司),CCK-8试剂盒(日本同仁化学研究所)。
三、方法
1. 蛋白质印迹法检测结直肠癌组织和癌旁非癌组织DLC1表达:取癌组织和癌旁非癌组织,加入RIPA裂解液提取总蛋白,BCA法测定蛋白含量。每一样本取100 μg总蛋白上样,SDS-PAGE凝胶电泳,转膜,封闭,加入鼠抗人DLC1单克隆抗体(1∶200) 4 ℃过夜,加入羊抗鼠IgG HRP(1∶5 000)室温孵育1 h,ECL显影,定影,凝胶成像系统拍照、分析。
2. qRT-PCR检测结直肠癌组织和癌旁非癌组织miR-483-3p表达:取癌组织和癌旁非癌组织,以Trizol试剂提取总RNA,参照microRNA逆转录试剂盒说明书行逆转录,反应条件:16 ℃ 30 min; 42 ℃ 30 min;85 ℃ 5 min;4 ℃控温。q-PCR反应采用Taqman探针法,选用U6作为内参照,反应条件:95 ℃ 15 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。2-ΔΔCt法计算miR-483-3p相对表达量。
3. pmirGLO-DLC1 WT和pmirGLO-DLC1 MUT载体构建:在Targetscan数据库中查找得到DLC1 3’UTR序列中与miR-483-3p互补的种子序列为AGGAGTG,以NCBI数据库中查找得到的DLC1(Gene ID:10395) 3’UTR序列为模板设计引物,上游引物:5’-CCG CTC GAG GCT TCC TGT TTG TTG AGG GTC T-3’(划线处为XhoⅠ酶切位点),下游引物:5’-CTA GTC TAG AAA GGC TAG AGG GAG CAG TTC AT-3’(划线处为XbaⅠ酶切位点)。PCR扩增片段长度为677 bp,包含miR-483-3p靶位序列。PCR产物经XhoⅠ和XbaⅠ酶切后,与同样经酶切的pmirGLO载体进行连接,所构建的野生型载体命名为pmirGLO-DLC1 WT。设计种子序列的突变序列为AGGCTGG(划线处为突变后碱基),采用重叠延伸PCR法诱导定点突变,突变型上游引物:5’-TGC ACA GAG GCT GGT GAA TGT G-3’,下游引物:5’-ACA CAT TCA CCA GCC TCT GTG C-3’,酶切和连接方法同野生型载体,所构建的突变型载体命名为pmirGLO-DLC1 MUT。以上引物合成和载体测序鉴定均由上海桑尼生物技术公司完成。
4. 荧光素酶报告基因检测实验:HCT116细胞以含10%胎牛血清的McCoy’s 5A培养基培养,37 ℃、5% CO2培养箱中过夜贴壁,制成细胞悬液,调整密度为2×105/mL,以每孔1 mL接种于12孔板,待细胞密度至70%,参照Lipofectamine®2000转染试剂盒说明书进行操作,分别将pmirGLO-DLC1 WT或pmirGLO-DLC1 MUT与miR-483-3p mimic或阴性对照mimic共转染HCT116细胞,报告基因质粒为200 ng/孔,核酸浓度为50 nmol/L,5 h后弃转染液,更换为新鲜培养基,继续培养48 h后进行细胞裂解,提取细胞裂解液。取荧光素酶报告分析仪专用检测板,每孔加入10 μL荧光素酶催化底物与10 μL细胞裂解液混匀,Promega荧光测定仪测定荧光素酶活性。每组设3个复孔,实验重复3次。对萤火虫荧光素酶荧光值与海肾荧光素酶荧光值的比值进行校正,作为各孔报告基因荧光强度值。
5. 蛋白质印迹法检测miR-483-3p对HEK293T细胞DLC1表达的影响:HEK293T细胞经胰酶消化后制成单细胞悬液,调整细胞密度,接种至6孔板,37 ℃、5% CO2培养箱中过夜贴壁,分别以50、100 nmol/L miR-483-3p mimic或阴性对照mimic转染细胞48 h、60 h,蛋白质印迹法检测同步骤1。
6. CCK-8实验检测miR-483-3p对HCT116细胞增殖的影响:取对数生长期HCT116细胞制成单细胞悬液,以1×104/孔接种至96孔板,37 ℃、5% CO2培养箱中过夜贴壁,分别以50、100 nmol/L miR-483-3p mimic或阴性对照mimic转染细胞 24 h、 48 h,每孔加入10 μL CCK-8试剂,酶标仪测定450 nm 波长处吸光度(A)值。每组设5个复孔,实验重复3次。
四、统计学分析
结 果
一、结直肠癌组织、癌旁非癌组织DLC1表达
蛋白质印迹法检测结果显示,16例结直肠癌患者中10例(62.5%)癌组织DLC1表达水平显著低于癌旁非癌组织(见图1)。
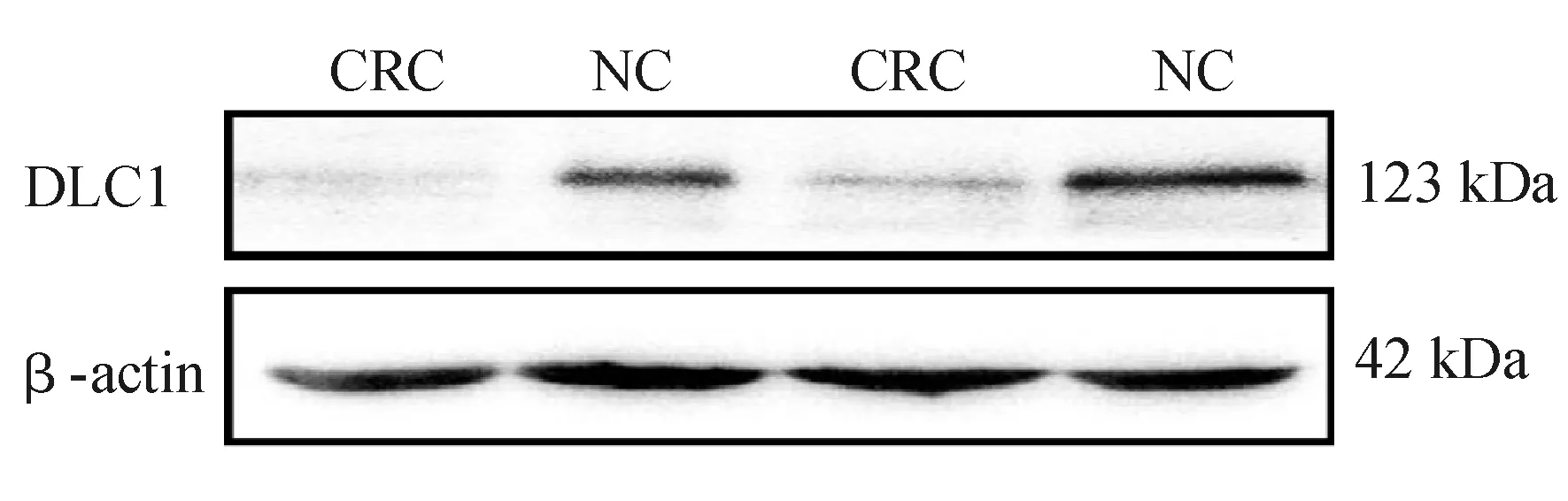
1 Da=0.992 1 u
图1结直肠癌组织、癌旁非癌组织DLC1表达(蛋白质印迹法)
二、结直肠癌组织、癌旁非癌组织miR-483-3p表达
qRT-PCR检测结果显示,16例结直肠癌患者癌组织中的miR-483-3p表达水平均不同程度地高于癌旁非癌组织,10例DLC1低表达者癌组织与癌旁非癌组织相比差异有统计学意义(P<0.05)(见图2)。
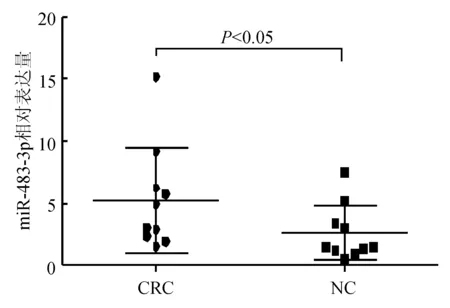
图210例DLC1低表达结直肠癌患者癌组织、癌旁非癌组织miR-483-3p表达
三、miR-483-3p靶向调控DLC1表达
荧光素酶报告基因检测结果显示,pmirGLO-DLC1 WT与miR-483-3p mimic共转染HCT116细胞后,荧光素酶活性较pmirGLO-DLC1 WT与阴性对照mimic共转染显著降低(P<0.01);而pmirGLO-DLC1 MUT与miR-483-3p mimic共转染HCT116细胞后,荧光素酶活性与pmirGLO-DLC1 MUT与阴性对照mimic共转染相比差异无统计学意义(P>0.05)(见图3),证实DLC1是由miR-483-3p调控的靶基因。
四、miR-483-3p对HEK293T细胞DLC1表达的影响
蛋白质印迹法检测结果显示,50、100 nmol/L miR-483-3p mimic转染内源性DLC1表达水平较高的HEK293T细胞48 h后,DLC1表达水平与阴性对照组相比无明显差异;转染60 h后,100 nmol/L miR-483-3p mimic组DLC1表达水平较阴性对照组显著降低,50 nmol/L组与阴性对照组间则无明显差异(见图4)。
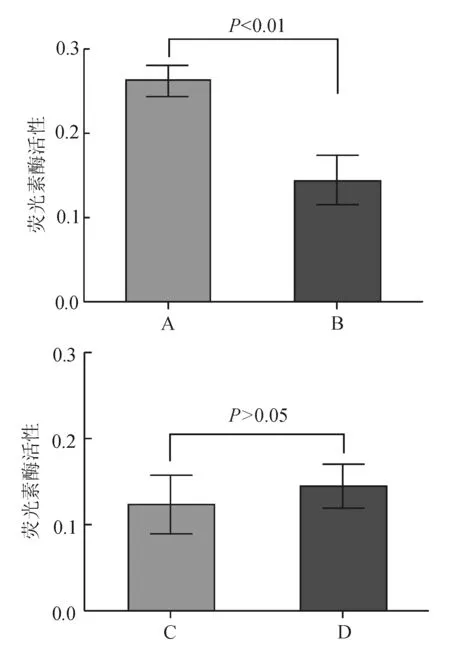
A:pmirGLO-DLC1 WT与阴性对照mimic共转染;B:pmirGLO-DLC1 WT与miR-483-3p mimic共转染;C:pmirGLO-DLC1 MUT与阴性对照mimic共转染;D:pmirGLO-DLC1 MUT与miR-483-3p mimic共转染
图3miR-483-3p靶向调控DLC1表达
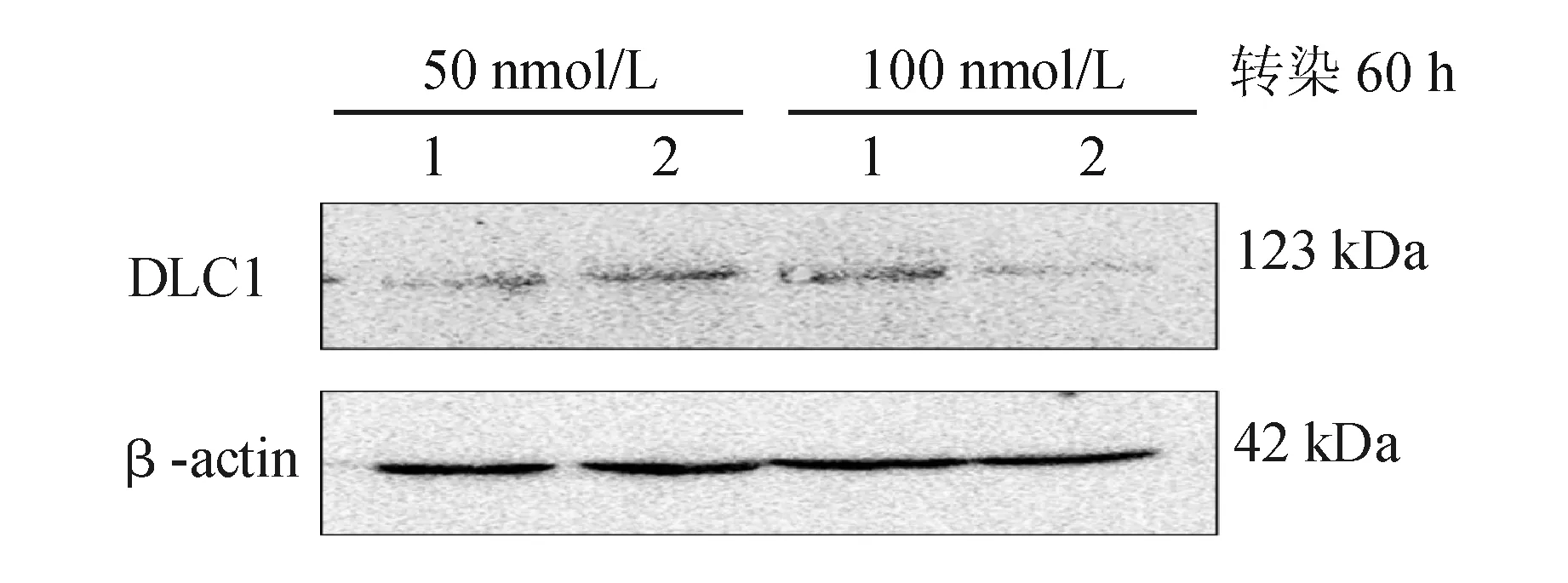
1:阴性对照mimic;2:miR-483-3p mimic
图4miR-483-3p对HEK293T细胞DLC1表达的影响(蛋白质印迹法)
五、miR-483-3p对HCT116细胞增殖的影响
CCK-8实验结果显示,50、100 nmol/L miR-483-3p mimic转染HCT116细胞24 h后,细胞增殖能力与阴性对照组相比无明显变化(P>0.05);转染48 h 后,50、100 nmol/L miR-483-3p mimic组细胞增殖能力均较阴性对照组显著增强(P<0.05)(见图5),但两组间差异无统计学意义(P>0.05)。
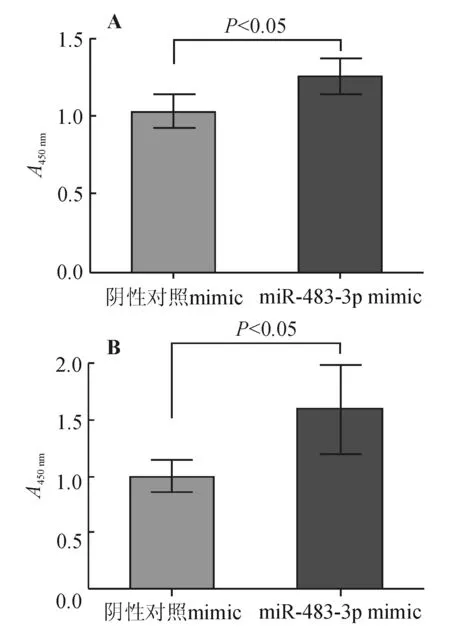
A: 50 nmol/L 转染浓度;B: 100 nmol/L 转染浓度
图5miR-483-3p对HCT116细胞增殖的影响(转染48h)
讨 论
DLC1是一种重要的抑癌基因,目前已在多种恶性肿瘤如肝癌、肺癌、前列腺癌、乳腺癌中发现DLC1表达降低或缺失,结直肠癌患者中约43%存在DLC1表达降低或缺失[6]。DLC1可通过自身多个结构域如Rho GAP、START、SAM发挥抑癌作用[7],其中Rho GAP结构域的抑癌作用受到较多关注,其可通过调节Rho蛋白RhoA、RhoC、Cdc42三个亚型的表达,影响细胞增殖、凋亡和迁移[8]。本研究结果显示,62.5%的结直肠癌患者癌组织DLC1表达水平较癌旁非癌组织显著降低,与上述研究结果相符。然而本研究样本量较小,未能进一步按病理分期分组,分析DLC1表达与结直肠癌病理分期的关系,有待后续扩大样本量作进一步研究。
表观遗传学调节异常在结直肠癌的发生、发展中,尤其是抑癌基因的调节中发挥重要作用,对DLC1表达的相关调节机制包括启动子甲基化、组蛋白去乙酰化以及microRNAs的转录后水平调节[9-10]。microRNAs对基因表达的调节作用主要是抑制靶基因mRNA翻译或降解靶mRNA,从而降低靶基因蛋白水平。IGF2是较早发现的内源性印迹基因,其缺失可导致结直肠癌等多种肿瘤发生[11]。miR-483-3p位于IGF2基因内含子内,两者表达水平呈正相关,提示miR-483-3p可能作用于抑癌基因,促进肿瘤发生[5]。本研究通过荧光素酶报告基因检测实验证实,DLC1为miR-483-3p的靶基因,miR-483-3p可靶向结合DLC1的种子序列而抑制其表达,导致蛋白水平降低。为验证miR-483-3p对DLC1表达的影响,本研究进一步以miR-483-3p mimic转染DLC1表达水平较高的HEK293T细胞并检测细胞内DLC1表达情况,结果显示较高浓度(100 nmol/L)、较长时间(60 h)转染miR-483-3p mimic可显著抑制DLC1表达,进一步证实DLC1是miR-483-3p的靶基因。此外,CCK-8实验结果显示,miR-483-3p mimic较长时间(48 h)转染HCT116细胞后,细胞增殖能力显著增强,提示miR-483-3p抑制DLC1表达对结直肠癌的发生具有促进作用。
综上所述,本研究通过蛋白质印迹法和qRT-PCR检测发现,结直肠癌组织DLC1表达水平降低, miR-483-3p表达水平增高;进一步的荧光素酶报告基因检测实验发现miR-483-3p可直接与DLC1的3’UTR结合而抑制其表达,进而促进结肠癌细胞增殖,证实miR-483-3p可在转录后水平抑制DLC1表达,参与促进结直肠癌发生。本研究揭示了miR-483-3p在结直肠癌发生中的作用机制,然而miR-483-3p能否作为结直肠癌的治疗靶点和发生风险评估指标,仍有待进一步研究。
1 Yuan BZ, Miller MJ, Keck CL, et al. Cloning, characterization, and chromosomal localization of a gene frequently deleted in human liver cancer (DLC-1) homologous to rat RhoGAP[J]. Cancer Res, 1998, 58 (10): 2196-2199.
2 Seng TJ, Low JS, Li H, et al. The major 8p22 tumor suppressor DLC1 is frequently silenced by methylation in both endemic and sporadic nasopharyngeal, esophageal, and cervical carcinomas, and inhibits tumor cell colony formation[J]. Oncogene, 2007, 26 (6): 934-944.
3 Ullmannova V, Popescu NC. Expression profile of the tumor suppressor genes DLC-1 and DLC-2 in solid tumors[J]. Int J Oncol, 2006, 29 (5): 1127-1132.
4 Zhou X, Zimonjic DB, Park SW, et al. DLC1 suppresses distant dissemination of human hepatocellular carcinoma cells in nude mice through reduction of RhoA GTPase activity, actin cytoskeletal disruption and down-regulation of genes involved in metastasis[J]. Int J Oncol, 2008, 32 (6): 1285-1291.
5 Veronese A, Lupini L, Consiglio J, et al. Oncogenic role of miR-483-3p at the IGF2/483 locus[J]. Cancer Res, 2010, 70 (8): 3140-3149.
6 Liao YC, Lo SH. Deleted in liver cancer-1 (DLC-1): a tumor suppressor not just for liver[J]. Int J Biochem Cell Biol, 2008, 40 (5): 843-847.
7 Lukasik D, Wilczek E, Wasiutynski A, et al. Deleted in liver cancer protein family in human malignancies (Review)[J]. Oncol Lett, 2011, 2 (5): 763-768.
8 Durkin ME, Yuan BZ, Zhou X, et al. DLC-1: a Rho GTPase-activating protein and tumour suppressor[J]. J Cell Mol Med, 2007, 11 (5): 1185-1207.
9 Banaudha K, Kaliszewski M, Korolnek T, et al. MicroRNA silencing of tumor suppressor DLC-1 promotes efficient hepatitis C virus replication in primary human hepatocytes[J]. Hepatology, 2011, 53 (1): 53-61.
10 Pacurari M, Addison JB, Bondalapati N, et al. The microRNA-200 family targets multiple non-small cell lung cancer prognostic markers in H1299 cells and BEAS-2B cells[J]. Int J Oncol, 2013, 43 (2): 548-560.
11 Cui H, Horon IL, Ohlsson R, et al. Loss of imprinting in normal tissue of colorectal cancer patients with microsatellite instability[J]. Nat Med, 1998, 4 (11): 1276-1280.
