苄氯法合成α-AlH3及其表征①
2014-09-07马晶芬曹一林朱朝阳王素芳何金选哈恒欣
马晶芬,曹一林,朱朝阳,王素芳,何金选,哈恒欣
(中国航天科技集团公司四院四十二所,襄阳 441003)
苄氯法合成α-AlH3及其表征①
马晶芬,曹一林,朱朝阳,王素芳,何金选,哈恒欣
(中国航天科技集团公司四院四十二所,襄阳 441003)
在乙醚-甲苯混合溶剂中,苄基氯和LiAlH4反应生成AlH3乙醚络合物。此络合物在甲苯介质中脱醚得到α-AlH3。通过X射线衍射、元素分析、扫描电镜及热分析,对样品进行表征。测试结果表明,此方法得到的α-AlH3晶体纯度高,Cl含量低,形貌完整,颗粒均匀,产物的热力学性能优良。
无机化学;α-AlH3;合成;晶型品质
0 引言
AlH3的含氢量高达10%,在推进剂领域被视为最有发展潜力的含能燃料, 在含二硝酰胺铵(ADN)的固体推进剂配方中添加α-AlH3,可使其标准理论比冲提高到2 940 kN·s/kg,比传统推进剂高出20%~25%[1]。AlH3晶型有7种(即α、α'、β、γ、δ、ε、ζ),其中α-AlH3最稳定,是最有可能应用于固体推进剂的AlH3品种[2]。α-AlH3的合成方法和反应工艺是决定产品品质的关键[3-5],产品品质直接决定了其在固体推进剂配方中的表现。而最近国内外开发的一些AlH3制备方法,几乎都存在晶型不纯、表面或内部缺陷多等问题,得不到符合固体推进剂使用性能要求的α-AlH3产品。
传统AlH3合成方法[6-10]中采用的主要原料之一为AlCl3,通过其Cl-与LiAlH4中的Li+生成在乙醚-甲苯溶剂中几乎不溶的LiCl,从而除去体系中的Li+。
但AlCl3本身稳定性较差,常含有一些其他的金属杂质(Ti、Ca等),储存过程中会出现发黄和吸湿等现象,与LiAlH4反应时易发生副反应,所生成的副产物AlHCl2、AlH2Cl可混杂残留在晶格和晶体表面,导致出现产品不纯和晶体缺陷,影响晶体的品质。
本文尝试采用有机苄氯替代AlCl3做氯源,原因在于其不会形成含氯中间产物,本身也不会残留在晶体表面或进入AlH3晶格中,可有效保障晶体结构完整性。
1 实验
1.1 实验原料与仪器
试剂:LiAlH4(≥97%),Alpha Aesar公司;苄氯,分析纯,国药公司;无水乙醚(99.5%)、甲苯(99.5%)、盐酸,分析纯,西陇化工公司。
仪器:Vario ELШ型元素分析仪,Elementar公司;JSM 26360LV型扫描电镜,日本株式会社;差热-热重连用仪SDT Q600,美国TA公司;D8 Advance型衍射仪,德国Bruker Ax公司。
1.2 晶体的制备
在惰性气体保护下,将苄氯(或AlCl3)含量为0.75 mol/L (0.25 mol/L)的乙醚甲苯(体积比为1∶1)溶液250 ml,LiAlH4含量为0.8 mol/L的乙醚甲苯(体积比1∶1)溶液250 ml依次加入到圆底烧瓶中,降温至20 ℃以下反应30 min,析出黑灰色沉淀,过滤取清液,在60~100 ℃的甲苯溶液中脱醚,瓶底析出白色晶体,反应至无乙醚蒸出。最后,将结晶溶液降温,过滤干燥得到样品。对样品进行元素分析、SEM、XRD及热力学性能的表征。
苄氯法、AlCl3法反应式分别如下:
LiAlH4+C7H7Cl+xEt2O→AlH3·xEt2O +
LiCl+C7H8→AlH3+xEt2O
LiAlH4+AlCl3+xEt2O→AlH3·xEt2O +LiCl
→AlH3+xEt2O
2 结果与讨论
2.1α-AlH3形貌
图1为2种方法α-AlH3的SEM图片对比。

(a )AlCl3法 (b)苄氯法图1 2种方法α-AlH3的SEM图片对比
从电镜照片可发现,由AlCl3合成的晶体颗粒粒径分散度大,形貌不规则,晶粒出现明显的团聚,且晶体表面不光滑,晶面生长不完整,与α晶态的理想形貌相差甚远。
以苄氯为原材料合成的晶粒无团聚现象,大小均匀,基本无碎晶,粒径分布集中(均在50~100 nm),且大部分晶粒形状为立方体或接近立方体,棱角较为清晰,晶面生长完整,与晶体的理想形貌非常接近。
图2为本研究产品与国外[9]α-AlH3的SEM图片对比。从电镜照片看出,国外产品晶体表面存在明显孔隙,苄氯法产物也存在这个问题,推测其成因有以下两方面:
(1)此现象出现于结晶阶段,结晶的原理为络合物在甲苯溶液中分解,分解产生的乙醚可溶于甲苯溶液,而后因为乙醚的沸点较低(34.5 ℃),故被蒸出,分解所得的AlH3不溶于甲苯溶液并首先以γ晶态析出,并在甲苯液中受热转化为α晶态。若此时条件控制不佳,会使得部分γ晶态无法转变为α晶态,而出现立方颗粒的晶面上环绕生长有针状的晶体的现象,在后期处理的过程中,γ晶态由于稳定性较差发生分解,故在α晶态的晶体表面留下一些孔隙。
(2)晶体形成后,由于内部结构不完整(晶体结构中掺杂了Cl、C等原子),晶体生长受影响,出现结晶内部结构坍塌,从而出现明显的孔隙。
后期需要对孔隙成因及特征作深入研究,以指导更高品质晶体的合成。

(a) 国外AlCl3法[9] (b)本研究苄氯法产品图2 本研究产品与国外产品的SEM图片对比
2.2α-AlH3元素含量
图3为X射线衍射图谱,其中最强的衍射峰出现在27.7°,为AlH3的(012)晶面产生,(104)及(110)晶面产生的衍射峰强度接近,分别在38.4°及40.5°出现,(202)、(024)、(116)、(122)、(214)等晶面的衍射峰位置均与标准图谱一致。可见,所合成的产物为α-AlH3。

图3 X射线衍射谱
图4为苄氯法所得产物的红外光谱分析。由图4可见,3个主要的吸收峰分别出现在1 718 、873 、673 cm-1,与标准图谱一致。
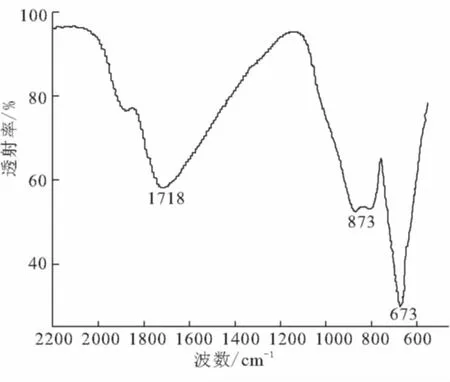
图4 α-AlH3红外光谱分析
表1为α-AlH3元素含量分析的结果,晶体中含量最高的元素为H和Al,由于原材料影响,产物中含有一定量的Cl,晶体在制备及稳定化过程中,有少量的C元素和O元素掺入,为了研究原材料的替换对产物中Cl元素含量的影响,对H、Al、Cl的含量进行分析。

表1 α-AlH3的元素分析
由表1可知,AlCl3法及苄氯法合成的晶体其H、Al含量都接近理论值,但在相同的实验条件下,苄氯法合成的产物中Cl元素的含量和AlCl3法合成的产物相比,有显著的降低。
2.3α-AlH3热性能
通过恒温失重测试以及差热分析(DSC),对产物进行热力学性能的表征。在氮气氛围下,进行恒温失重实验,以升温速率为2 ℃/min升温至100 ℃,恒温10 h,使用AlCl3法合成的晶体热失重0.574 %,苄氯法合成的晶体热失重0.138 %(图5)。可见,苄氯法产物的储存稳定性有明显提升。
图6为α-AlH3的DSC曲线。此实验在氮气氛围下进行,升温速率为20 ℃/min,样品发生分解而不发生氧化。对3组共6个样品做了分析,其结果均比较相似,图7取其中一组样品的分析结果作说明。A样为苄氯法产物,B为AlCl3法产物。
由图6可见,α-AlH3的分解为一吸热的过程,样品A起始分解温度及分解速率最大时的温度分别在195 ℃及208 ℃位置出现,而样品B的这2个温度点分别在191 ℃及204 ℃左右。可见,在相同的条件下,苄氯法合成的产物分解反应相比AlCl3法略有推迟,可推测苄氯法产物的晶体质量有所提升,因而高温下的热稳定性有一定的提升。

图5 α-AlH3的TG曲线

图6 α-AlH3的DSC曲线(20 ℃/min)
3 结论
(1)以苄基氯为反应原材料,经过低温下络合物的生成,高温下络合物脱乙醚,结晶过滤后,得到了α-AlH3。
(2)采用苄氯法合成的α-AlH3具有高纯度、低Cl量、形貌较完整、颗粒均匀度高的优点。
(3)与AlCl3法产物相比,苄氯法可得到更高质量的晶体,因而具有更好的常温和高温热力学性能。
[1] Max Calabro.Selection of reference missions and definition of propellant requirements[R].FOI-2010-1487.
[2] 张志国,何伟国,赵传富,等. 三氢化铝制备工艺及稳定性研究进展[J].化学推进剂与高分子材料,2010,8(2):11-14.
[3] Eisenreich N,Weriser V,Koleczko A,et al.On the oxidation of AlH3as a component to be used in rocket propellants[C].Thirol. European Combustion Meeting,2007.
[4] Bakum S I,Kuznetsova S F,Kuznetsov N T.Method for the preparation of aluminum hydride[J].Russian Journal of Inorganic Chemistry,2010,12 (55):1830-1832.
[5] 朱朝阳,马煜,张素敏,等. 杂质晶型对AlH3样品稳定性和安全性影响的研究[J].含能材料,2011,19(7):637-640.
[6] Kato T,Nakamori Y,Orimo S,et al.Thermal properties of AlH3-etherate and its desolvation reaction into AlH3[J].Alloys and Compounds,2007,446-447:276-279.
[7] Gary K Lund,Michael W Lesley,Jami Hanks.Characterization and synthesis of alpha alane[C]//37thInternational Annual Conference of ICT.Germany:Kalsruhe,2006,142:1-11.
[8] Bulychev B M,Verbetskii V N,Sizov A I,et al.Non-solvated aluminum hydride, crystallization from diethyl ether-benzene solutions[J].Russian Chemical Bulletin,2007,56(7):1305-1312.
[9] Graetz J,Reilly J J.Aluminum hydride as a hydrogen and energy storage material: Past, present and future[J].Alloys and Compounds,2010,11(114).
[10] Petrie Mark A,Bottaro Jeffrey C,Schmitt Rorbert J,et al.Preparation of aluminum hydride polymorphs,particular stabilizedα-AlH3[P].US 6228338,2001.
(编辑:薛永利)
Synthesis ofα-AlH3with benzyl chloride and its characterization
MA Jing-fen,CAO Yi-lin,ZHU Zhao-yang,WANG Su-fang,HE Jin-xuan,KA Heng-xin
(The 42nd Institute of the Fourth Academy of CASC,Xiangyang 441003, China)
AlH3ether complex was synthesized by reacting LiAlH4with benzyl chloride,andα-AlH3was obtained by deremoval of diethyl-ether of AlH3ether in toluene.The obtainedα-AlH3was characterized by XRD,elemental analysis,SEM and thermal analysis.The crystal presents complete morphology,high particle uniformity,high purity,low chlorine content and high thermal stability.
inorganic chemistry;α-AlH3;synthesis;crystal quality
2013-10-28;
2013-11-28。
总装预研项目(51328050203)。
马晶芬(1989—),女,硕士,研究方向为AlH3的合成及稳定化处理。E-mail:jingfenma@sina.com
V512
A
1006-2793(2014)05-0650-03
10.7673/j.issn.1006-2793.2014.05.012
