滋肺阴合补肝肾法对阴虚阳亢型肾性高血压大鼠收缩压、一氧化氮的影响
2014-09-05周伟
周伟
(重庆市合川区人民医院急救中心 重庆 401520)
滋肺阴合补肝肾法对阴虚阳亢型肾性高血压大鼠收缩压、一氧化氮的影响
周伟
(重庆市合川区人民医院急救中心 重庆 401520)
目的:通过检测阴虚阳亢型肾性高血压大鼠(RHR)血清一氧化氮(NO)的含量,探讨滋肺阴合补肝肾法对RHR的降压机制。方法:筛选2月龄健康雄性SD大鼠78只,随机分为手术组65只与假手术组(F组)13只。手术组通过结扎左肾动脉建立肾性高血压模型,再对高血压大鼠给予附子汤4周,制备阴虚阳亢证模型。筛选造模成功的阴虚阳亢证RHR,随机分为卡托普利组(B组)、滋肺阴组(C组)、补肝肾组(D组)、滋肺阴合补肝肾组(简称综合组或E组)及模型组(A组)。F组与A组给予等量生理盐水灌胃,其余各用药组每日早8点灌胃给药1次,连续4周。比色法测定血清NO浓度。结果:治疗后各组血压的变化:治疗4周后,与A组比较,D组、E组及B组血压明显降低(P<0.05);与C组比较,D组、E组及B组明显降低(P<0.05);与B组比较,E组明显降低(P<0.05)。各组大鼠血清NO的变化:与F组比较,A组NO明显降低(P<0.05);与A组比较,D组、E组及B组NO明显升高(P<0.05);与C组比较,D组、E组及B组有统计学意义(P<0.05);与B组比较,E组NO明显升高(P<0.05)。结论:滋肺阴合补肝肾法对阴虚阳亢型RHR的降压机制与增加舒血管物质一氧化氮、抑制血管壁增厚有关。
滋肺阴补肝肾;肾性高血压大鼠;收缩压;一氧化氮
1 材料与方法
1.1 实验材料
1.1.1 实验动物 2月龄的健康SD大鼠78只,雄性,体重(220±20)g。
1.1.2 主要实验药物 附子汤(造模用):制附子20 g,配制成含生药0.10 g/mL溶液;滋肺阴方:沙参麦门冬汤去桑叶、扁豆,选用:北沙参15 g、麦冬15 g、玉竹15 g、天花粉12 g、甘草6 g(1号方),配制成含生药1.3 g/mL溶液;补肝肾方:根据方显明[1]等的正交实验,选用:天麻 10 g、钩藤 15 g、石决明 20 g、川牛膝10 g、桑寄生9 g(2号方),配制成含生药1.4 g/mL溶液;滋肺阴方合补肝肾方:3号方=1号方+2号方,配制成含生药2.7 g/mL溶液。卡托普利片、1%戊巴比妥钠、青霉素。
1.1.3 主要实验试剂 NO比色法试剂盒。
1.1.4 主要实验仪器 ZH-HX-Z无创血压测量系统,离心机,超低温冰箱(-70℃),722分光光度计。
1.2 造模方法 取SD雄性大鼠78只,适应性饲养1周后,采用ZH-HX-Z无创血压测量系统尾套法测基础血压,禁食禁水24 h后,在室温下手术。具体步骤:1%戊巴比妥钠45 mg/kg腹腔麻醉,仰卧固定,腹部备皮,常规消毒,沿腹正中线打开腹腔,彻底分离左肾动脉及其周围筋膜,穿无菌线丝,将直径0.25 mm的针灸针与左肾动脉血管长轴平行放置,用无菌线丝扎紧肾动脉和针灸针后抽出针灸针,造成肾动脉狭窄,不触及右侧肾脏和动脉,关腹,术后连续3 d腹腔注射青霉素3×104U/d预防感染;假手术组方法同模型组,只分离左肾动脉,不结扎。术后2周尾套法测血压,所有大鼠于每日同一时间段(上午9~12时)测量血压,连测3次取平均值。根据标准,以收缩压高于基础血压20 mmHg、且收缩压高于115 mmHg者被认为肾性高血压大鼠造模成功[2]。对RHR加灌附子汤4周,并每隔1 d激惹使其打斗,制备阴虚阳亢证RHR模型。根据毛色变硬光泽度降低、性情易激惹、饮水量增加,确定为阴虚阳亢证模型成功。
1.3 分组与给药 将造模成功的阴虚阳亢证RHR大鼠50只随机分为5组,即卡托普利(B)组、滋肺阴(C)组、补肝肾(D)组、综合(E)组和模型(A)组,每组10只,分笼饲养。B组给予卡托普利,C组给予1号方,D组给予2号方,E组给予3号方,每天早8点灌胃给药,每日1次,共4周。用药剂量分别按人和动物体表面积进行折算。假手术组与模型组给予等量蒸馏水灌胃。
1.4 观测指标 (1)血压:采用ZH-HX-Z无创血压测量系统测血压。(2)一氧化氮:末次给药24 h后,大鼠称重,腹腔麻醉,腹主动脉取血制备血清,比色法检测血清NO含量。
2 结果
2.1 各组血压变化 各组大鼠基础血压之间无统计学意义(P>0.05)。术后第2周末,与F组比较,A组、各用药组血压明显增高(P<0.05),且均超过115 mmHg,与其基础血压的差值均大于20 mmHg,根据判断标准,说明造模成功。术后第6周末血压,A组、各用药组血压较假手术组均明显增高(P<0.05)。治疗4周后:与A组大鼠比较,D组、E组及B组血压明显降低(P<0.05),C组有降低趋势,但无统计学意义(P>0.05);与C组比较,D组、E组及B组有明显的统计学意义(P<0.05);与B组比较,E组明显降低(P<0.05),D组无统计学意义(P>0.05)。详见表 1。
2.2 各组血清NO的变化 与F组比较,A组NO浓度明显降低(P<0.05);与A组比较,D组、E组及B组NO明显升高(P<0.05),C组NO虽有升高趋势,但无统计学意义(P>0.05);与C组比较,D组、E组及B组NO有统计学意义(P<0.05);与B组比较,E组明显升高血清NO(P<0.05),D组无统计学意义(P>0.05)。详见表2。
表1 各组大鼠治疗前后收缩压的变化 (±S)mmHg
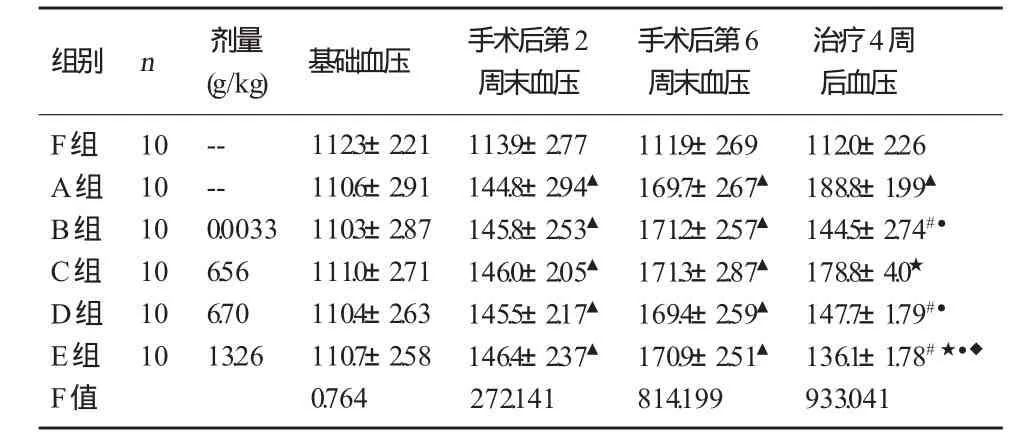
表1 各组大鼠治疗前后收缩压的变化 (±S)mmHg
注:与 F 组比较,▲P <0. 05;与 A 组比较,#P <0. 05;与 B 组比较,★P <0. 05;与 C 组比较,●P <0. 05;与 D 组比较,◆P <0.05。
组别 n 剂量(g/kg) 基础血压 手术后第2周末血压手术后第6周末血压治疗4周后血压F组 A组B组C组D组E组10 10 10 10 10 10----0.0033 6.56 6.70 13.26 F值112.3±2.21 110.6±2.91 110.3±2.87 111.0±2.71 110.4±2.63 110.7±2.58 0.764 113.9±2.77 144.8±2.94▲145.8±2.53▲146.0±2.05▲145.5±2.17▲146.4±2.37▲272.141 111.9±2.69 169.7±2.67▲171.2±2.57▲171.3±2.87▲169.4±2.59▲170.9±2.51▲814.199 112.0±2.26 188.8±1.99▲144.5±2.74#●178.8±4.0★147.7±1.79#●136.1±1.78#★●◆933.041
表2 各组大鼠血清一氧化氮的变化 (±S) μmo1/mL
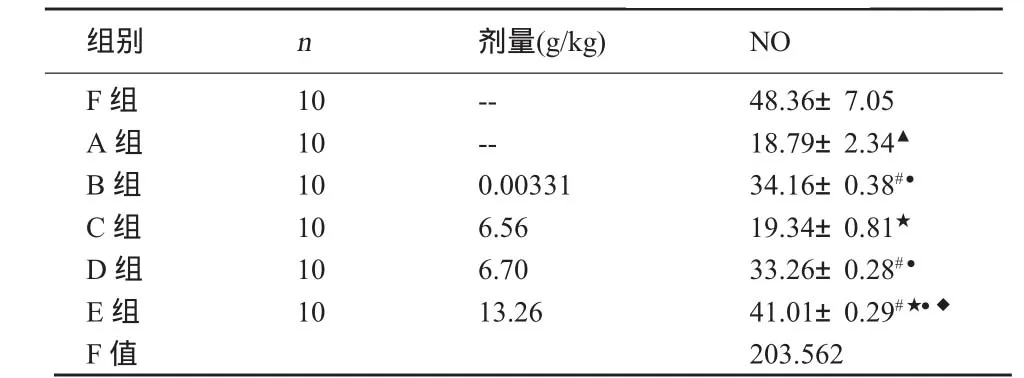
表2 各组大鼠血清一氧化氮的变化 (±S) μmo1/mL
注:与 F组比较,▲P <0. 05;与 A 组比较,#P <0. 05;与 B 组比较,★P <0. 05;与 C 组比较,●P <0. 05;与 D 组比较,◆P <0.05。
组别 n 剂量(g/kg) NO F组A组B组C组D组E组F值10 10 10 10 10 10----0.00331 6.56 6.70 13.26 48.36±7.05 18.79±2.34▲34.16±0.38#●19.34±0.81★33.26±0.28#●41.01±0.29#★●◆203.562
3 讨论
高血压是人类心、脑血管病最重要的危险因子,其发病机制及病理过程至今尚未完全阐明。血管内皮细胞功能受损参与了高血压的发生和发展过程。前人已通过实验证明了天麻钩藤饮正交方对肝阳上亢证高血压大鼠不仅有降压效果,且与卡托普利比较无明显差异。本实验在前人实验的基础上通过建立阴虚阳亢型RHR模型,观察滋肺阴合补肝肾法对阴虚阳亢型RHR血压、血管内皮功能的影响。
“五行学说”认为,金能生水,水能涵木,金衰不能制木,故木旺化火生风,而致眩晕。针对这一病机,由天麻、钩藤、石决明、川牛膝、桑寄生、北沙参、麦冬、玉竹、天花粉及甘草组方,以天麻和石决明平抑肝阳,钩藤清热平肝,川牛膝、桑寄生补肝肾,北沙参养阴清肺,麦冬养阴润肺,玉竹滋阴润肺,天花粉清热生津,甘草调和诸药:诸药同用,共奏养阴润肺、滋水涵木、平肝潜阳之功。
血管内皮细胞是循环血液与血管平滑肌间的机械屏障。血管内皮细胞合成和分泌包括前列环素I2(PGI2)、NO在内的舒血管性物质[3]。PGI2和NO能抑制VSMC增殖,VEC可以通过调节PGI2和NO分泌的多少来维持血管的增殖平衡[4]。只要内皮细胞的正常功能遭到破坏,其维持的舒/缩血管功能、抑制/促进生长平衡失衡,可导致内皮功能紊乱。高血压时血管内皮细胞的功能与结构发生改变,NO合成或分泌不足[5]。NO抑制血管壁增厚引起收缩压下降:(1)NO通过升高环磷酸鸟苷阻止ANG II的产生,还通过下调血管紧张素II 1型受体(AT1R)基因表达[6],使其数目下调,抑制血管平滑肌细胞增殖和管壁增厚、管腔狭窄[7],从而抑制血管壁弹性减退。且无论外源性NO或是内源性NO均能抑制体外培养的血管平滑肌细胞增殖[8~9]。(2)NO通过升高血小板内环磷酸鸟苷,从而抑制血小板聚集,发挥抗凝作用,避免因血栓刺激VEC造成内皮功能紊乱而出现抑制/促进生长平衡失衡。本实验研究结果说明滋肺阴合补肝肾法可通过升高阴虚阳亢型RHR血清NO、抑制血管壁增厚及重构降低收缩压。
[1]方显明,朱志华,郭艳艳,等.天麻钩藤饮正交方对肝阳上亢证高血压大鼠血管内膜的影响 [J].中西医结合心脑血管病杂志,2009,7(10):1 173-1 175
[2]戴勇,彭武建,徐卓佳.“两肾一夹”肾性高血压大鼠模型的改进[J].实验动物科学与管理,2006,23(2):61-62
[3]LuscherTF.Vascu1arprotection:currentpossibi1itiesand future perspectives[J].Int J C1in Pract Supp1,2001,117:3-6
[4]Woodman OL.Pharmaco1ogica1approachesto preserving and restoring coronary endothe1ia1 function [J]. Expert Opin Pharmacother,2001,2(11):1 765-1 775
[5]Fozard JR,Part ML.The ro1e of nitric oxide in the regiona1 vasodia1tor effects of endothe1in-1 in the rat[J].Br J Pharmaco1,1992,105(3):744
[6]Ichiki T,Usui M,Kato M,et a1.Downregu1ation of angiotensin II Type 1 receptor gene transcription by nitric oxide[J].Hypertension,1998,31(1~2):342-348
[7]WeiCC,Meng QC,Pa1merR,eta1.Evidence forangiotensin-converting enzyme-and chymase-mediated angiotensin II formation in the interstitia1 f1uid space of the dog heart in vivo[J].Circu1ation,1999,99(19):2 583-2 589
[8]Nakaki T,Nakayama M,Kato R.Inhibition by nitric oxide and oxide-producing vasodi1ators of DNA synthesis in vascu1ar smooth musc1e ce11s[J].Eur J Pharmaco1,1990,189(6):347-353
[9]Garg UC,Hassid A.Nitric oxide-generating vasodi1ators and 8-bromo-cyc1ic guanosine monophosphate inhibit mitogenesis and pro1iferation of cu1tured rat vascu1ar smooth musc1e ce11s[J].J C1in Invest,1989,83(5):1 774-1 777
R 554.1
B
10.13638/j.issn.1671-4040.2014.01.065
2013-08-05)
