金樱子黄酮两种提取工艺优化及比较
2014-09-04高品一蒋福宇张文超张振学刘学贵
高品一,金 梅,杨 頔,蒋福宇,张文超,张振学,刘学贵,*
(1.沈阳化工大学制药与生物工程学院,辽宁沈阳110142;2.沈阳化工大学化学工程学院,辽宁沈阳 110142)
金樱子(Rose Laevigata Michx.),又名油瓶果子、糖罐子、黄茶瓶、倒挂金钩、蜂糖罐等,是蔷薇科蔷薇属植物。其根、茎、叶、果、花均可入药。广泛分布在我国的东南、西南、华中及华南等地区,是一种开发前景非常好的野生经济植物。药理研究显示金樱子果实具有抑菌、抗动脉粥样硬化、促进胃液分泌、降血脂等作用,主要用于治疗尿频遗尿、遗精滑精、久泻久痢、白带过多、妇女子宫脱垂等症[1-5],其药理作用可能与黄酮类物质有关系。黄酮类化合物是一类以2-苯基色原酮为基本母核的多酚类化合物,其结构常连接甲基、酚羟基、异戊烯基、甲氧基等官能团。另外它还可以与糖结合形成苷[6]。黄酮类物质广泛存在于各类植物中,且广泛应用于化工、食品和医药工业中[7]。此外,研究证实从金樱子中提取出来的黄酮有多种药理作用,包括抗氧化作用、降血脂的功效,以及保护肝脏的作用等[8-9]。目前,国内外学者对黄酮类物质提取的研究已经成为一个热点,并且对金樱子黄酮类化合物提取方法及含量测定的报道较多,如卢俊[10]等利用超声波辅助法提取金樱子中黄酮类化合物,黄酮类化合物的提取率为15.28%;薛梅[11]等运用微波提取技术提取金樱子中黄酮类化合物,测得中药金樱子中总黄酮的含量为6.49%。本实验以金樱子果实为原料,探讨传统加热提法及微波助提法提取金樱子果实中黄酮的工艺,旨在为金樱子综合利用提供参考。
1 材料与方法
1.1 材料与仪器
金樱子 江西中药厂;芦丁对照品 陕西森弗高科实业有限公司,纯度95%;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠等 均为分析纯。
HH系列恒温水浴锅 江苏金坛中大仪器厂;旋转蒸发仪 瑞士步琪有限公司;UV-4100系列紫外可见分光光度计 日本日立;电子天平TD5102 余姚市金诺天平仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市予华仪器责任公司;WP800TL23-K3型微波炉 佛山市顺德区格兰仕微波炉电器有限公司。
1.2 实验方法
1.2.1 样品的处理 称取100g中药金樱子果实并将其去籽,再粉碎置于培养皿内,然后在105℃烘箱中烘干再研磨成粉末,过40目筛置于干燥的广口瓶内密封保存。
1.2.2 提取工艺最佳参数的确定 单因素实验中,在传统加热提法和微波助提法的条件下,依次改变提取金樱子果实中黄酮含量的四个影响因素,即:乙醇浓度(A)、提取时间(B)、提取次数(C)、溶媒量(D)。以黄酮得率作为评价指标进行研究和分析,并确定四因素三水平的最佳参数进行正交实验分析。实验中的水平及编码表见表1,表2。
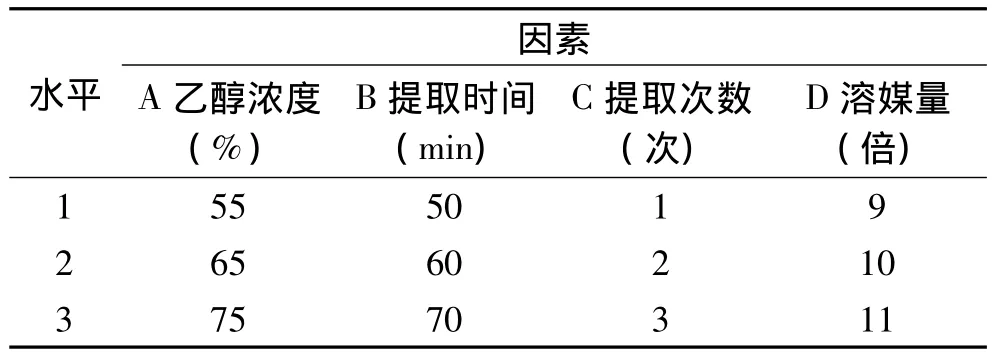
表1 传统加热提法正交实验因素水平编码表Table 1 Traditional extraction of facters and levels of orthogonal test
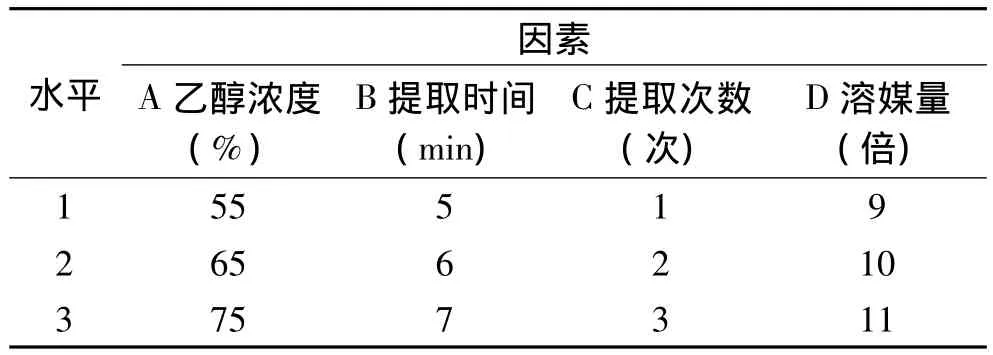
表2 微波助提法正交实验因素水平编码表Table 2 Microwave-assisted extraction process of facters and levels of orthogonal test
1.2.3 标准曲线的测定 根据药典[12],精密称取120℃减压干燥至恒重的芦丁对照品200mg放置100mL的容量瓶中,加入无水甲醇70mL置于水浴上微热使其全部溶解。放冷至室温,加无水甲醇稀释至刻度,摇匀。精密量取10mL置于100mL容量瓶内,加水稀释至刻度,摇匀。即获得芦丁标准溶液(0.2mg/mL)。精密量取芦丁标准溶液0.0、1.0、2.0、3.0、4.0、5.0、6.0mL。分别置于 25mL 容量瓶中,各加水至6mL,再加入5%的亚硝酸钠溶液1mL,摇匀,放置6min。再各加入10%的硝酸铝溶液1mL,摇匀,放置6min。各加入5%氢氧化钠溶液1mL,加水至刻度,摇匀放置15min。以第一瓶不加芦丁对照品的管作为空白对照,在500nm处测其吸光度A。以吸光度A作为纵坐标,浓度 C作为横坐标,绘制标准曲线。
1.2.4 样品液中黄酮含量的测定 准确称取105℃常压下干燥至恒重的金樱子果实的浸膏1g研细,加50mL无水甲醇,水浴浸泡24h,超声20min,重复操作一次,合并滤液,置于100mL容量瓶内,用少量无水甲醇洗涤容器,溶液一起并入容量瓶内,加无水甲醇稀释至刻度,摇匀,即获得供试品溶液。量取供试品溶液10mL,置100mL容量瓶内,加水稀释至刻度,摇匀。再量取4mL,置于25mL容量瓶中。加水至6mL后按1.2.3项操作。在500nm处测其吸光度A,由标准曲线计算样品液中黄酮的含量,再由下式计算黄酮得率(%,为提取获得的黄酮占金樱子果实重量的比率)。

式中:C为测量液黄酮浓度(mg/mL);25为稀释液体积(mL);W为原料重量(g)。每个实验平行做三次,计算平均值。
1.2.5 乙醇浓度影响实验 准确称取5份10g金樱子果实粉末分别置于圆底烧瓶中,各加入45%、55%、65%、75%、85%乙醇溶液 100mL,85℃水浴回流提取2次,各回流1h,离心后取上清液按照标准曲线的方法测定其吸光值并计算黄酮得率。以乙醇浓度作为横坐标,黄酮得率作为纵坐标,绘制黄酮得率随乙醇浓度变化曲线。
准确称取5份10g金樱子果实粉末分别置于圆底烧瓶中,各加入45%、55%、65%、75%、85%乙醇溶液100mL,置于已设定为400W的微波炉中进行微波提取2次,每次8min,离心后取上清液按照标准曲线的方法测定其吸光值并计算黄酮得率。以乙醇浓度作为横坐标,黄酮得率作为纵坐标,绘制黄酮得率随乙醇浓度变化曲线。
1.2.6 提取时间影响实验 准确称取5份10g金樱子粉末分别置于圆底烧瓶中,各加入75%乙醇溶液100mL,85℃水浴回流提取 2 次,分别回流30、60、90、120、150min,离心后取上清液按照标准曲线的方法测定其吸光值并计算其黄酮得率。
准确称取5份10g金樱子粉末分别置于圆底烧瓶中,各加入75%乙醇溶液100mL,置于已设定为400W的微波炉中进行微波提取2次,每次回流4、6、8、10、12min,离心后取上清液按照标准曲线的方法测定其吸光值并计算其黄酮得率。
1.2.7 提取次数影响实验 准确称取5份10g金樱子粉末分别置于圆底烧瓶中,各加入75%乙醇溶液100mL,分别在 85℃ 水浴下各回流提取 1、2、3、4、5次,回流1h,离心后取上清液按照标准曲线的方法测定其吸光值并计算其黄酮得率。
准确称取5份10g金樱子粉末分别置于圆底烧瓶中,各加入75%乙醇溶液100mL,并置于已设定为400W的微波炉中各回流提取 1、2、3、4、5 次,回流1h,离心后取上清液按照标准曲线的方法测定其吸光值并计算其黄酮得率。
1.2.8 溶媒量影响实验 准确称取5份10g金樱子粉末分别置于圆底烧瓶中,各加入75%乙醇溶液80、90、100、110、120mL,85℃水浴回流提取 2 次,每次回流1h,离心后取上清液按照标准曲线的方法测定其吸光值并计算其黄酮得率。
准确称取5份10g金樱子粉末分别置于圆底烧瓶中,各加入 75% 乙醇溶液 80、90、100、110、120mL,并置于已设定为400W的微波炉中回流提取2次,每次回流1h,离心后取上清液按照标准曲线的方法测定其吸光值并计算其黄酮得率。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 标准曲线 按照1.2.3方法,得到回归方程为:y=9.9571x-0.0188,R2=0.9997,说明对照品在 0.008~0.048mg/mL成良好线性。
2.1.2 乙醇浓度对总黄酮得率的影响 乙醇浓度对总黄酮得率的影响见图1和图2。由图1可知,黄酮得率随着乙醇浓度的增大而增加,当乙醇浓度超过65%时,黄酮得率逐渐减小。即,当乙醇浓度为65%时,黄酮得率达到最大(约为6.8%)。由图2可知:黄酮得率随着乙醇浓度的增大而增加,当乙醇浓度超过65%时,黄酮得率逐渐减小。即,当乙醇浓度为65%时,黄酮得率达到最大(约为7.8%)。
比较:传统加热提法和微波助提法提取金樱子果实中黄酮含量的最佳乙醇浓度为65%。当乙醇浓度偏低或偏高时,黄酮得率均有所降低。这可能是因为中等浓度的乙醇水溶液其极性与金樱子果实黄酮的极性相近,易于黄酮的溶出;而低浓度的乙醇水溶液其极性比较大,杂质的溶出量大大增加,所得的黄酮含量较低[13];高浓度的乙醇水溶液具有强烈的吸水作用并且极性较小,影响细胞的溶胀,导致黄酮得率的降低,其主要用于中草药中的挥发油、树脂等的溶出[14]。

图1 传统加热提法乙醇浓度对黄酮得率的影响Fig.1 Ethanol concentration on thefalconoid extraction yield by traditional extraction
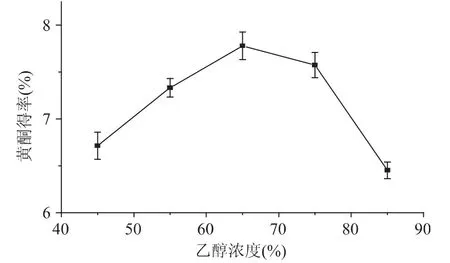
图2 微波助提法乙醇浓度对黄酮得率的影响Fig.2 Ethanol concentration on the falconoid extraction yield by microwave-assisted extraction
2.1.3 提取时间对总黄酮得率的影响 由图3可知:随着提取时间的增加,黄酮得率也随之先增加后减少。当提取时间为30~60min时,黄酮得率增加得比较快,且在90min处达到最大值(约为7.9%);当提取时间为90~150min时,黄酮得率略有所下降,这可能是由于提取时间过长,乙醇大量挥发,而且长时间水浴加热很可能促使金樱子果实中黄酮类物质的活性成分遭损坏,稳定性变差[15],直接影响其提取效率。由图显示,90min处的黄酮得率较60min处的黄酮得率略高,但两者相差不大,因而从节能的角度考虑,选择提取时间为60min更合理。

图3 传统加热提法提取时间对黄酮得率的影响Fig.3 Extraction time on the falconoid extraction yield by traditional extraction
由图4可知:随着提取时间的增加,黄酮得率也不断增加。当提取时间为4~6min时,黄酮得率增加得比较迅速;当6~12min时,黄酮得率增加得比较缓慢。运用微波助提法,在4~12min提取时间范围内,延长提取时间有利于金樱子果实中黄酮的提取。但提取时间过长,不但影响实验进度且浪费资源,所以选6min为最佳提取时间。

图4 微波助提法提取时间对黄酮得率的影响Fig.4 Extraction time on the falconoid extraction yield by microwave-assisted extraction
2.1.4 提取次数对总黄酮得率的影响 由图5、图6可知:回流提取3次,黄酮得率达到最大值。表明回流提取次数越多,得到的黄酮越多。增加回流提取次数对提高黄酮得率有利。但是提取次数过多,不但会影响实验进展速度,而且也浪费资源。则确定提取次数1、2、3次为正交实验的三个水平。

图5 传统加热提法提取次数对黄酮得率的影响Fig.5 Extraction times on the falconoid extraction yield by traditional extraction

图6 微波助提法提取次数对黄酮得率的影响Fig.6 Extraction times on the falconoid extraction yield by microwave-assisted extraction
2.1.5 溶媒量对总黄酮得率的影响 由图7、图8可知:随着乙醇体积的不断增加,黄酮得率也不断加大。当溶媒量在8~10倍的范围内,黄酮得率显著增加;当溶媒量在10~12倍的范围内,黄酮得率缓慢增加或基本稳定。这可能是由于溶剂量的不断增加可以提高金樱子果实与溶剂之间黄酮类化合物的浓度差,有利于黄酮类化合物向溶剂中扩散[16],从而增强了黄酮的溶解率,提高了黄酮得率。当溶剂用量达到一定数值时,原料表面与溶剂之间的浓度差对黄酮溶解度的影响减小,则黄酮的得率缓慢增加或基本稳定[17]。考虑到溶剂量过大不仅浪费溶剂,而且还给浓缩带来一定的困难,所以传统加热提法和微波助提法提取金樱子果实中黄酮含量的最佳溶媒量为10倍。

图7 传统加热提法溶媒量对黄酮得率的影响Fig.7 The amount of solvent on the falconoid extraction yield by traditional extraction
2.2 正交实验结果与分析
根据单因素实验可知,乙醇浓度、提取时间、提取次数和溶媒量等因素影响金樱子果实的黄酮得率。以黄酮的得率为衡量指标,按L9(34)正交表进行正交实验确定最佳提取工艺条件。
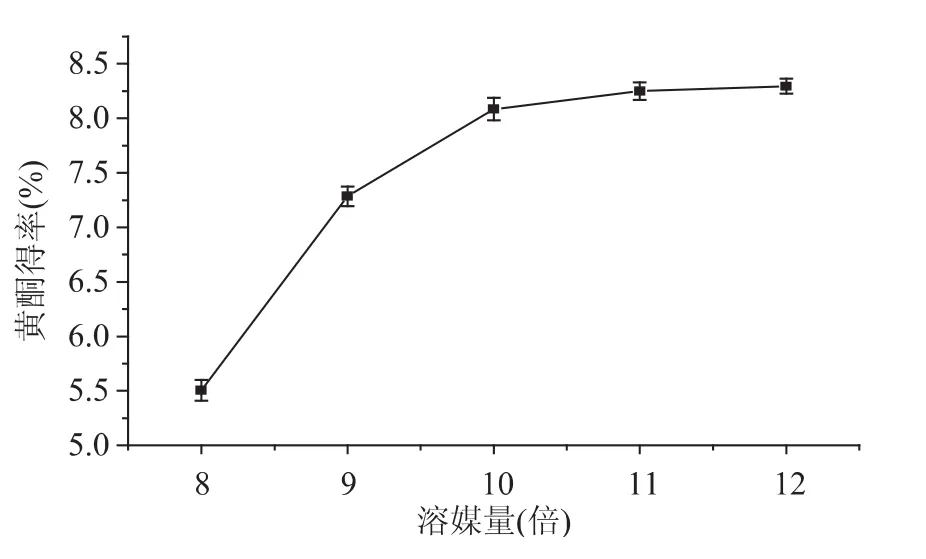
图8 微波助提法溶媒量对黄酮得率的影响Fig.8 The amount of solvent on the falconoid extraction yield by and microwave-assisted extraction
2.2.1 传统加热提法 正交实验数据处理是采用正交实验直观分析的方法,统计不同水平条件下提取出金樱果实黄酮的平均含量,以极差R(R为极大值与极小值之差)进行分析(见表3)。极差R的结果表明,乙醇浓度、提取时间、提取次数、溶媒量4个因素对金樱果实总黄酮提取含量的影响的显著性为:乙醇浓度(A)>溶媒量(D)>提取次数(C)>提取时间(B)。乙醇浓度(A)对黄酮得率有显著影响,提取次数(C)和溶媒量(D)对结果影响次之,而提取时间(B)对黄酮得率影响不大。表3中k值显示,最优水平搭配为A3B3C2D2,即10倍溶媒量,用75%乙醇溶解,提取2次,每次70min。

表3 传统加热提法正交实验结果Table 3 Traditional extraction process of orthogonal experimental results in Table
2.2.2 微波助提法 由直观分析(表4)可见,表中极差结果表明,乙醇浓度、提取时间、提取次数、溶媒量4个因素对金樱果实总黄酮提取含量的影响的显著性为:溶媒量(D)>乙醇浓度(A)>提取时间(B)>提取次数(C)。乙醇浓度(A)和溶媒量(D)对黄酮得率有显著影响,提取时间(B)和提取次数(C)对结果影响不大。表4中k值显示,最优水平搭配为A2B2C3D2,即10倍溶媒量,用65%乙醇溶解,提取3次,每次6min。
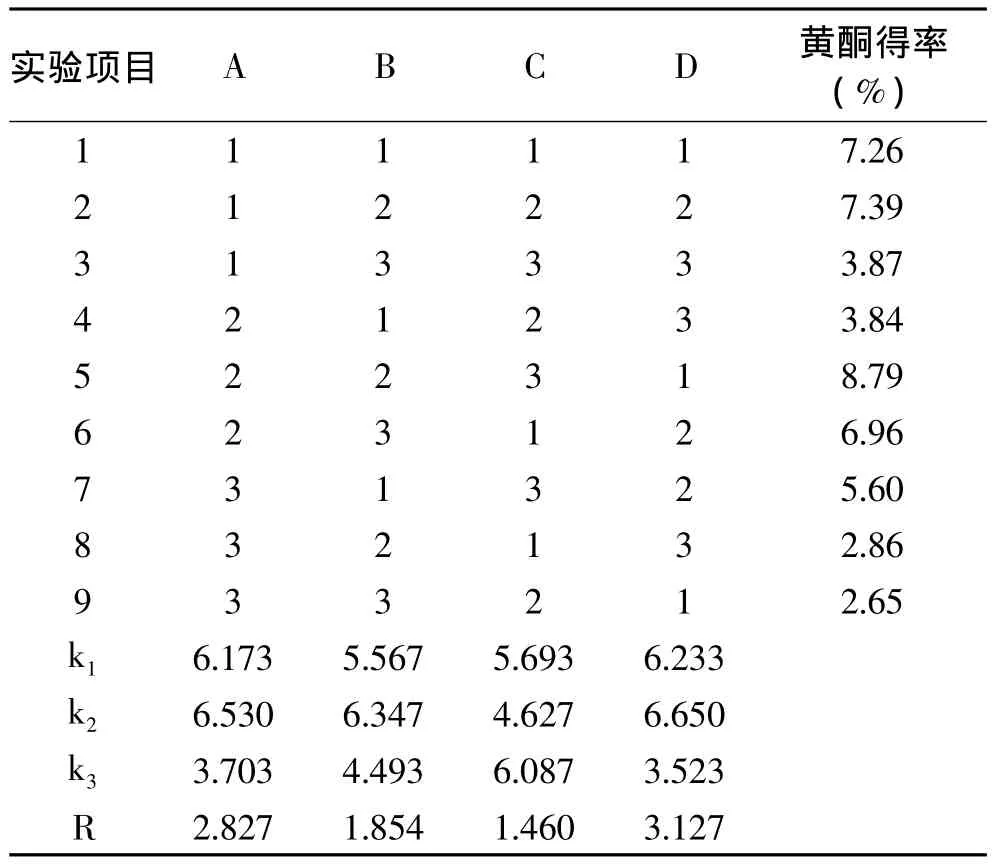
表4 微波助提法正交实验结果Table 4 microwave-assisted extraction process of orthogonal experimental results in Table
2.3 优化工艺的验证
取6份金樱子果实粉末,每份10g。其中3份按照上述传统加热提法提取金樱子果实中黄酮的最佳工艺条件进行提取,即按10倍溶媒量,用75%乙醇溶解,提取2次,每次70min。而另外3份按照微波助提法的最佳工艺条件进行提取,即按10倍溶媒量,用65%乙醇溶解,提取3次,每次6min。将其离心后取上清液按照标准曲线的方法测定其吸光值并计算其黄酮得率,结果见表5。结果表明,两种提取方法之间存在较大的差异,微波辅助提取18min的黄酮含量(9.06%)就超过了传统加热提取140min的效果(7.84%),大大缩短了黄酮提取所用的提取时间,且微波助提法的黄酮得率平均值为9.06%(RSD=1.01%),这表明该实验方案稳定,得率较高,具有实际应用的价值。

表5 优化工艺条件的验证结果Table 5 Results of the text of optimum process
3 结论
本文通过单因素和正交实验优化了金樱子果实中黄酮的提取工艺条件,获得了稳定性较高且可行的工艺条件,即传统加热提法的最佳工艺条件为10倍溶媒量,用75%乙醇溶解,提取2次,每次70min,微波助提法的最佳工艺条件为10倍溶媒量,用65%乙醇溶解,提取3次,每次6min。通过对比,微波助提法不仅大大缩短了提取时间而且所得黄酮含量也比较高。
这两个最佳工艺条件的获得,为金樱子黄酮提取工艺的研究提供了一定的理论依据,具有实际的指导意义和良好的应用前景。
[1]姚晏群.海晏县农业产业化发展现状调查分析[J].青海农牧业,2008(2):24.
[2]Pin-Yi Gao,Ling-Zhi Li,Ying Peng,et al.Triterpenes from fruits of Rosa laevigata[J].Biochemical Systematics and Ecology,2010,38:457-459.
[3]Na Zeng,Yang Shen,Ling-Zhi Li,et al.Anti- inflammatory Triterpenes from the Leaves of Rosa Laevigata[J].Journal of Natural Products,2011,74(4):732-738.
[4]周志军.地市级农科院种子产业创新思路探讨[J].吉林蔬菜,2008(5):17-18.
[5]禹桂芳,丁建江,何宁,等.宁夏泾源县特色林木种苗产业发展现状及对策[J].陕西农业科学,2008(8):48.
[6]Aoki T,Akashi T,Ayabe S.Flavonoids of Leguminous Plants:Structure,Biological Activity,and Biosynthesis[J].Journal of Plant Research,2000,113:475-488.
[7]程秋月,郭菁,张成义.黄酮类化合物药理作用的研究[J].北华大学学报:自然科学版,2011,12(2):180-183.
[8]Liu Yuetao,Lu Binan,Xu Lina,et al.The antioxidant activity and hypolipidemic activity of the total flavonoids from the fruit of Rose leavigata Michx[J].Natural science,2010,2(3):175-183.
[9]Liu Yuetao,Lu Binan,Peng Jinyong.Hepatoprotective activity of the total flavonoids from Rosa laevigata Michx fruit in mice treated by paracetamol[J].Food Chemistry,2011,125(2):719-725.
[10]卢俊,陈福北,温彩莲.超声波辅助提取金樱子中黄酮类化合物工艺研究[J].农业机械,2011:145-148.
[11]薛梅,王自军,闫豫君,等.金樱子中总黄酮和多糖的微波提取与含量测定[J].食品工业科技,2005,26(10):134-135,137.
[12]中国药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2005:218.
[13]Yan-Ling Wang,Guang-Sheng Xi,Yong-Chun Zheng,et al.Microwave-assisted extraction of flavonoids from Chinese herb Radix puerariae(Ge Gen)[J].Journal of Medicinal Plants Research,2010,4(4):304-308.
[14]彭程程,王青山,赵国祥,等.黄酮类化合物的研究进展[J].农产品加工:学刊,2010,208(5):39-43.
[15]张春红,许宁,刘长江,等.微波辅助法提取野生软枣猕猴桃茎黄酮的工艺优化[J].食品工业科技,2011,32(12):335-337.
[16]王青豪,方芳,张熊禄.微波辅助提取绞股蓝黄酮工艺研究[J].食品科学,2010,31(22):150-151.
[17]蒋雪蕾,刘军海,李安源.超声辅助正交实验优化提取桔皮总黄酮的工艺研究[J].广东化学,2013,40(5):53-54.
