交联海藻酸钠固定化柚(皮)苷酶
2014-09-04雷生姣潘思轶
雷生姣,潘思轶
(1.三峡大学化学与生命科学学院,湖北宜昌443002;2.华中农业大学食品科技学院,湖北武汉430070)
海藻酸(Alginate)作为一种重要的海洋生物资源,是从海带、马尾藻等褐藻类植物中提取的天然多糖高分子共聚物,来源丰富,其安全性已经长期使用证实[1]。海藻酸钠为海藻酸的钠盐,是一种化学物质,具有可降解性和易于加工成膜性[2],属环境友好型载体材料。这些独特物理化学性能赋予了海藻酸钠非凡的应用价值,近几十年来,海藻酸钠在食品加工[3]、纺织工业[4]、生物医学[5-6]与环境保护[7]等领域中都获得了广泛应用,并显示出良好的应用前景。海藻酸钠的凝胶化过程即聚合物的交联,主要是古洛糖醛酸上的钠离子与二价阳离子交换的过程。二价阳离子有助于把分子聚集在一起,而分子聚合的本性和它们的聚合更加固了约束的阳离子,即两者具有协同结合作用[8-9]。海藻酸钠凝胶作为酶固定化的载体具有很多优点:凝胶具有很强的亲水性,能为酶提供适宜的微环境,使固定化酶呈现出与游离酶相似的行为;载体本身具有极好的生物相容性,固定化凝胶的制备过程简单,条件温和;凝胶具有较大孔径,酶分子与底物和产物具有较高的扩散速率,酶促反应不受扩散限制,是应用较广的固定化载体。本文以海藻酸钠为载体固定化柚(皮)苷酶,考察固定化过程中的各因素(海藻酸钠质量分数、酶液质量浓度、戊二醛体积分数、交联时间等)对固定化酶活力的影响;同时,对固定化柚(皮)苷酶的使用特性进行研究,为固定化柚(皮)苷酶的工业化应用提供理论依据。
1 材料与方法
1.1 材料与仪器
柚(皮)苷酶,活力 359U/g 购于 sigma-Aldrich,美国公司;98%柚皮苷,HPLC 购于sigma-Aldrich,美国公司;海藻酸钠 上海化学试剂分装厂;氢氧化钠(分析纯)天津市瑞金特化学品有限公司;其他化学试剂均为分析纯。
pH计 西德Knick公司;3000型紫外-可见分光光度计 上海光谱仪器有限公司;JA12002电子天平 上海天平仪器厂;SHA-BA双功能水浴恒温振荡器 金坛市杰瑞尔电器有限公司;HH2型电热恒温水浴锅 常州国华电器有限公司;DHG-06-200B型电热恒温鼓风干燥箱 武汉海声达仪器设备有限公司。
1.2 实验方法
1.2.1 游离柚(皮)苷酶与海藻酸钠固定化柚(皮)苷酶活力的测定 游离柚(皮)苷酶与固定化柚(皮)苷酶活力测定方法参照 Lei等文章[10-11]。
游离酶活力测定:5mL具塞试管中加入0.6mL底物柚皮苷(500μg/mL)和 0.3mL醋酸缓冲液(0.2mol/L,pH4.0),在 60℃的恒温水浴锅中保温5min后立即加入0.1mL柚苷酶液(2.0mg/mL)(0.2mol/L,pH4.0),置 入 60℃ 的 恒 温 振 荡 器(150r/min)中准确反应30min;取出反应液,添加4mL蒸馏水和4.9mL 90%(体积分数)一缩二乙二醇(DEG),40℃恒温水浴锅中预热 3~5min,再加入4.0mol/L NaOH 0.1mL,充分摇匀,在水浴锅中保温发色10min;取出注入1cm比色皿内,用紫外分光光度计在420nm处测定吸光值,通过柚皮苷标准曲线计算酶活力。
固定化酶活力测定:方法与游离酶活力测定基本相同,只需将酶液用1g固定化酶凝珠代替,将0.3mL缓冲液添加至0.4mL即可,其他均相同。
酶活力定义(U):在测定条件下(60℃,pH4.0),每分钟消耗1μg柚皮苷所需的酶量为一个酶活力单位。
酶的比活力:在测定条件下(60℃,pH4.0),单位质量酶分子所表现出的酶活力。
1.2.2 交联-包埋-交联法制备海藻酸钠固定化柚(皮)苷酶凝珠 称取质量分数为3.0%的海藻酸钠溶液 10g,加入柚(皮)苷酶液 1.0mL(质量浓度1.0mg/mL),充分混匀后,再加入体积分数2.0%的戊二醛溶液1.0mL,充分混匀,在振荡器(150r/min)上振荡0.5h,静置交联1.5h;用5mL注射器逐滴注入不断搅拌的质量浓度4.0g/100mL CaCl2溶液中(100mL),形成光滑小球后滤出小球体,更换CaCl2溶液再静置硬化1h,滤出小球体,用缓冲液冲洗两次;再用体积分数0.025%的戊二醛溶液交联2h(100mL),滤出小球体,用缓冲液冲洗两次,用吸水纸吸干水分得固定化酶,冰箱内储存备用。
1.2.3 单因素实验 按照1.2.2确定的参数条件,每10g载体内添加酶液1mL,改变酶液质量浓度分别为0.5、1.0、1.5、2.0、2.5、3.0mg/mL,即每克载体的承载量分别为 0.05、0.10、0.15、0.20、0.25、0.30mg 酶蛋白,其他条件不变,制备固定化酶。按游离酶和固定化酶活力测定方法分别测定其活力,比较载体在不同承载量时的固定化酶活力回收率。
按照1.2.2的实验方法和单因素实验确定的适宜酶液浓度,改变前交联戊二醛溶液的体积分数(1.0%、1.5%、2.0%、2.5%、3.0%、3.5%),制备固定化酶,比较不同前交联戊二醛体积分数对固定化酶活力的影响。采用同样的实验方法,改变后交联戊二醛溶液的体积分数(0.015%、0.020%、0.025%、0.030%、0.035%),比较不同前交联时间对固定化酶活力的影响。
分别设定前交联时间为 0.5、1.0、1.5、2.0、2.5、3.0h,在前述单因素实验基础上,制备固定化酶,比较不同前交联时间对固定化酶活力的影响。采用同样的方法,改变后交联时间(1.0、1.5、2.0、2.5、3.0h),比较不同后交联时间对固定化酶活力的影响。
1.2.4 正交实验 根据单因素实验结果及相关文献报道[12],选酶液质量浓度、前交联戊二醛体积分数、前交联时间、后交联时间为影响因素,设计了4因素3水平的表1,进行L9(34)正交实验,确定最佳固定化条件。

表1 海藻酸钠固定化柚(皮)苷酶条件的L9(34)正交设计表Table 1 L9(34)Orthogonal test for immobilized naringinase in alginate sodium
1.2.5 海藻酸钠固定化柚(皮)苷酶稳定性研究 以正交实验确定的最优固定化工艺制备固定化柚(皮)苷酶凝胶,按照酶活力测定方法,分别测定游离酶与固定酶的酶活,以酶的相对活力为目标,依次考察固定化酶与游离酶的温度耐受性、储存稳定性和固定化酶的操作稳定性。
固定化酶与游离酶的温度耐受性实验采用将适量游离酶液和固定化酶置于60℃的恒温水浴锅中保温一定的时间后,取出一定量测定其活力,比较其温度耐受性。保温时间设定为15~180min。将制备好的固定化酶凝珠和同时配制的柚(皮)苷酶溶液(1.0mg/mL)分别置于棕色磨口试剂瓶中,冰箱内贮藏,每隔一定的时间测定一次游离酶和固定化酶的活力。以起始酶活值为100%,计算酶的相对活力,比较固定化酶与游离酶的储存稳定性。
在5mL的具塞试管中加入1.0g海藻酸钠溶液制备的固定化酶(27个凝珠),再加入0.6mL的底物柚皮苷溶液(500μg/mL)和0.4mL醋酸缓冲液,置于60℃的恒温振荡器(150r/min)中反应30min后,倾倒出反应液用于测定柚皮苷含量并计算酶活力;固定化酶凝珠用0.2mol/L的醋酸-醋酸钠缓冲液(pH4.0)洗涤至无反应产物残留,重新装入新鲜底物溶液进行下一批酶解反应,以此进行多次水解循环来测定固定化酶的重复使用性。
1.2.6 数据处理 所有实验均重复3次以上,采用Origin 8.0软件进行统计学分析。定量数据采用平均值±标准差(SD)表示。
2 结果与分析
2.1 海藻酸钠凝胶制备固定化柚(皮)苷酶条件优化
2.1.1 海藻酸钠载体固定化柚(皮)苷酶的承载量
给酶量对固定化酶活力和活力回收率的影响如图1所示。固定化酶活力随给酶量的增加而增加,而活力回收率随给酶量的增加而下降。当给酶量为0.1mg/g载体时,固定化酶活力与活力回收率均较高。当给酶量较低时,载体将酶分子包埋在凝胶孔隙内,酶分子与载体的活性基团结合位点多[13],大多数游离酶可结合于载体内;而且,结合的游离酶在载体孔隙内可以充分的暴露出活性基团,表现出较游离酶更高的活性,因而其活力回收率就会出现高于100%的情形;随着给酶量的上升,包埋于载体内的酶的摩尔分数逐渐下降[14],导致酶活回收率的降低。故本实验选择酶液质量浓度为1.0mg/mL,即载体承载量为0.1mg/g载体。
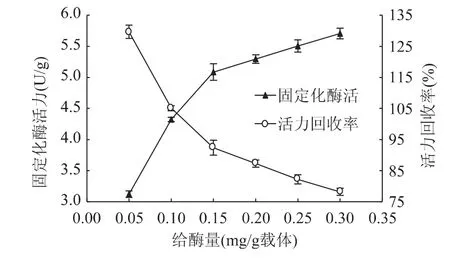
图1 给酶量对固定化酶活力和活力回收率的影响Fig.1 Effect of the amount of enzyme on immobilized enzyme activity and recovery rate of immobilized enzyme
2.1.2 前交联戊二醛体积分数对酶固定化的影响戊二醛既是交联剂,又是酶蛋白的变性剂,因此,其使用量直接影响固定化酶的活性和稳定性。图2为前交联戊二醛体积分数对固定化酶活性的影响。由图可知,当前交联戊二醛体积分数由1.0%增加到2.0%时,固定化酶的活力也随之增加;当体积分数达到2.0%时,固定化酶的活力达最高;体积分数继续增加,酶活力开始下降。但在2.0%~3.5%的戊二醛体积分数范围内,对固定化酶活力影响不是很大,相对活力均保持在90%以上。这主要是因为海藻酸钠上的活性基团为定量的,当绝大部分与交联剂结合后,只有少部分的活性基团未被结合,使得戊二醛体积分数对固定化酶相对活力影响不大。因此,本实验选用前交联戊二醛最适体积分数为2.0%。
2.1.3 前交联时间对酶固定化的影响 前交联时间对固定化酶活力的影响如图3所示。由图中可以看出,海藻酸钠固定化柚(皮)苷酶的相对活力在2.5h内随交联时间延长而增大,到2.5h时达最大;后又随着交联时间增加而缓慢降低。并且在1.5h内,固定化酶活力上升较快,这可能是因为最初海藻酸钠上的活性基团较多易于与酶分子结合;1.5h后酶活基本无明显变化。综合考虑实验的便捷和实效性,本实验选用1.5h作为最适前交联时间。
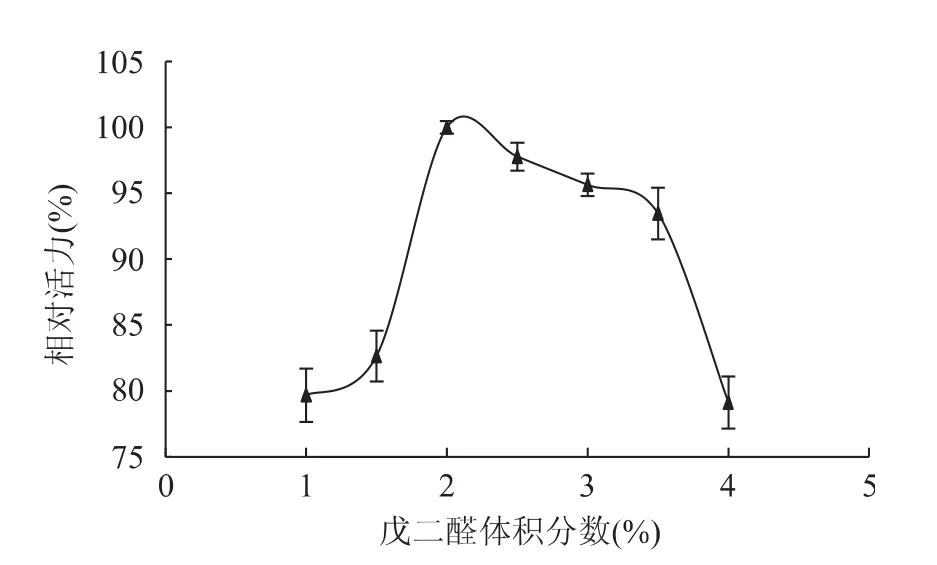
图2 前交联戊二醛体积分数对固定化酶相对活力的影响Fig.2 Effect of pre-crosslinking glutaraldehyde volume fraction on relative activity of immobilized naringianse
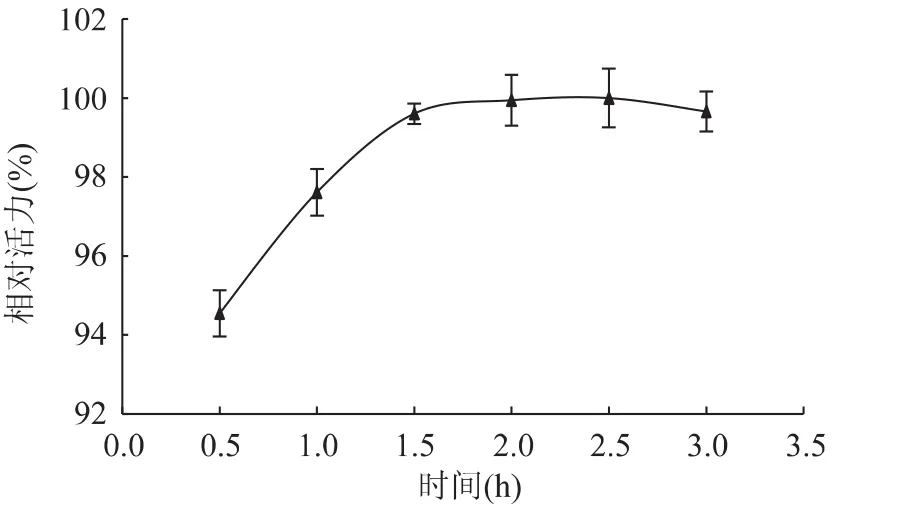
图3 前交联时间对固定化酶相对活力的影响Fig.3 Effect of pre-crosslinking time on relative activity of immobilized naringianse
2.1.4 后交联戊二醛体积分数对酶固定化的影响采用前交联可以使酶分子之间以及酶分子和载体分子之间交联,从而形成网状结构,一定程度上减少包埋后酶的渗漏[15];采用后交联可以使凝珠在成球过程中破坏的网状结构重新交联,使胶珠表面可能存在的酶分子得以交联而加固,避免脱落,能提高酶的重复使用性[16]。
图4为后交联戊二醛体积分数对酶活力的影响。在戊二醛体积分数范围为0.010%~0.025%时固定化酶活力呈增加趋势,在0.025%时达到最大;体积分数高于0.025%后,酶活开始降低;并且在范围0.015%~0.035%之间,固定化酶活力变化较小。由此说明后交联戊二醛体积分数对固定化酶活力影响较小。因此,本实验选用后交联戊二醛最适体积分数为0.025%。
2.1.5 后交联时间对酶固定化的影响 后交联时间对海藻酸钠固定化柚(皮)苷酶的影响如图5所示。由图可见,随着后交联时间的延长,柚(皮)苷酶的活力先增加后降低,到2h达最大。故本实验选用2h作为最适后交联时间。
2.2 正交实验确定海藻酸钠固定化柚(皮)苷酶最优工艺
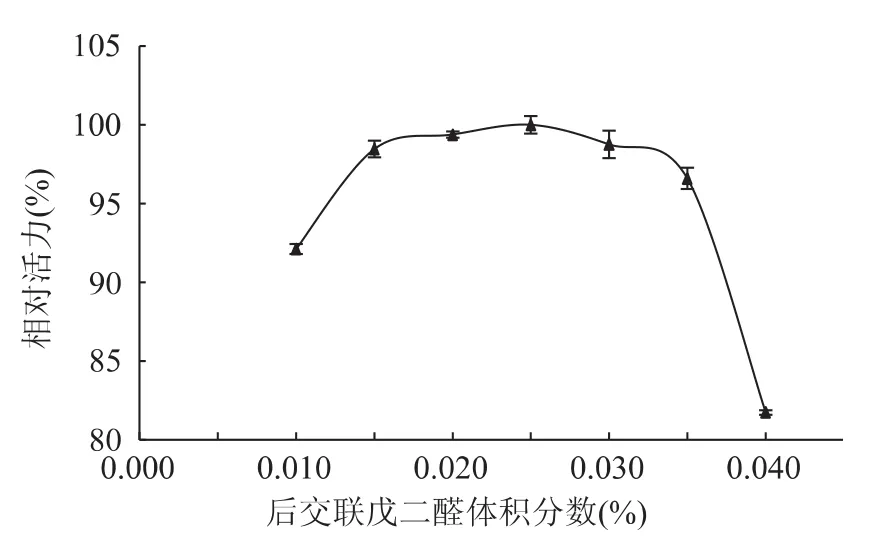
图4 后交联戊二醛体积分数对固定化酶活力的影响Fig.4 Effect of after-crosslinking glutaraldehyde volume fraction on relative activity of immobilized naringianse
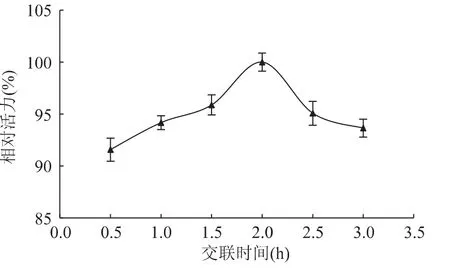
图5 后交联时间对固定化酶活力的影响Fig.5 Effect of after-crosslinking time on relative activity of immobilized naringianse
正交实验结果及数据分析见表2。由表2极差分析可知,影响固定化酶活力的主次因素依次A>D>C>B,即酶液质量浓度对固定化酶活力的影响最为显著,其次依次为后交联时间、前交联时间、前交联戊二醛体积分数。四因素的最佳组合为A2B1C3D2,即酶液质量浓度为1.0mg/mL,前交联戊二醛体积分数为2.0%,前交联时间1.5h、后交联时间2h时,固定化酶活力最高。根据正交实验所得的最佳工艺条件,进行3次平行实验,3次实验的固定化酶活力分别为 5.01、5.16、5.04U/g,平均值为 5.07U/g,结果大于正交实验中的固定化酶活力。所以通过实验验证,说明正交实验的结论是正确的。
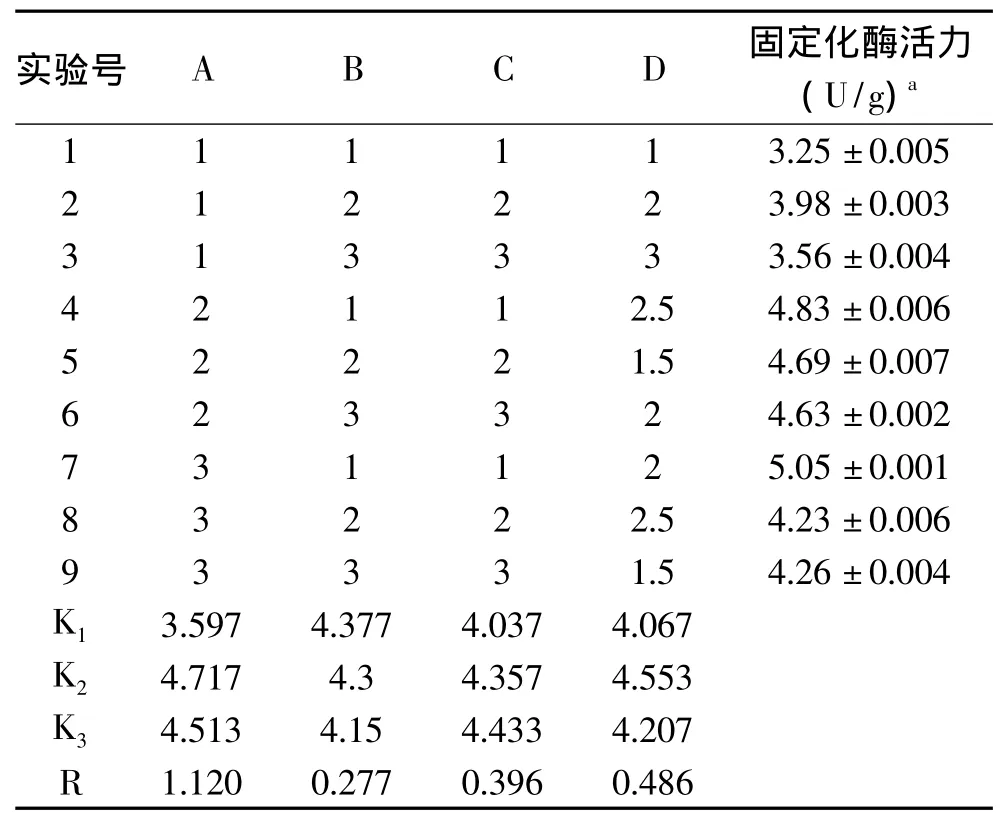
表2 海藻酸钠固定化柚(皮)苷酶L9(34)正交实验结果Table 2 Result of L9(34)orthogonal test of immobilized naringinase in alginate sodium
2.3 海藻酸钠凝胶载体固定化柚(皮)苷酶稳定性研究
2.3.1 海藻酸钠固定化酶与游离酶的温度耐受性游离酶与固定化酶在60℃时的温度耐受性见图7。从图中可以看出,游离酶在60min内酶活升高,固定化酶在45min内酶活升高;继续保温后,两种酶的活力均开始下降;游离酶在保温180min时,相对酶活力仅为16.12%,而固定化酶相对活力为44.70%。因此海藻酸钠固定化酶相对于游离酶而言,其热稳定性增强,且随着保温时间的延长,其酶活力较游离酶的活力降低缓慢。这主要是因为酶分子固定化后,可在较高的温度下获得最快的反应速度,同时载体的存在也会产生一定的空间位阻和屏蔽作用,使得酶分子抵御外界环境变化的能力增强[17]。
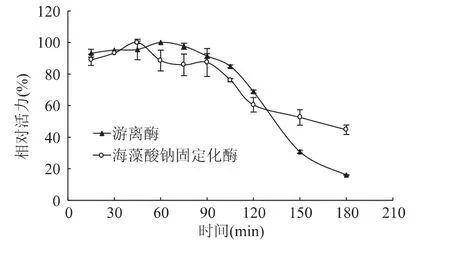
图7 游离酶与固定化酶在60℃时的温度耐受性Fig.7 Temperature tolerance of free and immobilized naringinase at 60℃
2.3.2 海藻酸钠固定化酶的操作稳定性 固定化酶经重复使用后,剩余相对活力如图8所示。由图可知,在第二次使用后,随着酶解批数的增加,固定化酶的残余酶活力基本趋于平衡,活力均保持在60%以上。这可能是因为第一次使用后,与载体结合不稳定的游离酶均泄漏[18],在后面的重复使用中,与载体结合牢固的酶均能表现出良好的活性,因而固定化酶的残余活力基本保持不变,这说明海藻酸钠固定化酶具备较好的重复使用性。
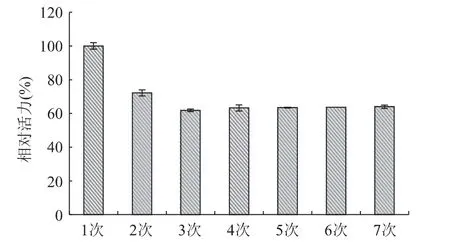
图8 固定化酶的重复使用性Fig.8 Effect of number of use on immobilized naringinase
2.3.3 海藻酸钠固定化酶与游离酶的贮藏稳定性 固定化酶和游离酶在4℃冰箱内贮藏后,酶活力变化趋势如图9所示。由图显示,两种形态的酶在贮藏期间,活力都呈下降趋势。在6d的贮藏期间,游离酶和固定化的活力下降率基本一致;但是在第15d和30d时,固定化酶的活力基本保持不变,十分稳定,残余活力在76%左右;游离酶的活力在6d后呈迅速下降趋势,在第15d时基本没有活力。表明海藻酸钠固定化酶在本实验条件下,其贮藏稳定性明显优于游离酶。这也与酶分子固载于海藻酸钠凝胶网络中后,其酶蛋白的空间构型更加稳定,对环境的抵御能力增强有关。

图9 游离酶与固定化酶的贮藏稳定性Fig.9 Storage stability of free and immobilized naringinase
3 结论与讨论
实验以海藻酸钠为载体,戊二醛为交联剂,采用交联-包埋-交联法对柚(皮)苷酶进行了固定化,制备了固定化柚(皮)苷酶。研究发现,酶液质量浓度、戊二醛体积分数和交联时间对固定化酶活力均有影响;并通过正交实验确定了海藻酸钠凝珠固定化柚(皮)苷酶的最优工艺条件:海藻酸钠浓度3%,固定化酶的承载量0.1mg/g载体,前交联戊二醛体积分数2.0%,前交联时间 1.5h,后交联戊二醛体积分数0.025%,后交联时间2h,制备的固定化酶最高活力5.07U/g。柚(皮)苷酶经海藻酸钠载体固定化后,其温度耐受性与贮藏稳定性较游离酶有较大幅度的提高;固定化酶重复使用7次后,活力仍然保持在60%左右。
[1]陈益清.海藻酸-壳聚糖-海藻酸离子取代凝胶的研究[D].天津:天津大学化工学院,2002.
[2]胡军楚,潘湛昌,董奋强,等.可生物降解高吸水材料的研究进展[J].材料导报,2006,20(11):362-365.
[3]赵振玲,于功明,刘洪武,等.海藻酸钠对面条质构影响的研究[J].粮食加工,2008,33(1):78-81.
[4]杨志清.海藻酸钠在经纱上浆中的应用[J].现代纺织技术,2002,10(4):21-22.
[5]曹月龙,庞坚,詹红生,等.海藻酸盐在软骨组织工程中的应用[J].中国组织工程研究与临床康复,2007,11(48):9777-9780.
[6]龚泰芳,方彩云,陈文,等.海藻酸盐的理化特性及其在组织工程研究和临床中的应用[J].中国组织工程研究与临床康复,2007,11(18):3613-3616.
[7]林永波,邢佳,孙伟光.海藻酸钠在重金属污染治理方面的研究[J].环境科学与管理,2009,32(9):85-88.
[8]郝晓丽.海藻酸钙冻干膜及海藻酸钙基互穿网络膜材料的制备与性能研究[D].青岛:青岛大学,2010.
[9]秦益民 .海藻酸[M].北京:中国轻工业出版社,2008,23-104.
[10]Lei S J,Pan S Y.Improvement of the activity of naringinase by covalent immobilization on sodium alginate in biomaterial engineering and its applications[J].Advanced Materials Research,2012,578:187-190.
[11]雷生姣,王可兴,潘思轶.聚乙烯醇-海藻酸钙固定化柚苷酶的研究[J].食品科学,2011,32(3):138-143.
[12]Busto M D,Meza V,Ortega N,et al.Immobilization of naringinase from Aspergillus niger CECT 2088 in poly(vinyl alcohol)cryogels for the debittering of juices[J].Food Chemistry,2007,104:1177-1182.
[13]Ellenrieder G,Blanco S,Daz M.Hyhrolysis of supersaturated naringin solutions by free and immobilized naringinase[J].Biotechnology Techniques,1998,12:63-65.
[14]Puri M,Marwaha S S,Kothari R M.Comparative kinetic characterization of soluble and alginate entrapped naringinase[J].Enzyme and Microbial Technology,1996,18:281-285.
[15]Mishra P,Kar R.Treatment of grapefruit juice for bitterness removal by amberlite IR120 and amberlite IR400 and alginate entrapped naringinase enzyme[J].Journal of Food Science,2003,68(4):1229-1235.
[16]Spagna G,Barbagallo R N,Casarini D,et al.A novel chitosan derivative to immobilize α-L-rhamnopyranosidase from Aspergillus niger for application in beverage technologies[J].Enzyme and Microbial Technology,2001,28:427-438.
[17]陈晔,韩玉洁.海藻酸钙法固定化乳酸菌发酵制备L-乳酸的研究[J].食品工业科技,2008,29(1):98-100.
[18]许松伟.海藻酸-二氧化硅杂化凝胶固定化脱氢酶研究[D].天津:天津大学化工学院,2005.
