丁苯酞对弥漫性颅脑损伤大鼠脑水肿及p38MAPK表达的影响
2014-09-04刘永亮王丽娟王丽娜李建民赵雅宁河北省唐山市人民医院神经外科河北唐山06000河北省唐山市丰润区第二人民医院检验科河北唐山0600河北联合大学附属医院神经外科河北唐山06000
刘永亮,王丽娟,王丽娜,李建民,赵雅宁,王 鹏(.河北省唐山市人民医院神经外科,河北 唐山 06000;.河北省唐山市丰润区第二人民医院检验科,河北 唐山 0600;.河北联合大学附属医院神经外科,河北 唐山 06000)
·论著·
丁苯酞对弥漫性颅脑损伤大鼠脑水肿及p38MAPK表达的影响
刘永亮1,王丽娟2,王丽娜1,李建民3,赵雅宁3,王 鹏1
(1.河北省唐山市人民医院神经外科,河北 唐山 063000;2.河北省唐山市丰润区第二人民医院检验科,河北 唐山 063030;3.河北联合大学附属医院神经外科,河北 唐山 063000)
目的探索丁苯酞对弥漫性颅脑损伤大鼠脑水肿及大脑皮层p38MAPK表达的影响。方法健康雄性SD大鼠144只,随机分为假手术组、对照组和丁苯酞组。对照组和丁苯酞组参考Mormarou法自由落体打击建立大鼠弥漫性颅脑损伤模型。丁苯酞组于大鼠模型制造成功后30min给予80mg/kg丁苯酞软胶囊植物油溶液灌胃,1次/d,连续用药至1、2、7、14d 4个时间点。假手术组和对照组于相同时间点给予等量植物油。各组于术后1、2、7、14d 4个时间点行神经功能学评分检测行为学变化;干湿质量法观察3组大鼠脑组织含水量的变化;免疫组织化学法观察3组大鼠p38MAPK表达的变化。结果与假手术组比较,对照组神经功能评分降低,脑组织含水量增加,p38MAPK阳性细胞细胞表达数量增加(P<0.05);与对照组比较,丁苯酞组神经功能评分增加,脑组织含水量降低,p38MAPK阳性细胞表达数量减少(P<0.05)。结论丁苯酞对弥漫性颅脑损伤大鼠有保护作用,同时可以减少p38MAPK的阳性表达。
脑损伤;脑水肿; p38丝裂原活化蛋白激酶类;丁苯酞
颅脑创伤是临床常见的一类疾病,随着交通运输业的发展,交通事故越来越多,颅脑创伤的发生率和致死率不断增加。丁苯酞是我国自行研制的一类治疗缺血性脑血管病的新药,对急性脑梗死有明显的治疗作用。而有关丁苯酞对颅脑创伤的影响尚未见临床报道,本研究观察丁苯酞对颅脑创伤大鼠脑水肿及皮层p38MAPK表达的影响,旨在为丁苯酞在颅脑创伤中的应用提供理论指导。
1 材料与方法
1.1 动物来源:清洁SD雄性大鼠144只(购自北京维通利华公司),体质量(320±20)g,维持室温在20~25℃,正常饮食饮水,饲养2~3周后进行实验。
1.2 方法:按照随机数字表法将144只大鼠分为假手术组、对照组和丁苯酞组,每组分为1、2、7、14d4个时间点。每个时间点4只。行为评分用48只,脑组织含量用48只,免疫组织化学用48只。参照Marmarou等[1]的方法制作弥漫性颅脑损伤模型。对照组和丁苯酞组术前12h禁食水,采用吸入性麻醉的方法,剪去大鼠颅顶毛发,常规消毒,沿中线失状缝切开头皮,暴露颅骨顶部,剥离骨膜,大鼠冠状缝与失状缝正中放置不锈钢垫,俯卧位固定于海绵床垫上。待动物开始苏醒、有肢体活动时,质量450g的铜棒在垂直塑料管中从1.2m高度自由落下击中不锈钢垫,造成大鼠弥漫性颅脑创伤。丁苯酞组大鼠致伤后30min给予丁苯酞软胶囊植物油溶液,药物剂量按80mg/kg灌胃,1次/d,直至各时间点处死。对照组给予等量植物油。假手术组仅给予麻醉及头皮切开、缝合,但不致伤。
1.3 行为学检测:参照Chen等[2]的神经功能缺失评分量表(neurologicalseverityscores,NSS),对3组大鼠在1、2、7、14d时间点进行神经功能行为学检测。
1.4 采用干湿质量法测量脑组织含水量:参照Yang等[3]的实验方法,将3组不同时间点的大鼠,开颅取出脑组织后,用过滤纸将其表面的液体擦干,将脑组织放置于烘烤过的载玻片上,准确测量得到脑组织的质量即湿质量。随即将脑组织放入110℃烤箱中24h,测得到的质量即为干质量。脑组织含水量=(湿质量-干质量)/湿质量×100%。
1.5 免疫组织化学:参照免疫组织化学试剂盒步骤进行实验。采用阳性细胞计数法,在相同光镜倍数(10×40)下每只大鼠每个指标选取5张脑组织切片,每张切片在高倍视野镜下随机选取5个不重叠视野,计算每个视野的阳性细胞数及棕黄色颗粒细胞,取均数作为每组该指标阳性细胞数。
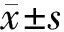
2 结 果
2.1 神经功能评分结果:与假手术组比较,对照组大鼠神经功能评分下降(P<0.05);与对照组比较,丁苯酞组大鼠神经功能评分提高(P<0.05)。并随着时间延长,行为学评分越来越高,丁苯酞组14d与各时间点和对照组比较,差异均有统计学意义(P<0.05)。见表1。
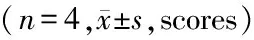
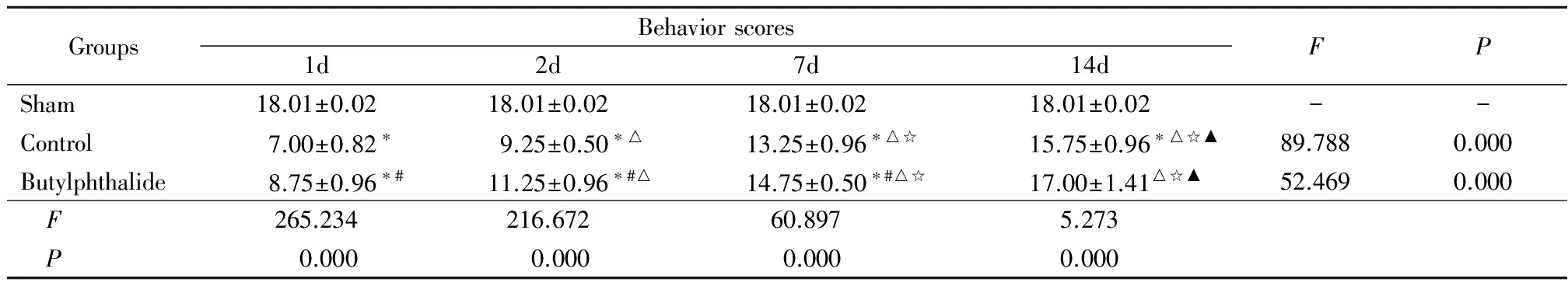
GroupsBehaviorscores1d2d7d14dFPSham18.01±0.0218.01±0.0218.01±0.0218.01±0.02--Control7.00±0.82∗9.25±0.50∗△13.25±0.96∗△☆15.75±0.96∗△☆▲89.7880.000Butylphthalide8.75±0.96∗#11.25±0.96∗#△14.75±0.50∗#△☆17.00±1.41△☆▲52.4690.000 F265.234216.67260.8975.273 P0.0000.0000.0000.000
*P<0.05vssham #P<0.05vscontrol △P<0.05vs1d ☆P<0.05vs2d ▲P<0.05vs7d byqtest
2.2 脑组织含水量结果:与假手术组比较,对照组伤后脑组织含水量增加(P<0.05)。对照组和丁苯酞组脑组织水含量均在7d达高峰,14d明显下降,丁苯酞组14d与2、7d和对照组比较差异均有统计学意义(P<0.05)。见表2。
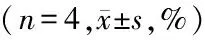
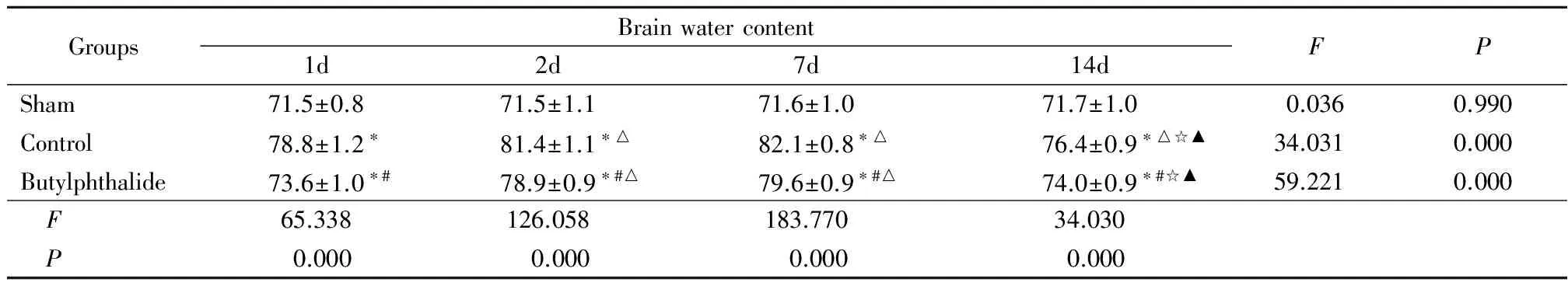
GroupsBrainwatercontent1d2d7d14dFPSham71.5±0.871.5±1.171.6±1.071.7±1.00.0360.990Control78.8±1.2∗81.4±1.1∗△82.1±0.8∗△76.4±0.9∗△☆▲34.0310.000Butylphthalide73.6±1.0∗#78.9±0.9∗#△79.6±0.9∗#△74.0±0.9∗#☆▲59.2210.000 F65.338126.058183.77034.030 P0.0000.0000.0000.000
*P<0.05vssham #P<0.05vscontrol △P<0.05vs1d ☆P<0.05vs2d ▲P<0.05vs7d byqtest
2.3 p38MAPK阳性细胞免疫组织化学: 假手术组大鼠皮层可以观察到有少量磷酸化;对照组皮层均有不同程度磷酸化,阳性细胞染色呈现棕黄色颗粒状,主要分布于细胞核;丁苯酞组的磷酸化p38MAPK阳性细胞数量表达均较对照组少,阳性细胞染色呈现棕黄色颗粒状,主要分布于细胞核。
假手术组p38MAPK阳性细胞表达各时间点差异无统计学意义(P>0.05)。对照组和丁苯酞组p38MAPK阳性细胞表达在7d达高峰,14d明显下降,丁苯酞组14d均较2、7d和对照组明显下降(P<0.05)。见表3。
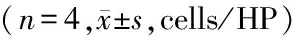

Groupsp38MAPKpositivecells1d2d7d14dFPSham2.60±1.1402.20±0.4472.40±0.5482.40±0.8940.2050.891Control11.80±1.924∗15.60±1.140∗△16.80±0.837∗△13.20±0.837∗☆▲16.0310.000Butylphthalide7.40±1.517∗#11.80±1.304∗#△13.40±1.342∗#△8.60±1.517∗#☆▲19.0620.000 F43.507223.562303.500115.947 P0.0000.0000.0000.000
*P<0.05vssham #P<0.05vscontrol △P<0.05vs1d ☆P<0.05vs2d ▲P<0.05vs7d byqtest
3 讨 论
随着社会现代化进程的快速推进,特别是交通运输业的迅猛发展,创伤性脑损伤的发生率日趋增高。其致残率和病死率较高,严重危害人们的身心健康,给社会和家庭带来沉重的负担。目前针对创伤性脑损伤的研究逐步深入,但其确切发生发展机制尚未完全清楚。
研究[4]表明丁苯酞具有多种药理作用。丁苯酞可提高脑血管内皮一氧化氮和前列腺环素的水平,通过抑制血清高敏C反应蛋白的表达[5],抑制基质金属蛋白酶9的表达和血尿屏障通透性的增高[6],降低细胞内钙浓度,抑制谷氨酸释放,降低花生四烯酸含量,抑制氧自由基和提高抗氧化酶活性等机制阻断急性脑梗死所致脑损伤的多个病理环节,从而发挥较强的抗脑缺血作用,改善神经系统功能[7]。
p38MAPK相对分子质量为38 000,最初被认为是一种能被脂多糖激活的激酶[8]。p38MAPK信号传导通路可由脑缺血再灌注损伤、渗透压变化和病理应激刺激等情况下激活,在多种神经系统疾病如脑损伤的发生发展过程中,细胞凋亡和炎症反应中均发挥重要作用[9-10]。炎性因子、应激刺激(紫外线、高渗透压、热休克)、脂多糖、过氧化氢、谷氨酸等均可激活p38MAPK信号通路[11]。
谷氨酸作用产生的兴奋毒性能够引起细胞因子的迅速表达和p38MAPK的快速激活。谷氨酸与中枢神经系统的NMDAR结合后可激活p38MAPK,导致脑颗粒细胞发生凋亡[8]。
本实验通过丁苯酞的干预作用,大鼠神经功能评分得以提高,脑水肿情况减轻,从而发挥了对弥漫性颅脑损伤大鼠的保护作用。而且在p38MAPK阳性结果表达中可以看出,用药之后p38MAPK阳性细胞表达数量是减少的,说明丁苯酞抑制了p38MAPK的表达,但其确切抑制机制值得进一步研究。
针对弥漫性颅脑损伤的发生率和致残致死率,进一步深入研究创伤性脑损伤发病机制及其伤后病理生理变化、寻求更加有效的治疗途径,将有助于提高患者的生存率,改善患者的生存质量。
[1] MARMAROU A,FODA MA,VAN DEN BRINK W,et al.A new model of diffuse brain injury in rats.Part Ⅰ:pathophysiology and biomechanics[J].J Neurosurg,1994,80(2):291-300.
[2] CHEN J,SANBERG PR,LI Y,et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats rats[J].Stroke,2001,32(11):2682-2688.
[3] YANG XF,LIU WG,SHEN H,et al.Correlation of cell apoptosis with brain edema and elevated intracranial pressure in traumatic brain injury[J].Chin J Traumatol,2005,8(2):96-100.
[4] 侯德仁,薛俐,陈坤,等.丁苯酞对阿尔茨海默病模型大鼠海马GFAP和VEGF的影响[[J].中南大学学报:医学版,2010,35(2):111-115.
[5] 朱海生.丁苯酞对慢性脑供血不足患者血清高敏C反应蛋白水平的影响[J].中华实用诊断与治疗杂志,2012,26(1):73-74.
[6] 高兰,娄季宇,杨霄鹏.丁苯酞对脑缺血再灌注损伤大鼠MMP-9活性和血脑屏障通透性的影响[[J].中风与神经疾病杂志,2012,29(2):116-118.
[7] 闫为民,王光辉,卢献彬.丁苯酞软胶囊联合舒血宁注射液治疗急性脑梗死疗效观察[[J].河北医科大学学报,2010,31(8):999-1000.
[8] LEE JC,LAYDON JT,MCDONNELL PC,et al.A protein kinase involved in the regulation of inflammatory cytokine biosynthesis[J].Nature,1994,372(6508):739-746.
[9] OTANI N,NAWASHIRO H,FUKUI S,et al.Role of the activated extracellular signal-regulated kinase pathway on histological and behavioral outcome after traumatic brain injury in rats[J].J Clin Neurosci,2007,14(1):42-48.
[10] SASAKI N,SEKIGUCHI M,KIKUCHI S,et al.Effects of asialo-erythropoietin on pain-related behavior and expression of phosphorylated-p38 map kinase and tumor necrosis factor-alpha induced by application of autologous nucleus pulposus on nerve root in rat[J].Spine(Phila Pa 1976),2011,36(2):E86-94.
[11] 金惠铭.病理生理学[M].上海:复旦大学出版社,2005:46.
(本文编辑:许卓文)
EFFECTOFBUTYLPHTHALIDEONBRAINEDEMAOFRATSAFTERFOCALCEREBRALINFARCTIONANDEXPRESSIONOFp38MAPK
LIUYongliang1,WANGLijuan2,WANGLina1,LIJianmin3,ZHAOYaning3,WANGPeng1
(1.DepartmentofNeurosurgery,TangshanPeople'sHospital,HebeiProvince,Tangshan063000,China;2.DepartmentofLaboratory,FengrunSecondPeople′sHospital,TangshanCity,HebeiProvince,Tangshan063030,China;3.DepartmentofNeurosurgery,theAffiliatedHospitalofHebeiUnitedUniversity,HebeiProvince,Tangshan063000,China)
ObjectiveToexploretheeffectofbutylphthalideonthebrainedemaofratsfollowingtraumaticbraininjuryandtheexpressionofp38MAPKaroundtheinjuryarea.Methods144Sprague-Dawleymaleratsweredividedintoshamgroup,controlgroupandbutylphthalidegroup(40mg/kg,onceaday).ThemodelwasmadebyMarmaroumethod.Afterinjury1,2,7,14d,behaviorscoresweredonetoobservethechangesofneuromotorfunction,brainwatercontentwasmeasuredtoobservethechangesofthebrainedema,theimmunohistochemistryandwesternblotweredonetolooktheexpressionofp38MAPKaroundtheinjuryarea.ResultsComparedwiththeshamgroup,thebehaviorscoresofcontrolgroupweredecreased,thebrainwatercontentofthecontrolgroupwasmore,thecontentofp38MAPKaroundtheinjuryareawasincreased(P<0.05).Comparedwiththecontrolgroup,thebehaviorscoresofbutylphthalidegroupwereincreased,thebrainwatercontentofthebutylphthalidegroupwasless,thecontentofp38MAPKaroundtheinjuryareaofbutylphthalidegroupwasdecreased(P<0.05).ConclusionButylphthalidecouldreducetheexpressionofp38MAPKfollowingtraumaticbraininjuryandreducethebrainedema.
braininjury;brainedema;p38mitogen-activatedproteinkinases;butylphthalide
2013-11-18;
2014-02-14
河北省卫生厅科研基金项目(20130384)
刘永亮(1974-),男,河北唐山人,河北省唐山市人民医院副主任医师,医学硕士,从事神经外科疾病诊治研究。
R651.15
A
1007-3205(2014)06-0631-04
10.3969/j.issn.1007-3205.2014.06.005
