油橄榄叶中橄榄苦苷含量的HPLC-DAD测定分析
2014-09-04李春燕唐远谋梁晓玲苟小军
李春燕,唐远谋,梁晓玲,刘 嵬,颜 军,苟小军*
(1.成都大学生物产业学院,四川 成都 610106;2.西华大学生物工程学院,四川 成都 610039;3.成都大学金牛校区管理委员会,四川 成都 610036)
油橄榄叶为木犀科、木犀榄属四季常绿乔木油橄榄(OleaeuropaeaL.)的叶子[1],其富含的抗氧化活性成分远远高于橄榄油[2],尤其以叶中橄榄苦苷为代表的抗氧化活性成分,其含量明显高于果实和树枝[3]。橄榄苦苷(oleuropein,OE)是一种重要的苯酚类裂环烯醚萜苷类化合物,具有极强的抗氧化能力[4-5],研究表明其能减慢低密度脂蛋白的氧化程度,可以预防冠心病、动脉粥样硬化,还具有舒缓平滑肌和降低血压等功效[6]。随着对橄榄苦苷研究的深入,其药理活性功能逐渐被研究人员发现并逐步应用于医疗、保健食品和化妆品等行业。国外对橄榄苦苷的研究较早,Cristina 等[7]对橄榄苦苷及其相关化合物的产生、分布和它在植物体内生物合成过程进行了特征分析。王成章等[8]研究了引种的希腊阿斯品种橄榄叶中橄榄苦苷的化学结构、分析方法及其季节性变化规律。彭焕超等[9]采用RP-HPLC法测定了不同来源油橄榄叶中的橄榄苦苷,但没有对油橄榄叶中的橄榄苦苷做定性分析。为此,本研究拟通过HPLC-DAD对油橄榄叶中的橄榄苦苷做定性定量分析,并进一步分析其稳定性和重复性。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
油橄榄叶(四川天源油橄榄公司提供)干燥粉碎后备用;40%的橄榄苦苷标准品、乙腈(色谱纯)、甲醇,均购自成都科龙化工有限公司。
1.1.2 仪器
微型高速万能试样粉碎机(北京中兴伟业仪器有限公司);KQ3200超声波清洗仪(昆山市超声仪器有限公司);日立L-2000高效液相色谱仪、二极管阵检列测器(日立仪器设备公司);FA10004B分析天平(上海越平科学仪器有限公司)。
1.2 实验方法
1.2.1 色谱条件
按照王成章等[10]的实验方法并作适当改进:色谱柱为Akasil C18(5 μm,4.6 mm×250 mm),流动相为23%乙腈水溶液,检测波长为230 nm,柱温为35 ℃,流速为1 mL/min。
1.2.2 橄榄苦苷标准品溶液的配制
精密称取40%的橄榄苦苷对照品10. 0 mg,置于10 mL的容量瓶中,加入体积分数为23%的乙腈-水溶液溶解并定容,摇匀后,配成橄榄苦苷质量浓度为0.4 mg/mL的溶液。
1.2.3 油橄榄叶提取液的制备
取自然阴干的油橄榄,粉碎。精确称取油橄榄叶粉末1 g,置于100 mL锥形瓶中,加入70%的甲醇溶液30 mL,常温下,于超声波中提取30 min。提取完全后,过滤,备用。
1.2.4 方法学考察
1.2.4.1 橄榄苦苷标准曲线的绘制
将1.2.2配制的橄榄苦苷标准品溶液按对半稀释法,依次配成0.2、0.1、0.05、0.025、0.0125 mg /mL的溶液。按质量浓度由小到大分别进样,每次进样60 μL,每个体积重复进样3次,取其HPLC峰面积平均值。记录保留时间和峰面积,以HPLC峰面积为纵坐标,橄榄苦苷质量浓度为横坐标,绘制HPLC标准曲线,得HPLC线性回归方程。
1.2.4.2 稳定性实验
取1.2.3制备的油橄榄叶提取液,每次进样60 μL,每隔1 h进样一次,连续进样5次,记录其保留时间和峰面积,计算RSD。
1.2.4.3 重复性实验
取1.2.3制备的油橄榄叶提取液,每次进样60 μL,重复进样3次,记录其保留时间和峰面积,计算RSD。
1.2.4.4 加标回收率实验
取1.2.3制备的油橄榄叶提取液5 mL,共5份,各加入0.05 g 40%的橄榄苦苷,摇匀后,用0.45 μm滤头过滤,进HPLC分析,记录保留时间和峰面积,计算平均回收率和RSD。
1.2.4.5 样品中橄榄苦苷含量的测定
将1.2.3制备的油橄榄叶提取液经0.45 μm滤头过滤,进样量为60 μL,重复进样3次,取其峰面积的平均值。用面积归一法,根据橄榄苦苷的线性回归方程计算油橄榄叶中橄榄苦苷的含量。
2 结果与讨论
2.1 橄榄苦苷标准曲线的绘制
按1.2.4.1的方法,得到的橄榄苦苷标准曲线如图1所示。

图1 橄榄苦苷的标准曲线
由图1可知,橄榄苦苷在0.0125~0.4 mg/mL内与其峰面积呈良好的线性关系,以橄榄苦苷质量浓度为横坐标,峰面积为纵坐标得到回归方程为y=746 900 22x+157 53,相关系数为R2=0.999 9。
2.2 样品的测定
2.2.1 油橄榄叶提取液的定性分析
将1.2.3制备的油橄榄叶提取液进样,再用1.2.2制备的40%的橄榄苦苷溶液进样,每次进样量都为60 μL,分别记录其保留时间。从图2可知油橄榄叶提取液中出现了3个峰,其中被标注为1的峰保留时间为14.389 min,而图3中40%的橄榄苦苷的保留时间为14.401 min,通过对比图2和图3可知此处该物质的出峰的保留时间很接近,故可判定在此色谱条件下油橄榄叶中含有橄榄苦苷。

图2 油橄榄叶提取液的HPLC色谱图

图3 40%橄榄苦苷的HPLC色谱图
2.2.2 样品的稳定性实验
按1.2.4.2方法进行样品稳定性实验,结果见表1。

表1 样品的稳定性实验
由表1可知,将同一批次油橄榄叶提取液样品间隔进样,测得峰面积变化幅度不大,通过线性回归方程可得油橄榄叶中的橄榄苦苷的平均含量为3.92 mg/g ,RSD为0.75%,表明油橄榄叶提取液的稳定性好,用HPLC测定油橄榄叶中橄榄苦苷的含量满足分析要求。
2.2.3 样品的重复性实验
按1.2.4.3方法进行样品重复性实验,结果见表2。

表2 样品的重复性实验
由表2可知,将同种油橄榄叶提取液样品进行3次平行测定,通过对比峰面积变化幅度不大,计算RSD为0.5%,表明用HPLC方法测定油橄榄叶中橄榄苦苷的含量满足分析要求。
2.2.4 样品的加标回收率实验
按1.2.4.4方法进行加样回收率实验,结果见表3。
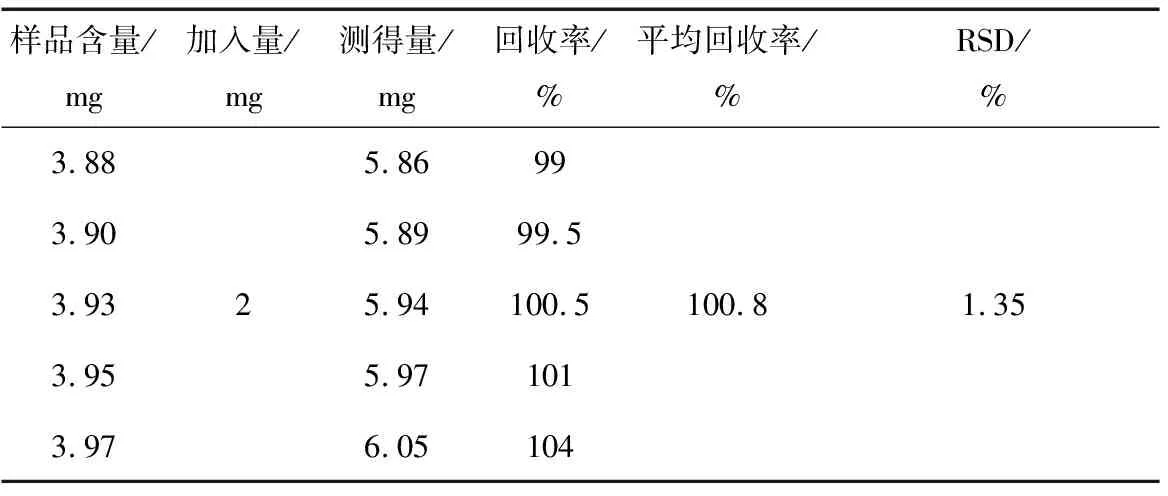
表3 样品的加标回收率实验
由表3可知,样品的平均回收率为100.8%,RSD为1.35%,满足分析测定要求。
2.2.5 样品中橄榄苦苷含量的测定
按1.2.4.5方法得到的橄榄苦苷的峰面积,结果见表4,得到的橄榄苦苷的线性回归方程y=746 90 022x+15 753,计算出油橄榄叶中橄榄苦苷的含量的平均值为3.92 mg/g。

表4 样品中橄榄苦苷的含量
3 结论
本方法用高效液相色谱-二极管阵列检测器(HPLC-DAD)建立油橄榄叶中橄榄苦苷的分析测定方法,橄榄苦苷标准品在0.012 5~0.4 mg/mL内与其峰面积呈良好的线性关系,相关系数R2=0.999 9。通过对油橄榄叶进行定性分析,可以确定其中含有橄榄苦苷,对建立的HPLC方法进行稳定性、重现性分析,并对样品中橄榄苦苷含量进行测定,根据橄榄苦苷标准曲线计算出油橄榄叶中橄榄苦苷的含量为3.92 mg/g。此方法对样品处理简单、测定速度快、重现性好、稳定性高,可以用于油橄榄叶中橄榄苦苷含量的测定。
[1]张崇礼.发展油橄榄产业势在必行[J].中国农业科技导报,2007,9(2):85-88.
[2]Jemaia H,Bouaziza M,Fkia I,et a1.Hypolipidimic and Antioxidant Activities of Oleuropein and Its Hydrolysis Derivative-rich Extracts fromChemlaliOlive Leaves[J].Chemico-Biological Interactions, 2008,176(2/3):88-98.
[3]Deirio J A, Baidez A G, Botia J M, et a1.Enhancement of Phenolic Compounds in Olive Plants (OleaeuropaeaL.) and Their Influence on Resistance Against Phytophthora sp[J].Food Chemistry, 2003,83(1):75-78.
[4]Evren A, Deniz B, Oguz B, et a1. Isolation of Polyphenols from the Extracts of Olive Leaves (OleaeuropaeaL.) by Adsorption on Silk Fibroin[J]. Separation and Purification Technology,2008,62:342-348.
[5]孙瑾,王宗举,陈岗,等.橄榄中多酚类物质体外抗氧化活性研究[J].中国食品添加剂,2010(3):69-74.
[6]Visioli F, Bellomo G, Mintedoro F, et a1. Low-density Lipoprotein Oxidation is Inhibited in Vitro by Olive Oil Constituents[J]. Atherosclerosis, 1995,117(1):25-32.
[7]Cristina S R, Juan C E, Harrpy J W. Oleuropein and Related Compounds[J].Science of Food and Agriculture,2008,26(6):39-43.
[8]王成章,高彩霞,叶建中,等.引种阿斯油橄榄叶中橄榄苦苷提取分离及结构鉴定[J].林产化学与工业,2009,29(3):53-57.
[9]彭焕超,张浩,陈雏,等.RP-HPLC测定不同来源油橄榄叶中的橄榄苦苷[J].华西药学杂志,2008,23(2):199-200.
[10]王成章,高彩霞,叶建中,等.HPLC研究油橄榄叶中橄榄苦苷的含量变化规律[J]. 林产化学与工业,2008,28(6):39-43.
