响应面法优化杏鲍菇下脚料多糖提取工艺
2014-09-04袁春红向文良
张 庆,林 凯,袁春红,李 可,肖 奎,向文良
(1. 西华大学生物工程学院,四川 成都 610039;2. 成都榕珍菌业有限公司,四川 成都 611733)
杏鲍菇(Pleurotuseryngii)又名刺芹侧耳,隶属于真菌门、担子菌亚门、真担子菌纲、层菌亚纲、伞菌目、侧耳科、侧耳属,是一种珍贵的药食皆宜的真菌。药用功效研究发现,杏鲍菇可显著提高人体免疫功能,并有抗癌、降血脂、润肠胃、美容的功效[1-5]。其多糖作为一种特殊的免疫调节剂,在激活T淋巴细胞中具有强烈的宿主介导性,能刺激抗体形成、增强机体免疫力、发挥抗癌作用[3]。杏鲍菇多糖成分对自由基引起的亚油酸、菜油氧化以及离体肝脏组织的脂质过氧化均有一定的抑制作用[4-5]。
目前,已有学者对杏鲍菇子实体、菌丝体及杏鲍菇菌糠废弃物多糖的提取工艺进行了研究[1, 5, 6-13],而从杏鲍菇加工过程中产生的下脚料中提取多糖的研究还未见报道。杏鲍菇加工废弃物下脚料大多产生于子实体部位,含有丰富的多糖成分,与子实体多糖具有相似的生物学活性和生理功能。从杏鲍菇加工废弃物下脚料中提取多糖,不仅可以延伸杏鲍菇产业链,提高产品附加值,还可减少废弃物丢弃造成的环境污染,促进杏鲍菇产业向多元化良性发展,提高企业经济效益和生态效益有重要促进作用。本实验主要探讨了热水浸提温度、提取时间及液料比对杏鲍菇下脚料多糖提取率的影响,利用Box-Behnken响应面分析法对多糖提取工艺参数进行优化,获得杏鲍菇废弃物下脚料多糖提取的最佳工艺条件,为杏鲍菇加工废弃物下脚料的进一步应用开发研究提供参考。
1 材料与方法
1.1 材料与试剂
杏鲍菇下脚料,四川榕珍菌业有限公司;无水葡萄糖、浓硫酸、苯酚,以上试剂均为分析纯。
1.2 仪器与设备
ZN-200A高速中药粉碎机,长沙市岳麓区中南制药机械厂;YLD-2000型电热恒温鼓风干燥箱,黄石市恒丰医疗器械有限公司;TB-214型电子天平,北京赛多利斯仪器系统有限公司;HH-S4数显恒温水浴锅,金坛市医疗仪器厂;WTL超微台式离心机,江苏金坛市金城国胜实验仪器厂;UV-2600型紫外可见分光光度计,尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 原料预处理
杏鲍菇下脚料鲜品,清洗除杂,切成片状,60 ℃电热恒温鼓风干燥至恒重,粉碎,过40目筛。按液料比8∶1(mL/g)加入无水乙醇,浸泡24 h, 旋转蒸发回收乙醇,去脂后残渣置于阴凉处风干,粉碎,过60目筛,于真空干燥器保存备用。
1.3.2 杏鲍菇下脚料多糖提取工艺路线
杏鲍菇下脚料(1.000 g)→热水浸提(不同因素)→离心2次→取上清液→定容→取上清液(稀释)→苯酚-硫酸法测定粗多糖提取率。
1.3.3 标准曲线制作
用苯酚-硫酸法测定多糖含量的标准曲线[5]。标准曲线以无水葡萄糖为标准品,于490 nm 波长处测定吸光度,以糖质量浓度(mg/mL)为横坐标,吸光度(A)为纵坐标,绘制葡萄糖标准曲线,并求出标注曲线回归方程。
1.3.4 杏鲍菇下脚料多糖提取单因素试验设计
分别考察提取温度、时间和液料比对多糖提取率的影响。
1.3.5 杏鲍菇下脚料多糖提取中心组合试验设计
在对提取温度、浸提时间、液料比3个进行单因素试验的基础上,以杏鲍菇下脚料多糖提取率为响应值,运用Box-Behnken中心组合试验设计方案,采用三因素三水平响应面分析法进行试验。实验数据依据Design-expert 7.0统计软件回归分析确定各提取条件的影响因子,绘制响应面与等值线图,分析确定杏鲍菇下脚料多糖的最佳提取条件。
1.3.6 杏鲍菇下脚料多糖提取率
多糖提取率/%=

(1)
2 结果与分析
2.1 单因素试验
2.1.1 提取温度对杏鲍菇下脚料多糖提取率的影响
准确称取5份0.20 g杏鲍菇下脚料干粉,各加入5 mL蒸馏水,摇匀,水浴加热,加热温度分别为75、80、85、90、95 ℃,浸提4 h,冷却,6 000 r/min离心10 min,收集上清液,加去离子水定容至一定体积,测定其中多糖质量浓度,计算多糖提取率,结果见图1。
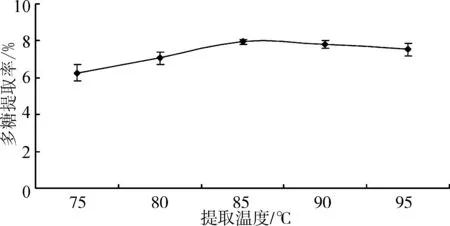
图1 提取温度对多糖提取率的影响
由图1可知,随着温度的上升,杏鲍菇下脚料多糖的提取率增加,当温度达到85 ℃后,多糖提取率随着温度的升高没有明显增加,综合温度过高能耗增加及水分挥发过多等因素考虑,选择85 ℃为适宜的多糖提取温度。
2.1.2 提取时间对杏鲍菇下脚料多糖提取率的影响
准确称取5份0.20 g杏鲍菇下脚料干粉,各加入5 mL蒸馏水,摇匀,85 ℃水浴分别加热1、2、3、4、5 h,冷却,6 000 r/min离心10 min,收集上清液,加去离子水定容至一定体积,测定其中多糖质量浓度,计算多糖提取率,结果见图2。

图2 提取时间对多糖提取率的影响
由图2可知,随着浸提时间的延长,杏鲍菇子实体多糖的提取率在不断的增加,3 h时的多糖提取率最大;此后,随着时间的延长,多糖提取率趋于稳定,无显著变化,因此从节约提取时间,降低提取成本角度考虑,选择适宜的提取时间为3 h左右。
2.1.3 液料比对杏鲍下脚料多糖提取率的影响
准确称取5份0.20 g杏鲍菇下脚料干粉,研究85 ℃水浴浸提3 h条件下,不同液料比对多糖提取率的影响,结果见图3 。
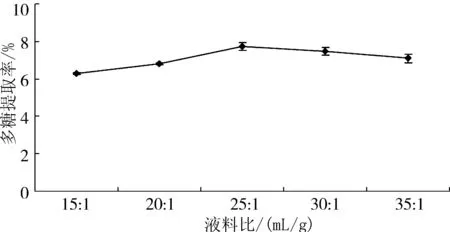
图3 提取液料比对多糖提取率的影响
由图3可知,开始阶段,随着液料比的增加,杏鲍菇下脚料多糖的提取率不断增加,当液料比达25∶1时提取率最大;而当液料比继续增加时,杏鲍菇下脚料多糖提取率开始下降,因此,25∶1为适宜的液料比。
2.2 响应面试验
2.2.1 响应面试验设计及结果
在单因素试验考察结果的基础上,依据Box-Behnken 中心组合试验设计原理,选取液料比、提取温度和时间3个因素为自变量,杏鲍菇下脚料多糖提取率(Y)为响应值,设计了一个三因素三水平共17个试验点的响应面优化分析试验。响应面试验因素水平编码值见表1,结果见表2。
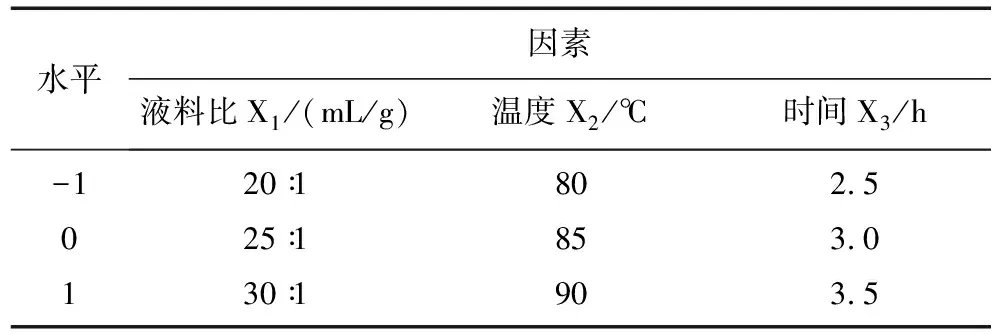
表1 试验因素及水平表
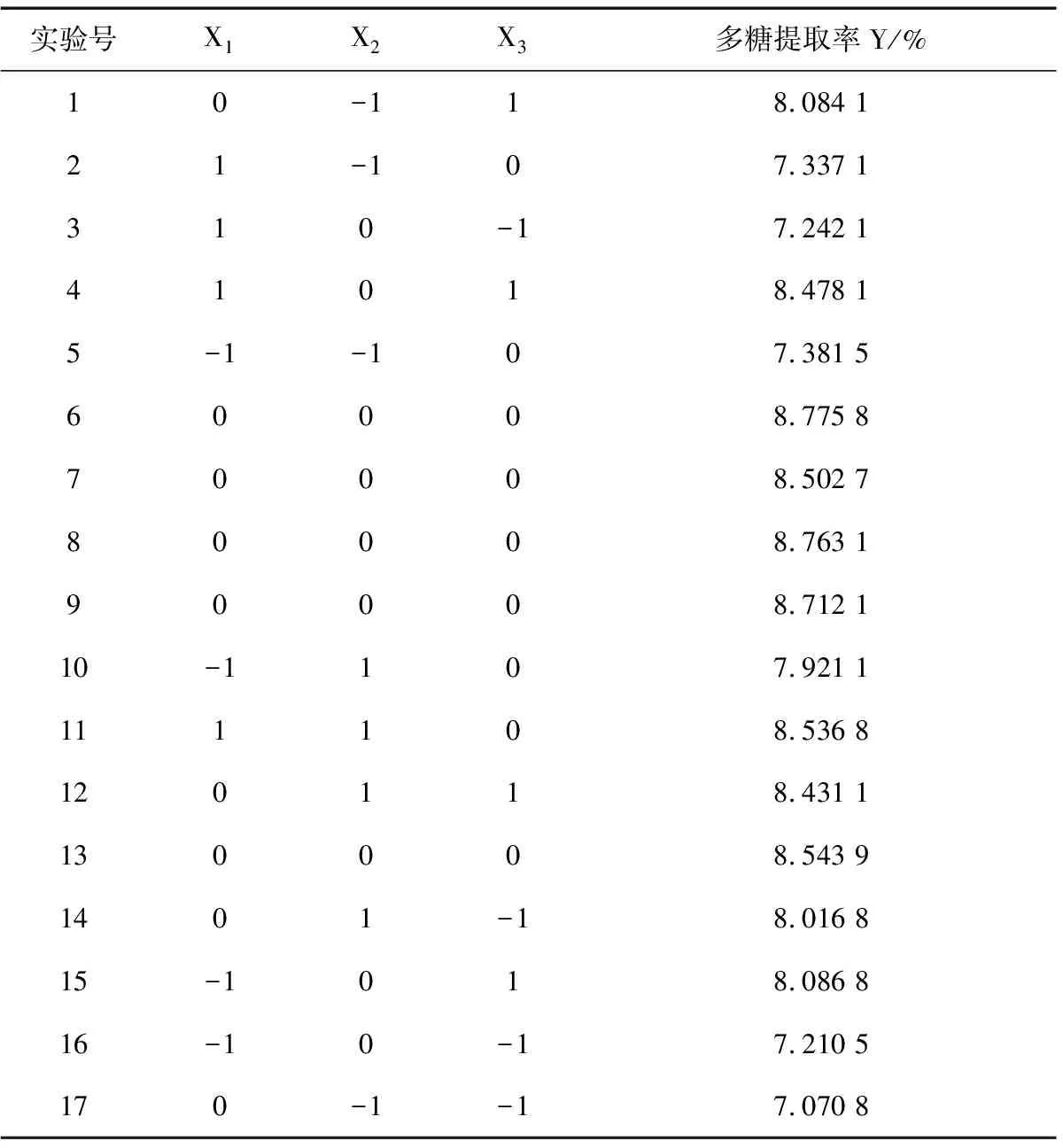
表2 响应面试验设计和结果
将表2所得的试验数据进行回归拟合分析,回归模型系数及显著性检验结果见表3。3个考察因素经回归分析后得到以杏鲍菇下脚料多糖提取率(Y)为目标函数的二次回归方程
Y=8.66+0.12X1+0.38X2+0.44X3+0.17X1X2+0.090X1X3-0.15X2X3-0.51X12-0.36X22-0.40X32
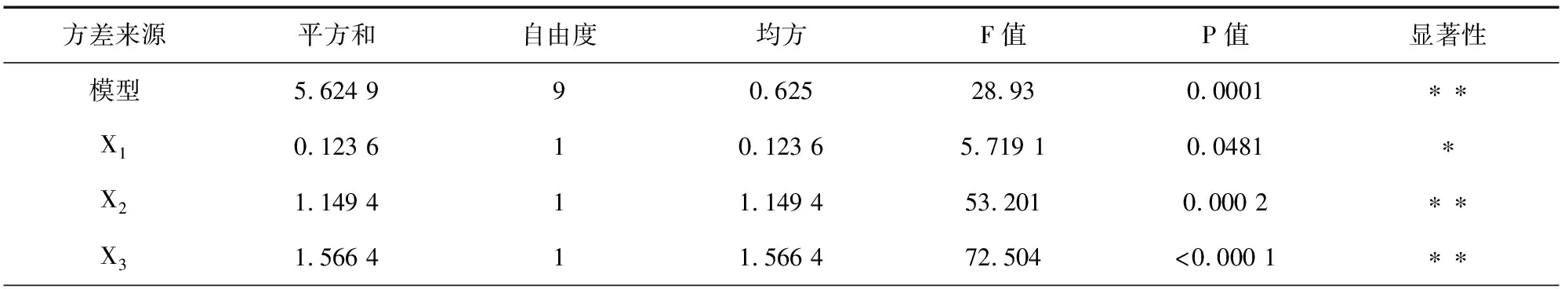
表3 回归模型系数及显著性检验结果

续表3方差来源平方和自由度均方F值P值显著性X1 X20.108 910.108 95.042 30.059 6X1 X30.032 310.032 31.497 20.260 7X2 X30.089 710.089 74.1520.081 0X121.077 411.077 449.8730.000 2∗∗X220.544 310.544 325.1930.0015∗∗X320.671 310.671 331.0720.000 8∗∗剩余项0.151 270.021 6失拟项0.086 330.028 81.770.291 7纯误差0.06540.016 2总差5.776 216相关系数(R2)R2=0.973 8
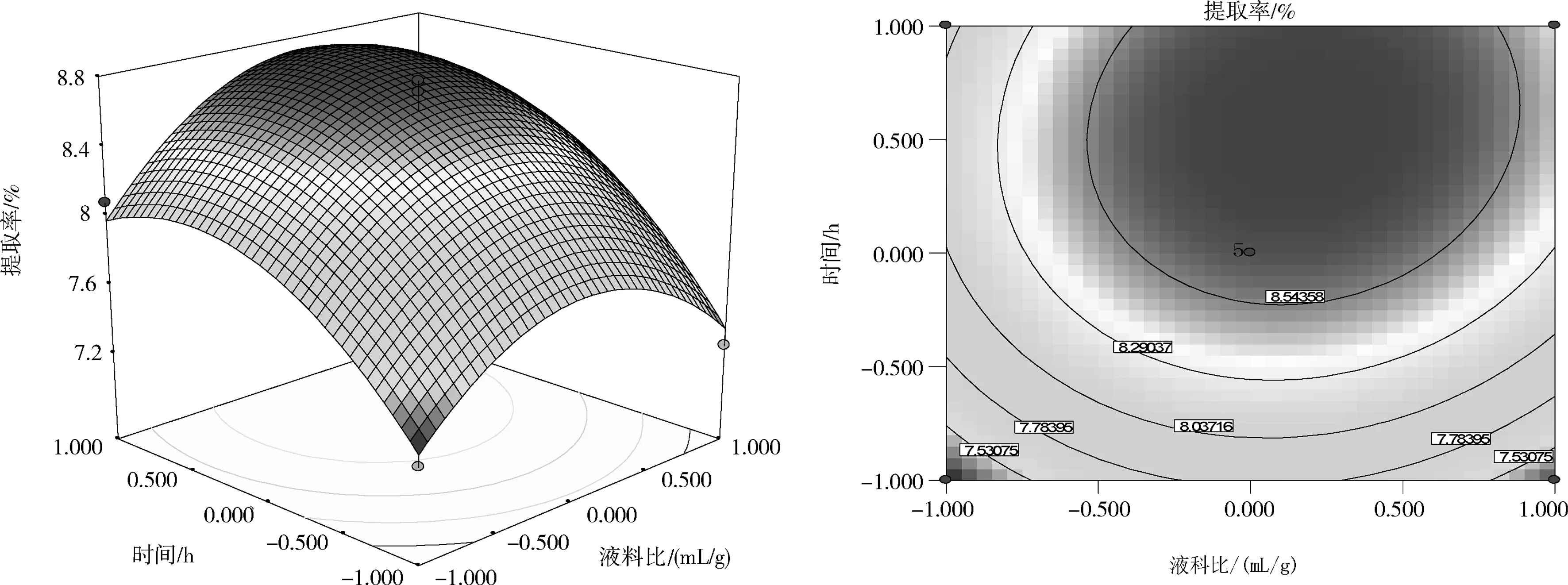
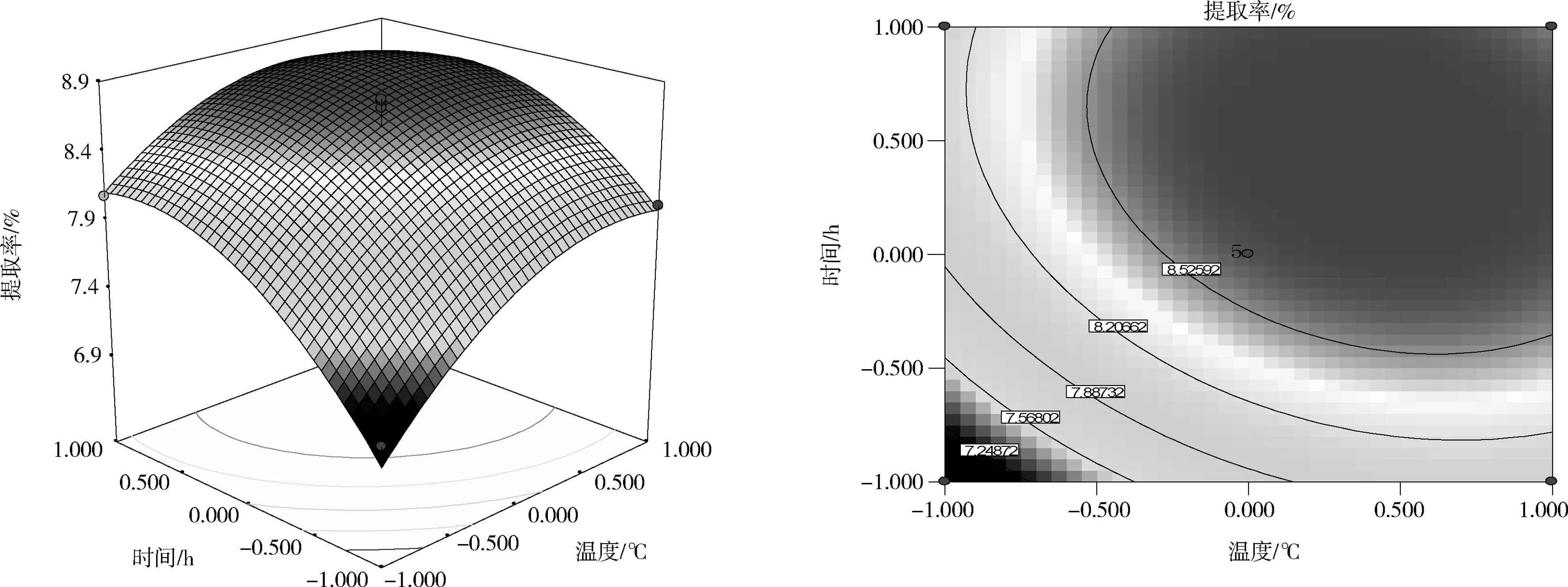
注:P值是方差齐性检查的结果; ** 表示极显著水平(P<0.01); * 表示显著水平(0.01 由回归模型方差分析可知,该回归模型P值<0.000 1,极显著,表明该模型能够正确预测杏鲍菇下脚料多糖提取率与各考察因素之间的关系。该模型的失拟项P(0.291 7)>0.05,不显著,表明无其他因素显著影响该实验,该回归模型与实际实验拟合较好,试验误差小。相关系数R2=0.973 8,表明采用响应面法设计所得的回归模型有效,适用于杏鲍菇下脚料多糖提取实验的理论预测。 2.2.2 响应面分析 响应曲面及等高线图能够直观地反映各个因素及其交互作用,利用Design Expert软件即可以作出2因素交互作用的响应曲面图及其等高线图,结果见图4。 (a)液料比(X1)和温度(X2) (b)液料比(X1)和时间(X3) (c)温度(X2)和时间(X1) 从图4可以看出,在所选的范围内存在极值,既是响应面的最高点,同时也是等高线最小椭圆的中心点。图4(a)显示了提取温度和液料比对多糖提取率的交互效应,由图4(a)可知,等高线沿作用温度轴变化较液料比轴向变化相对密集,曲面较陡,说明温度对杏鲍菇下脚料多糖提取率的影响较显著。图4(b)显示了提取时间和液料比对多糖提取率的交互效应,由图4(b)可知,等高线沿液料比轴向变化相对稀疏,而沿提取时间轴向变化更密集,说明时间较液料比对响应值的影响更大。图4(c)显示了提取温度和时间对多糖提取率的交互效应,从其等高线图可以看出该2个因素的交互作用不大,在编码值为0以上的提取温度在提取时间一定范围内都能够得到较大的响应值。 2.2.3 最优化工艺条件的确定 对二次回归方程分析,可得最优化的杏鲍菇下脚料多糖提取条件为:液料比26.2 mL/g,温度87.4 ℃,时间3.245 h。在该条件下由响应面模型预测理论提取率为Y=8.87%。为检验响应面优化法的可靠性,考虑实验室试验条件,采用液料比26 mL/g、温度87 ℃、时间3.2 h的修正条件进行平行试验,结果得出杏鲍菇下脚料多糖的实际提取率为8.76 %,与模型理论预测值基本吻合,说明,该响应面回归模型具有可行性。 在单因素试验的考察基础上,采用Box-Behnken响应面法建立影响因素的二次回归模型,对数据进行分析,得到杏鲍菇下脚料多糖的提取最佳工艺参数为液料比26 mL/g、提取温度87 ℃、提取时间3.2 h,多糖的提取率为8.76 %。 [1]毛栋. 杏鲍菇多糖提取条件优化及其抗氧化、降血脂功能研究[D]. 南京: 南京师范大学, 2010. [2]Xiaonan L, Bo Z, Rongshanl L, et al. Extraction and Antioxidant Activities of Intracellular Polysaccharide fromPleurotussp. Mycelium [J]. International Journal of Biological Macromolecules, 2010, 47(2): 116-119. [3]迟桂荣, 徐琳, 吴继卫. 杏鲍菇多糖的抗病毒、抗肿瘤研究[J]. 莱阳农学院学报:自然科学版, 2006, 23(3): 174-176. [4]张俊会, 王谦. 杏鲍菇多糖的抗氧化活性研究[J]. 中国食用菌, 2003, 22(2): 38-39. [5]刘晓楠. 三种侧耳多糖的提取及其抗氧化活性分析[D]. 泰安:山东农业大学, 2011. [6]杨梅, 王丽雅, 庄跃飞, 等. 杏鲍菇多糖的提取及其分离的研究[J]. 中国食用菌, 2005, 24(4): 38-39. [7]高娟娟, 梁安慧, 阳敏, 等. 超声波对杏鲍菇多糖提取率影响试验[J]. 食用菌, 2005, 27(6): 49. [8]范文秀, 王振河. 杏鲍菇多糖的提取及含量测定[J]. 广东微量元素科学, 2006, 13(7): 53-55. [9]孟思, 刘晓宇, 李信辉, 等. 杏鲍菇水溶性多糖提取工艺研究[J]. 食品科学, 2007, 28(9): 141-144. [10]杜敏华, 田龙. 杏鲍菇碱溶性多糖的酶法提取及其结构的初步分析[J]. 食品工业科技, 2007, 6(28): 113-116. [11]杜敏华, 田龙. 微波辅助法提取杏鲍菇多糖研究[J]. 食品科技, 2007, 32(3): 117-119. [12]钱珍, 孙灵慧, 刘晓宇, 等. 响应曲面法优化杏鲍菇多糖的提取工艺研究[J]. 食品科技, 2009, 34(11): 204-207. [13]侯军, 林晓民, 李瑛, 等. 响应面法优化杏鲍菇菌糠多糖提取工艺[J]. 食品科学, 2010, 31(24): 155-158.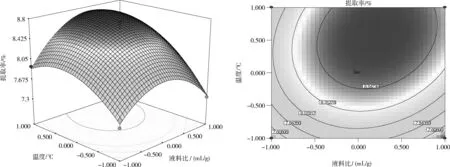
3 结论
