骨关节炎患者血清和关节液瘦素的检测及意义
2014-09-04吴盛荣罗楚天王瑾黄庆东
吴盛荣 罗楚天 王瑾 黄庆东
骨关节炎患者血清和关节液瘦素的检测及意义
吴盛荣 罗楚天 王瑾 黄庆东
目的 探讨骨关节炎患者血清和关节液瘦素浓度水平变化与关节软骨损伤程度之间的关系。方法 50例骨关节炎患者(研究组)采用酶联免疫吸附方法(ELISA)对血清和关节液进行瘦素的含量测定, 采用Outerbridge评分法作软骨病理病变评估, 并与40例非骨关节炎患者(对照组)做比较。结果 研究组血清和关节液瘦素浓度明显高于对照组(P<0.01);研究组血清和关节液瘦素浓度水平与软骨损伤评分(Outerbridge评分)呈正相关(r分别为0.513, 0.682)。结论 骨关节炎患者血清和关节液瘦素浓度明显升高, 瘦素浓度越高, 软骨损伤程度越重 。
骨关节炎;瘦素;关节软骨
骨关节炎(osteoarthritis,OA)是最常发生于人体外周动力关节和中轴关节的退行性疾病, 涉及的组织包括软骨、软骨下骨以及滑膜, 主要病理特点为关节软骨破坏变性增生、骨赘形成、滑膜炎、滑膜增生、关节腔变窄, 好发于老年人,多发于膝关节。瘦素(leptin) 属于肥胖基因编码,源于脂肪细胞合成并分泌的细胞因子类激素, 属于炎症介质网络中的一种细胞因子。近年来, 瘦素在关节炎症形成及退变性病变过程中作用日益受到重视。本研究通过检测骨关节炎患者血清和膝关节液瘦素浓度, 结合关节镜下软骨病变程度, 来分析血清和关节液瘦素浓度水平与关节软骨损伤程度之间的关系。
1 资料与方法
1.1 一般资料 本组患者2010年7月~2013年12月在本院住院部行关节镜手术的诊断为骨关节炎患者50例, 定为研究组, 其中男13例, 女37例, 年龄49~79岁, 平均年龄57.3岁;对照组为行关节镜手术其他膝关节疾病(非骨关节炎患者)40例, 其中男10例, 女30例, 年龄51~80岁, 平均年龄59.1岁。两组一般资料比较, 差异无统计学意义(P>0.05),具有可比性。
1.2 标本的采集及瘦素的检测 血清标本收集:关节镜手术前禁止饮食8 h, 清晨空腹抽静脉血3 ml, 3000 r/min离心20 min, 留取血清分装EP管。关节液标本收集:关节镜手术麻醉后, 取髌下外侧入路行膝关节腔穿刺, 抽取关节液3 ml, 3000 r/min离心20 min, 留取上清液分装EP管。采用ELISA对血清和关节液进行瘦素的含量测定(试剂盒由美国RD公司提供)。
1.3 关节镜下软骨病理病变评估 采用Outerbridge评分法[1],对髌骨面、股骨内侧髁、股骨髌面、股骨外侧髁、胫骨外侧髁、胫骨内侧髁6区域评分, 每个区域为0~4分, 将各区域评分相加。0分:正常;1分:关节表面肿胀、软化, 大小不计;2分:有裂隙或破裂形成<1.5 cm2;3分:有裂隙或破裂形成>1.5 cm2;4分:软骨下骨暴露, 大小不计。
1.4 统计学方法 用SPSS18.0统计学软件处理数据。计量资料以均数±标准差( x-±s)形式表示, 实施t检验;计数资料以率(%)形式表示, 实施χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 研究组与对照组血清与关节液瘦素比较 研究组明显高于对照组(P<0.01)。见表1。
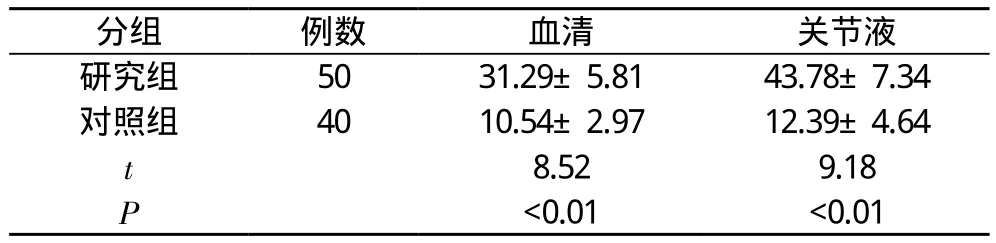
表1 研究组与对照组血清和关节液瘦素浓度比较( x-±s, ng/ml)
2.2 研究组血清和关节液瘦素浓度与软骨Outerbridge评分的关系 研究组血清和关节液瘦等浓度水平与软骨损伤Outerbridge评分呈正相关。见表2。
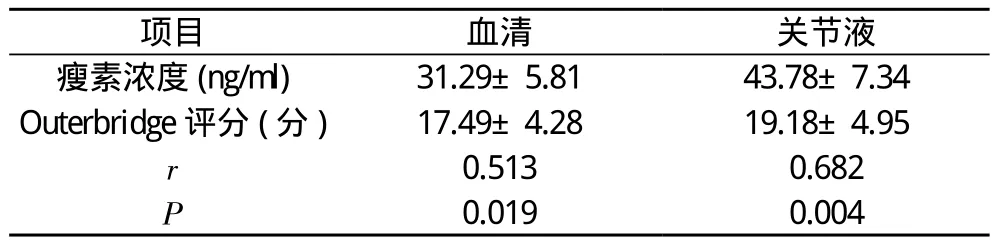
表2 骨关节炎血清和关节液瘦素浓度与软骨Outerbridge评分的关系( x-±s)
3 讨论
瘦素是由脂肪组织分泌的一种蛋白类激素, 体内分布广泛, 参与机体能量代谢,关节软骨中有较多瘦素及瘦素受体表达, 近期研究证实它属于细胞炎症网络中的一分子[2]。
从本研究资料可以看出, 研究组血清和关节液瘦素浓度明显高于对照组, 表明在骨关节炎状态下血清和关节液瘦素均有高表达。本研究还表明研究组血清和关节液瘦素浓度水平与软骨损伤评分(Outerbridge评分)呈正相关, 即瘦素浓度水平越高, 关节软骨损伤程度越重, 与相关研究一致[3]。炎症因子在骨关节炎发病机制中起至关重要的作用, 研究表明瘦素可以诱导合成一氧化氮合酶, 大量产生一氧化氮, 继而诱导产生炎症因子前列腺素-2、白介素-1、白介素-6、白介素-8[4], 此外瘦素还可以促使机体产生基质金属蛋白酶-3及基质金属蛋白酶-13从而诱发骨性关节炎, 目前已知基质金属蛋白酶系列是导致骨性关节炎的重要炎性介质[5]。有学者认为瘦素可能通过诱导产生一氧化氮合成酶及一氧化氮,再激发各种炎症因子发挥作用, 其中JAK-STAT信号转导途径是主要途径, 干扰素-2C有协调效应[6]。学者发现正常人群中瘦素受体处于低表达, 而骨关节炎患者关节软骨细胞含大量瘦素mRNA受体, 并且mRNA受体表达随受损程度加重而增多[7]。另外学者还发现瘦素可刺激关节内转化生长因子-β、胰岛素样生长因子-β生成, 这两个因子为软骨生长因子, 诱发蛋白多糖合成增多, 由此促进关节软骨细胞增殖合成[3], 瘦素还可诱导胶原合成、成骨细胞增殖、骨矿化,或释放抗成骨因子,从而调节骨的生长[8]。
综上所述, 瘦素在骨关节炎的血液和关节液中呈现高表达, 且能够反映软骨损伤的程度, 然而瘦素的具体生物调控机制如何, 在骨关节炎发病机制中所起到的何种作用, 能否作为一种快速的反映病情的生物标志物, 仍有待学者们做进一步研究。
[1] Outerbridge RE.The etiology of chondromalacia patellae.J Bone Joint Surg, 1961(43):752-757.
[2] Ku JH, Lee CK, Joo BS, et al.Correlation of synovial fluid leptin concentrations with the severity of osteoarthritis.Clin Rheumatol, 2009, 28(12):1431-1435.
[3] Dumond H, Presle N, Terlain B, et al.Evidence fora key role of leptin in osteoarthfitis.ArthrisRheum, 2003, 48(11):3118.
[4] Zhan GF, Basinski MB, Beats JM, et al.Crystal structure of the obese Protein leptin-E100.Nature, 1997(387):206-209.
[5] Koskinen A, Vuolteenaho K, Nieminen R, et al.Leptin enhances MMP-1,MMP-3 and MMP-13 production in human osteoarthritic cartilage and correlates with MMP-1 and MMP-3 in synovial fluid from OA patients.Clin Exp Rheumatol, 2011, 29(1):57-64.
[6] Otero M, Gomez Reino JJ, Gualillo O.Synergistic induction ofnitric oxide synthase type.In vitro effect of leptin and interfere on-in human chondrocytes and ATDC5 chondrogenic cells.Arthritis Rheumatism, 2003(48):404.
[7] Simopoulou T, Malizos KN, Iliopoulos D, et al.Differential expression of leptin and leptin's receptor isoform (Ob-Rb)mRNA between advanced and minimally affected osteoarthritic cartilage; effect on cartilage metabolism.Osteoarthritis Cartilage, 2007(15): 872-883.
[8] Gordeladze JO, Drevon CA, Syversen U, et al.Leptin stimulateshuman Osteoblastic cell proliferation, de novo collagen synthesis, and mineraliazation: impact on differentiation markers, apoptosis, and osteoclasticsignaling.JCellBiochem, 2002, 85(4):825.
2014-05-23]
515144 广东省汕头市潮南民生医院骨科(吴盛荣黄庆东);汕头市潮南区两英中心卫生院(罗楚天);汕头市潮南区陇田中心卫生院(王瑾)
吴盛荣
