Mn(II)与L-谷氨酸二元体系循环伏安特性影响因素的研究*
2014-09-03董稼的
董稼的
(甘肃工业职业技术学院 化工学院,甘肃 天水 74025)
Mn(II)与L-谷氨酸二元体系循环伏安特性影响因素的研究*
董稼的
(甘肃工业职业技术学院 化工学院,甘肃 天水 74025)
通过对金属离子Mn(Ⅱ)与L-谷氨酸(Glu)二元体系形成配合物的循环伏安行为的研究,探讨摩尔配比、pH值、扫描速率、支持电解质、电极各种因素对峰电流的影响,试图运用循环伏安法探究配合物扫描的最佳条件.实验结果表明:当Mn(Ⅱ)与Glu的摩尔配比为1:2、pH=3.33、扫描速率v=26 mV/s、KNO3为支持电解质,铂电极上Mn(Ⅱ)与Glu配合物电极反应的峰电流之比(Ipa/Ipc)最大,此为最佳实验条件.
Mn(Ⅱ);L-谷氨酸;配合物;循环伏安法
循环伏安法(CV)作为一种重要的电化学分析方法,被广泛的应用于电化学、无机化学、生物化学等的研究领域中.锰是人体必要的微量矿物质元素,是构成正常骨骼时所必要的物质,并有着多方面的作用.关于Mn(Ⅱ)的研究较多,但它与配体的循环伏安行为的研究较少.本文利用循环伏安法对Mn(Ⅱ)与L-谷氨酸二元体系循环伏安特性的影响因素进行探讨.
1 实验部分
1.1 仪器及试剂
LK98BII型微机电化学分析系统(天津市兰力科化学电子高技术有限公司);213型铂片电极(姜堰市江扬电子仪器厂);铂盘电极(0360-Φ2);金盘电极(3013-Φ4);232型饱和甘汞电极(上海雷磁仪器厂).谷氨酸(Glu)为生化试剂,Mn(NO3)2、KCl、KNO3、NaCl、KH2PO4、HCl、KOH均为分析纯试剂,实验用水均为蒸馏水,氮气为高纯氮.
1.2 实验方法
(1)溶液的配制.实验体系都定容为25.00 mL,其中支持电解质的浓度为0.1 mol/L,待测液中Mn(Ⅱ)的浓度为0.001mol/L,调节Glu的浓度使Mn(Ⅱ)与Glu之间的物质的量之比分别为1:1、1:2、1:3、1:5、1:7、1:9再用蒸馏水定容,摇匀,待测.用KOH与HCl调节溶液的pH值.
(2)电极系统及其处理.电极系统:铂盘电极为工作电极,铂片电极为对电极,饱和甘汞电极为参比电极.电化学测量工作电极表面在每次测试前在浓HNO3中浸泡30min,然后再用蒸馏水超声波清洗,最后将铂片电极和铂盘电极在0.3mol/L的硝酸溶液中进行电化学处理,取出后再用蒸馏水冲洗干净,用滤纸将其表面吸干,待用.
(3)含金属离子溶液的循环伏安法测定条件.溶液测定前均用高纯氮气除氧10min,循环伏安测定电位选在-0.2~1.0V.整个实验过程均在室温下进行,本文所有电位值均相对于参比电极而言,仪器的灵敏度为10μA,滤波参数为50Hz,放大倍率为1,电流极性还原为正.
2 结果与讨论
2.1 Mn(II)的循环伏安曲线
图1中的曲线出现的氧化峰和还原峰均为单峰.电极反应在Mn(Ⅲ)/Mn(Ⅱ)之间进行,且该电极反应为简单的单电子过程,其电极反应为: .

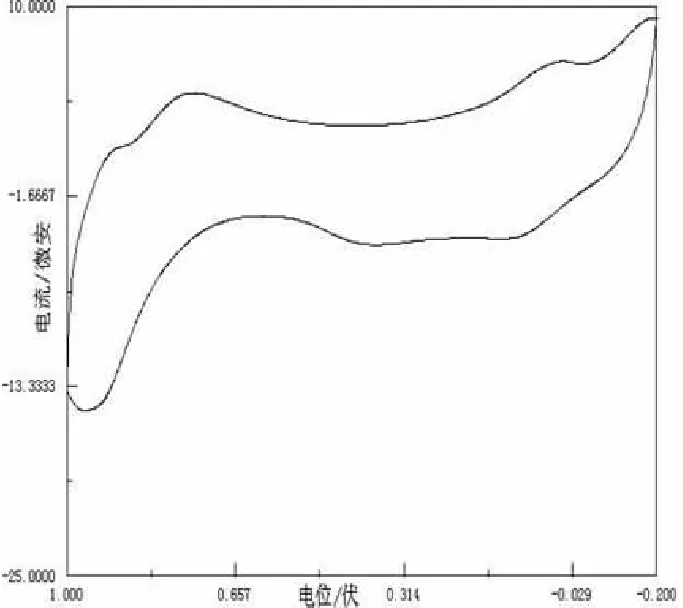
图1 Mn(II)与KNO3循环伏安图
2.2Mn(II)与配体Glu在不同摩尔配比条件下的循环伏安曲线
在不同的配比中,循环伏安法的扫描曲线有所区别.所配溶液Mn(Ⅱ)与L-谷氨酸的物质的量之比分别为1:1、1:2、1:3、1:5、1:7、1:9,由图2可以看出,Mn(Ⅱ)与Glu的摩尔配比为1:2的溶液的峰电流最大且Ipa/Ipc最接近1.因此,在以后的实验中所配制的溶液的摩尔配比均为1:2.随着Mn2+与L-谷氨酸摩尔配比的增加,还原峰和氧化峰的峰电流均减小了.故选择溶液的摩尔配比为1:2.
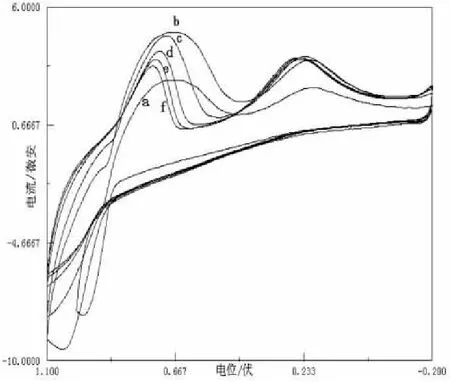
图2 Mn(II)与Glu不同摩尔配比的循环伏安图
随着n(Mn2+) :n(Glu)的值越来越小,体系的电化学活性越来越小,如图2所示,a、b、c、d、e、f分别为同一条件下n(Mn2+):n(Glu)=1:1、1:2、1:3、1:5、1:7、1:9的循环伏安图,明显可以看到还原峰、氧化峰逐渐减弱,这是因为体系中游离的Mn2+的浓度逐渐减小,使体系的电化学活性越来越小.由于非活性物质占据电极表面,阻碍电子的传递,减少了电极有效表面积,那么随着扫描圈数的增加,非电活性物质占据的电极表面积增加,电极的有效表面积减小,故峰电流降低直至不变.在Epc=0.24V处有一还原峰,且此峰的位置基本没变化,与Glu和KNO3扫描时出现的峰的位置相差不大.此峰形成的原因前面已经讨论过了,这里就不再赘述了.由于氧化峰比还原峰灵敏,在同一条件下,Mn(Ⅲ)与Glu形成的二元体系比Mn(Ⅱ)与它形成的二元体系稳定,且Mn(Ⅲ)的静电引力比Mn(Ⅱ)的大,说明Mn(Ⅲ)配位能力强于Mn(Ⅱ).
2.3Mn(II)与配体Glu不同扫描速率条件下的循环伏安曲线
图3是在相同参数设置下,不同扫描速率的Mn2+与Glu的CV叠加图,随着扫描速率的增大,Ipa和Ipc的值越来越大,峰电位Epa随着扫速的增大而朝正电位方向移动.在5.0~40mV/s之间,以不同的扫描速率进行扫描表明:峰电流与扫描速率v1/2成正比,而扫描速率对峰电位的影响不大.扫描速率度在1~30mV/s范围内Mn(III)/Mn(II) 电对的氧化还原反应是准可逆的.扫描速率较快时,氧化峰的峰电位正移,峰顶变宽、峰形变样,不适宜选择扫率,而且△Ep值变大,Ipa/Ipc值变小;扫描速率较慢时,还原峰和氧化峰的峰电位均发生负移,当扫描速率低于10mV/s时,峰形变得很低而且还不灵敏.在扫描速率v=26mV/s时,峰电流之比最大,即Ipa/Ipc最大,所以选择扫描速率为26mV/s.

图3 Mn(II)与Glu不同速率的循环伏安图
2.4Mn(II)与配体Glu不同pH条件下的循环伏安曲线
固定Mn(Ⅱ)与Glu的摩尔配比为1:2;扫描速率为26mV/s,KNO3为支持电解质,用HCl、KOH溶液调节体系的pH,考察不同pH值对伏安行为的影响.实验表明,在pH=3.33时,峰电流之比最大.图4中pH很小时,峰电流Ipa较小但随着pH的增加,峰电流也在逐渐增大,在pH=3.33时峰电流达到最大.pH=4.00时,体系中的Mn2+发生了氧化,溶液的颜色发生了变化并有固体生成.随着pH的变大,溶液中的Mn2+越来越不稳定,更容易被氧化.从图4中可看出pH=5.00时,Mn2+已被氧化为Mn3+,图中已没有了还原峰.而Mn3+在空气中稳定,在弱酸性或中性环境中锰主要以三价存在,这与实验结果相符合.
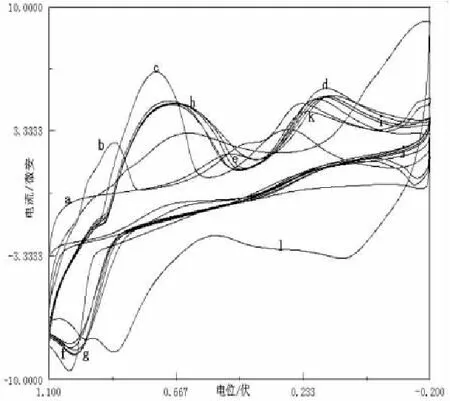
图4 Mn(II)与Glu不同pH值的循环伏安图
a.pH=1.50;b.pH=2.00;c.pH=3.00;d.pH=3.31;e.pH=3.32;f.pH=3.33;g.pH=3.35;h.pH=3.41;i.pH=3.50;j.pH=3.61;k.pH=4.00;l.pH=5.00
2.5Mn(II)与配体Glu在不同支持电解质条件下的循环伏安曲线
分别以浓度为0.1mol/L的KCl、KNO3、KH2PO4、NaCl溶液为支持电解质进行实验,考察不同电解质对电极的循环伏安行为的影响.实验结果表明:在不同的支持电解质中,循环伏安曲线是不相同的.从图5中可以看出,在KH2PO4为支持电解质的体系中,氧化峰和还原峰的峰电流都很小,这说明H2PO4与Mn2+发生了配位反应.而在KCl、NaCl、KNO3为支持电解质的体系中,氧化峰和和还原峰的峰电流都相差不大,NaCl与KCl的几乎相同.其中,KNO3作为支持电解质时的峰电流的比值最大,而且峰形也很理想,所以选择KNO3作为体系的支持电解质.

图5 不同电解质的循环伏安图
2.6Mn(II)与Glu在不同电极条件下的循环伏安行为
从图6可知,曲线a中的还原峰的峰形特别理想,但氧化峰很不理想.在曲线b中还原、氧化峰都比a的要小的多,但两峰的峰形都很匀称,比较理想.在实验中,由于实验条件所限,金电极和铂电极的盘半径不相同,金电极的盘半径(r=2)大于铂电极的(r=1).因为电极的盘半径不同,产生的电流密度不同,所扫描的曲线就不相同.根据Randles-Savcik方程:ip=2.69×105n3/2AD1/2v1/2c.峰电流与盘半径的平方成正比.因此,盘的半径越大,扫描出的峰形越大,故金电极的扫描曲线较铂电极的大.由于Mn(Ⅲ)/Mn(Ⅱ)电对的氧化还原反应是准可逆的,根据Ipa/Ipc计算知,铂电极的比值较金电极的接近于1,且铂电极扫描的氧化峰和还原峰比金电极扫描的较理想些,故选择铂电极为实验电极.

图6 不同电极对Mn(II)与GLu循环伏安曲线的影响
3 结论
通过Mn(Ⅱ)与Glu形成的二元体系配合物的CV图比较,结果表明:在固定其它条件不变的情况下,改变Mn(II)与Glu的配比,测得在n(Glu):n(Mn2+)=2:1时,氧化、还原峰最灵敏.固定配比和其它条件,改变扫描速度,当扫速v=26mV/s时,峰最理想.通过改变pH值,测得pH=3.33时Ipa/Ipc值最大.选用不同的电解质进行CV扫描,KNO3作为支持电解质的效果最佳.用不同材质的电极进行实验,结果铂电极的效果要好于金电极的.因此,Mn(Ⅱ)与Glu形成的二元体系配合物进行CV扫描时,选用铂电极、以KNO3溶液作为支持电解质、扫速v= 26mV/s、pH=3.33时,Ipa/Ipc≈1此为实验最佳条件,实验效果最好.
[1]杨辉,卢文庆.应用电化学[M].北京:科学出版社,2001.
[2]宋化灿,宋继国,杨绮琴,等.香豆素衍生物对Cd(Ⅱ)配位作用的电化学研究[J].中山大学学报,2002,41(5):54-56.
[3]李红,巢晖,将雄,等.四种钌(Ⅱ)配合物的中心离子电化学行为的比较[J].物理化学学报,2001,17(8):728-732.
[4]杨声,冯小强,蒋罗明.Cu(Ⅱ)在巯基化壳聚糖修饰金电极的循环伏安行为(I)[J].天水师范学院学报,2005,25(2):39-41.
[5]师同顺,柳巍.四-(1-萘基)四苯并卟啉锰的合成和循环伏安特性研究[J].化学研究与应用,1998,10(6):578-582.
[6]杨培慧,周志军,冯德雄,等.玻碳电极吸附循环伏安法测定维生素B2[J].暨南大学学报,2001,22(5):93-97.
[7]陆光汉.分析化学[J].北京:高等教育出版社,2000.
[8]王伯康.综合化学实验[M].南京:南京大学出版社,2002.
[9]叶芝祥,蔡铎昌,吴四维.循环伏安法对色氨酸电化学氧化机理的研究[J].四川师范学院学报,1999,20(4):335-338.
(责任编辑:陈衍峰)
2013-09-10
董稼的(1983-),男,甘肃天水人,讲师.
甘肃工业职业技术学院校级科研基金资助项目(Gzy2012-21).
O657
A
1008-7974(2014)01-0035-03
