爱博霉素B的全合成研究进展
2014-09-02吕宜春崔庆华
吕宜春, 崔庆华
(1.山东化工职业学院 化学工程系,山东 淄博 255400; 2. 滨州市环境保护科学技术研究所,山东 滨州 256606)
爱博霉素B的全合成研究进展
吕宜春1*, 崔庆华2
(1.山东化工职业学院 化学工程系,山东 淄博 255400; 2. 滨州市环境保护科学技术研究所,山东 滨州 256606)
爱博霉素B是16元环的大环内酯类化合物,以其独特的抗癌性能和复杂新颖的化学结构而受到越来越多的化学工作者的关注,从发现至今已有许多研究小组报道了相关的全合成研究成果. 本文作者综述了其合成研究进展,分析了各合成路线的关键步骤,讨论了某些路线的优缺点,并对该药的研究前景进行了展望.
爱博霉素B;抗癌;全合成;研究进展
爱博霉素是一类16元环的大环内酯化合物,1993年由德国生物技术公司(GBF)研究中心的科学家HÖFLE从纤维堆囊菌的培养液中分离得到,后来发现这些化合物能够杀死肿瘤细胞,其作用机理与紫杉醇的机理相似,能够促进微管蛋白的聚合,形成稳定的细胞微管,抑制癌细胞的分裂,从而导致癌细胞死亡[1]. 通过对这类化合物的微管稳定作用效能与紫衫醇较为全面的离体试验比较后发现:爱博霉素是一类具有促微管蛋白聚合特性、结构新颖的抗肿瘤化合物[2]. 与紫杉醇相比,爱博霉素水溶性更好,便于配制和使用;结构相对简单,容易通过全合成得到,因此爱博霉素作为极具潜力的抗癌新药,引起了全世界化学家、生物学家及药学家的极大兴趣[3],从发现至今的二十多年时间里,有关爱博霉素的研究报告近千篇[4-5]. 山东大学、中科院上海有机所、山东轻工业学院等研究机构在爱博霉素菌种筛选等方面都展开了相关研究,但是由于发酵用的菌株不易得到,发酵法生产周期长、效率低. 爱博霉素的结构相对简单,化学方法有可能成为爱博霉素生产的方法之一,因此对爱博霉素进行全合成就成了有机化学家特别关心的课题,新的全合成路线也层出不穷. 天然的爱博霉素B(见图1)由于发现早,活性研究更彻底,进入临床时间早等原因,更是吸引了化学家对其全合成的兴趣. 本文作者对爱博霉素B的一些主要全合成路线及方法进行了综述.
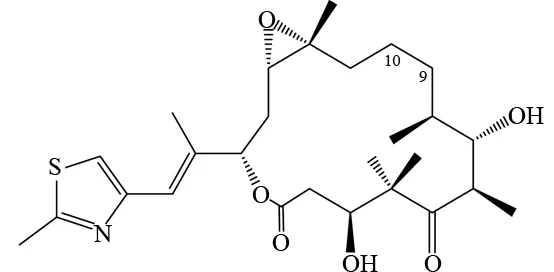
图1 爱博霉素B的结构Fig.1 The structure of Epothilone B
1 爱博霉素B的全合成
截止到目前,至少有六个小组完成了爱博霉素B的合成. 1997年,DANISHEFSKY继1996年完成了爱博霉素A的全合成后又首次完成了爱博霉素B的全合成[4]. 紧接着NICOLAOU也完成了爱博霉素B的全合成研究. 在此之后越来越多的科学家实现了对爱博霉素B的全合成.
1.1 DANISHEFSKY等对爱博霉素B的全合成
1997年,DANISHEFSKY等首次报道了爱博霉素B的全合成路线(见图2)[4].

图2 DANISHEFSKY等对爱博霉素B的全合成Fig.2 DANISHEFSKY's total synthesis of Epothilone B
他们在形成大环时采用了Aldol缩合反应,两个手性片段5和7通过硼烷基化物的Suzuki反应,立体选择性得到一个顺式烯烃缩醛化合物,然后催化水解得到醛9,醛与乙酰基进行分子内的Aldol缩合反应得到大环化合物,这是一个立体选择性很高的反应,直接得到所需的S-构型的醇;然后脱C-5位保护基,再选择性的保护C-3位羟基,氧化C-5位羟基到酮;最后脱去所有保护基后,再经过几步保护-脱保护反应得到爱博霉素B. 该合成路线能够较容易的引入乙酸酯基,这是该路线的优势,但同时这个乙酸酯基在碱性条件下很容易被水解断裂,使产率降低,这是该合成路线的不足之处. 该合成虽然过程比较复杂,实际生产受到限制,但仍然为爱博霉素B的全合成指出了方向. 同年,该课题组在借鉴了NICOLAOU用烯烃复分解方法[6]成功合成爱博霉素A的经验后,又成功地用烯烃复分解方法合成了爱博霉素B[7]. 但由于与爱博霉素A相比,爱博霉素B的环上双键有一个甲基,烯烃复分解时位阻相对较大,所以使用的催化剂必须有很强的Schrock活性. 复分解法的合成路线如图3所示:
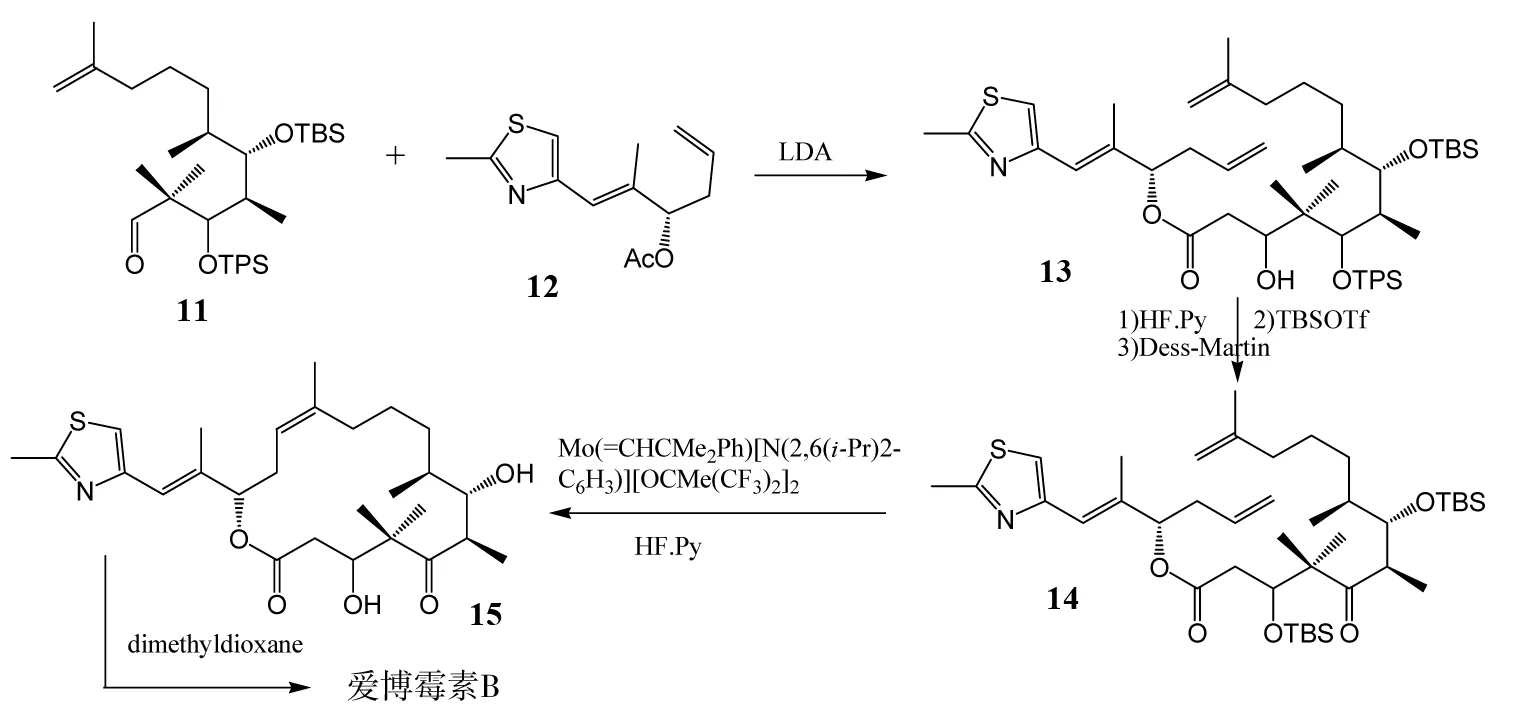
图3 DANISHEFSKY等对爱博霉素B的全合成Fig.3 DANISHEFSKY’s total synthesis of Epothilone B
1.2 SINHA等对爱博霉素B的全合成
SINHA小组[8]在DANISHEFSHKY小组提出的合成方法基础上,对合成路线进行了改进(图4),在C9-C10位置用烯烃复分解反应形成双键,然后氢化还原得到爱博霉素B,有效地避免了C12,C13位烯烃复分解反应形成双键时得到的几乎等量顺反异构体.
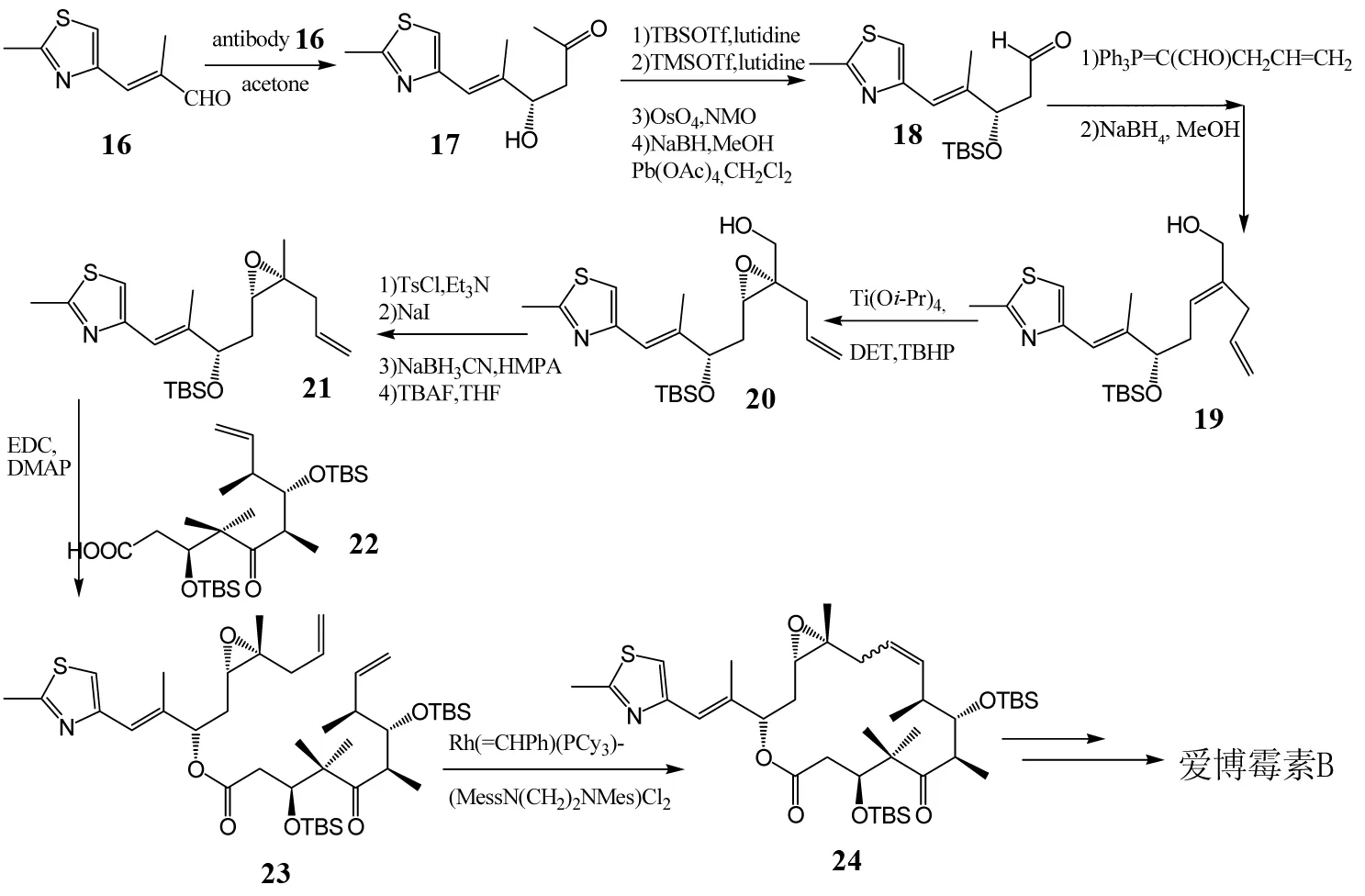
图4 SINHA等对爱博霉素B的全合成Fig.4 SINHA’s total synthesis of Epothilone B
1.3 NICOLAOU等对埃博霉素B的全合成
1997年,NICOLAOU小组也报道了爱博霉素B的全合成,并在后期对合成路线进行了改进[9-10]. 由于爱博霉素B是一个大环内酯类化合物,因此NICOLAOU小组采用了直接合成内酯的方法,化合物25和化合物26在低温下直接生成内酯,然后经过多步保护、去保护、缩环最后生成目标化合物(图5). 这种直接由两个小的片段生成内酯的方法目标性强,选择性高,本是一个很好的方法,但是在醛酮缩合这一步选择性低,只有1.3∶1,导致最终产率降低,无法高效生产目标化合物.
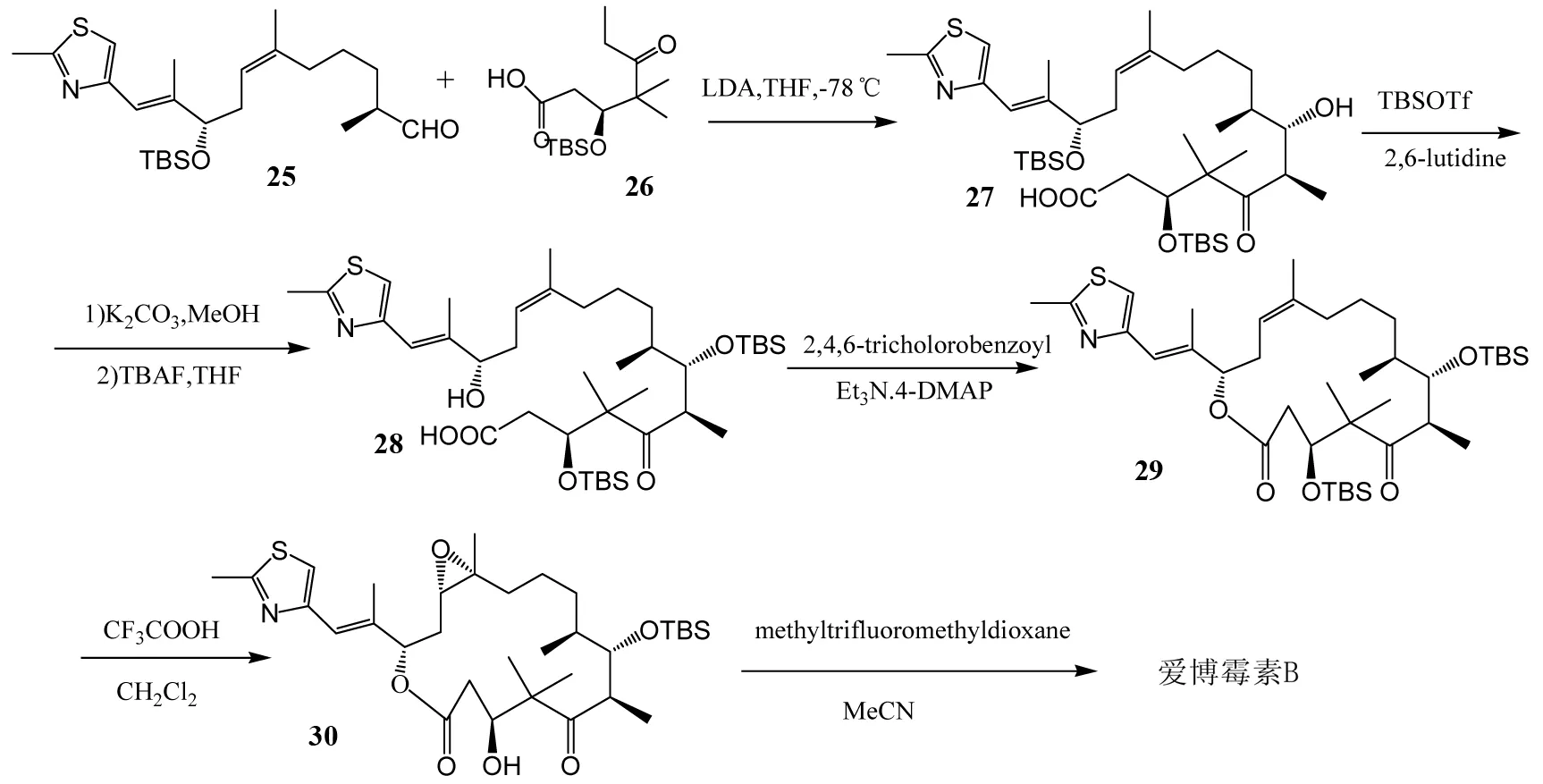
图5 NICOLAOU等对爱博霉素B的全合成Fig.5 NICOLAOU’s total synthesis of Epothilone B
1.4 GRIECO等对爱博霉素B的全合成
1998年,GRIECO等人[11]以烯丙基醇[12]为原料,经过Sharpless环氧化[13]、Swern氧化、霍纳尔—沃兹沃斯—埃蒙斯等反应生成化合物37,接着与已知化合物醋酸盐38发生加成反应,最后经过和DANISHEFSKY合成法最后六步相同的反应生成目标化合物(图6). 该路线立体选择性地合成了爱博霉素B.
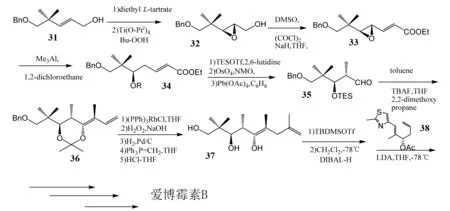
图6 GRIECO等对爱博霉素B的全合成Fig.6 GRIECO’s total synthesis of Epothilone B
1.5 WHITE等对爱博霉素B的全合成
1999年,WHITE课题组[14]首次在闭合大环骨架之前完成C9-C10键的结合. 这种方法首先需要合成两个片段X和Y,片段X以3-碘-2-甲基-2-丙烯醇为起始原料,经羟基保护和低温加成得到化合物41,化合物41又与苯基取代氮氧环丙烷发生反应[15]生成中间体,该中间体再经羟基保护和去保护得到化合物42,化合物42和铜锂试剂反应得到化合物43,化合物43与化合物N[16]发生霍纳-埃蒙斯缩合以较高产率生成双烯烃44,在经过与溴化镁反应、三苯基甲基溴化膦生成片段X. 而片段Y的生成采用了MULZER[17]和MEYER[18]文献中所用的方法. 两个片段通过Witting偶合反应结合在一起,再经过去保护、闭环、去保护等系列反应最后得到爱博霉素B(图7). 这个方法将不易结合的C9-C10提前连在一起,简化了合成路线,提高了产率. 后来该课题组对爱博霉素B的全合成又进行了多次探讨[19-20].
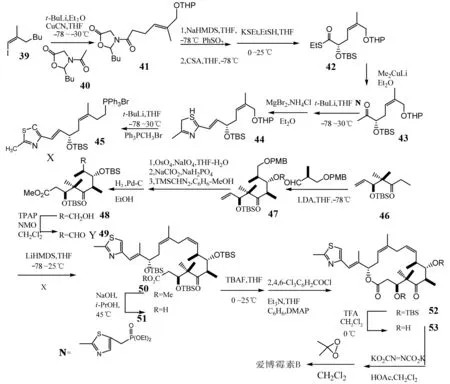
图7 WHITE等对爱博霉素B的全合成Fig.7 WHITE’s total synthesis of Epothilone B
1.6 LIN Guoqiang等对爱博霉素B的全合成
2012年,上海有机所的LIN Guoqiang课题组[21]报道了一种更加简短有效的合成爱博霉素B的方法(图8). 在该合成路线中,中间体化合物59的合成采用了一种不同于以往其他文献报道的全新的方法,以2,2-二甲基-1,3- 环戊二酮54为起始原料,发生不对称催化反应,最终以高达96%的ee值得到想要的手性产物. 由起始原料到中间体化合物59共经过五步反应,这五步总产率高达30%. 而另一关键中间体63的合成是以化合物60为起始原料,经四步反应完成,产率33%,这是目前这一中间体合成的最经济有效的方法. 两个重要中间体再发生Aldol反应,为了控制立体选择性,引入LDA试剂作为基质,使立体选择性达到1∶1. 以化合物54为起始原料,共经过11步并以高达8%的总收率完成了爱博霉素B的全合成,合成路线简单,高效.
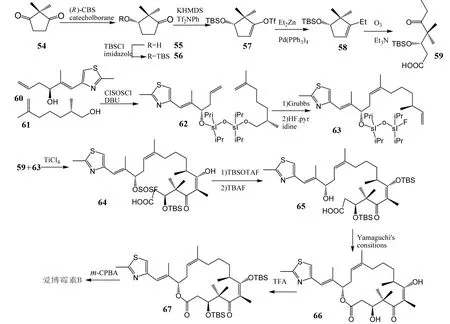
图8 LIN等对爱博霉素B的全合成Fig.8 LIN’s total synthesis of Epothilone B
2 展望
爱博霉素类化合物具有广泛的生物活性,因此激励着化学家及药学家不断地探索. 从1993年分离出爱博霉素至今的二十多年里,越来越多的化学工作者投入到它的全合成研究中. 关于合成路线的设计除了上面讨论的以外,其他几种完全的或不完全的合成路线,以及含有该类骨架的衍生物的合成也逐渐见诸报道[22-23],在此不再一一赘述. 根据这个领域的发展趋势以及对爱博霉素B研究现状的了解,本文作者认为在今后相当长的时间里爱博霉素B的全合成仍将是合成化学研究的热点之一,研究工作将主要集中在设计新的合成路线,以及对现有的合成路线进行优化等方面.
[1] (a)BOLLAG D M, MCQUENEY P A, ZHU Jian, et al. Epothilones, a new class of microtubule-stabilizing agents with a taxol-like mechanism of action [J]. Cancer Res,1995, 55(11): 2325-2333. (b)GERTH K,BEDORF N,HÖFLE G, et al. Epothilons A and B: antifungal and cytotoxic compounds from sorangium cellulosum (Myxobacteria): production, physico-chemical and biological properties [J]. J Antibiot, 1996, 49(6): 560-563. (c) HÖFLE G, BEDORF N, STEINMETZ H, et al. Epothilone A and B—novel 16-membered macrolides with cytotoxic activity: isolation, crystal structure, and conformation in solution [J]. Angew Chem Int Ed Engl, 1996, 35(13/14): 1567-1569. (d) ALESSANDRA P, STEPHANE H, RENU M, et al. Epothilone B inhibits migration of glioblastoma cells by inducing microtubule catastrophes and affecting EB1 accumulation at microtubule plus ends [J]. Biochemical Pharmacology, 2012, 84(4): 432-443.
[2] ROGALSKA A, SZULA E, GAJEK A, et al. Activation of apoptotic pathway in normal, cancer ovarian cells by epothilone B original research article [J]. Environmental Toxicology and Pharmacology, 2013, 36(2): 600-610.
[3] (a)ALTMAILN K H. Epothilone B and its analogs-a new family of anticancer agents [J]. Mini Rev Med Chem, 2003, 3(10): 149-158. (b)ALTALLA R, FOJO T, REED E, et al. Epothilones: a novel class of non-taxane microtubule-stabilizing agents [J]. J Curr Pharm Des, 2002, 8(19): 1707-1712. (c)NICOLAOU K C, RITZEN A, NAMATO K. Recent developments in the chemistry, biology andmedicine of the epothilones [J]. Chem Commun, 2001, 32(44): 1523-1535. (d) MATHUR N D, BURNELL G S, ISAAC P, et al. Large low-field magnetoresistance in La0.7Ca0.3MnO3induced by artificial grain boundaries [J]. Nature, 1997, 387: 266-268. (e)BUEY R M, DIAZ J F, ANDREU J M, et al. Interaction of epothilone analogs with the paclitaxel binding site: relationship between binding affinity,microtubule stabilization, and cytotoxicity [J]. Chem Biol, 2004, 11(2): 225-236. (f)NICOLAOU K C, VOUDOUMIS D, LI Tianhu, et al. Designed epothilones: combinatorial synthesis, tubulin assembly properties, abd cytotoxic action against taxol-resistant tumor cells [J]. Angew Chem Int Ed Engl,1997, 36(19): 2097-2103. (g)NICOLAOU K C, VALLBERG H, KING N P, et al. Total synthesis of oxazole-and cyclopropane-containing epothilone a analogues by the olefin metathesis approach [J]. Chem Eur J, 1997, 3(12): 1957-1970.
[4] NICOLAOU K C, DELFT F V, OHSHIMA T, et al. Total synthesis of eleutherobin [J]. Angew Chem Int Ed Engl, 1997, 36(22): 2520-2524.
[5] (a)ROGALSKA A, GAJEK A, MARCZAK A. Epothilone B induces extrinsic pathway of apoptosis in human SKOV-3 ovarian cancer cells [J]. Toxicology in Vitro, 2014, 28(4) : 675-683. (b) XIAO Chuanfan, LI Ke, HUANG Rong, et al. Investigation of inclusion complex of epothilone A with cyclodextrins [J]. Carbohydrate Polymers, 2014, 102: 297-305.
[6] NICOLAOU K C, WINSSINGER N, PASTOR J, et al. Synthesis of epothilones A and B in solid and solution phase [J]. Nature, 1997, 387: 268-272.
[7] LIVOREIL A, SAUVAGE J P, ARMAROLI N, et al. Electrochemically and photochemically driven ring motions in a disymmetrical copper [2]-catenate [J]. J Am Chem Soc, 1997, 119(50): 12114-12124.
[8] SINHA S C, BARBAS C F, LEMER R A. The antibody catalysis route to the total synthesis of epothilones [J]. Proc Natl Acad Sci USA, 1998, 95(25): 14603-14608.
[9] TSAI Chufa, SHEN Hueiping, TSAI Suchen, et al. A new athecate earthworm of the genus Amynthas Kinberg (Megascolecidae: Oligochaeta) from Taiwan with discussion on phylogeny and biogeography of the A. illotus species-group [J]. J Nat Hist, 2012, 36(7): 757-765.
[10] NICOLAOU K C, NINKOVIC S, SARABIA F, et al. Total syntheses of epothilones A and Bviaa macrolactonization-based strategy [J]. J Am Chem Soc, 1997, 119: 7974-7991.
[11] MAY S A, GRIECO P A. Total synthesis of (-)-epothilone B [J]. Chem Commun, 1998, 15: 1597-1598.
[12] BLANCHETTE M A, MALAMAS M S,NANTZ M H, et al. Synthesis of bryostatins. 1. construction of the C(1)-C(16) fragment [J]. J Org Chem, 2002, 54(12): 2817-2821.
[13] KATSUKI T, SHARPLESS K B. The first practical method for asymmetric epoxidation [J]. J Am Chem Soc, 1980, 102(18): 5974-5976.
[14] WHITE J D, CARTER R G, SUNDERMANN K F. A highly stereoselective synthesis of epothilone B [J]. J Org Chem,1999, 64(3): 684-685.
[15] DAVIS F A, CHALTOPHADHYAY S, TOWSON J C, et al. Chemistry of oxaziridines. 9. Synthesis of 2-sulfonyl-and 2-sulfamyloxaziridines using potassium peroxymonosulfate (oxone) [J]. J Org Chem, 1988, 53: 2087-2089.
[16] SCHINZER D, LIMBERG A, BOHM O M. Studies towards the total synthesis of epothilones: asymmetric synthesis of the key fragments [J]. Chem Eur J, 1996, 2(11): 1477-1482.
[17] MULZER J, MANTOULIDIS A. Synthesis of the C(1)-C(9) segment of the cytotoxic macrolides epothilon A and B [J]. Tetrahedr Lett, 1996, 37(51): 9179-9182.
[18] CLAUS E, PAHL A, JONES P G, et al. Synthesis of the C1-C9 segment of epothilons [J]. Tetrahedr Lett, 1997, 38(8): 1359-1362.
[19] WHITE J D, SUNDERMANN K F, CARTER R G. Improved synthesis of epothilone B employing alkylation of an alkyne for assembly of subunits [J]. Org Lett, 1999, 1: 1431-1434.
[20] WHITE J D, CARTER R G, SUNDERMANN K F, et al. Total synthesis of epothilone B [J]. J Am Chem Soc, 2001, 123: 5407-5410.
[21] WANG Jie, SUN Bingfeng, CUI Kai, et al. An efficient total synthesis of (-)-epothilone B [J]. Org Lett, 2012, 14(24): 6354-6357.
[22] HARRIS C R, KUDUK S D, SAVIN K, et al. Dianion equivalents corresponding to the polypropionate domain of epothilone B [J]. Tetrahedr Lett, 1999, 40(12): 2263-2266.
[23] MULZER J, KARIG G, POJARLIEV P. A novel highly stereoselective total synthesis of epothilone B and of its (12R,13R) acetonide [J]. Tetrahedr Lett, 2000, 41(40): 7635-7638.
[责任编辑:任铁钢]
ProgressintotalsynthesisofEpothiloneB
LV Yichun1*, CUI Qinghua2
(1.DepartmentofChemicalEngineering,ShandongVocationalCollegeofChemicalEngineering,Zibo255400,Shandong,China; 2.InstituteofEnvironmentProtectionScienceandTechnologyofBinzhouCity,Binzhou256606,Shandong,China)
Epothilone B is a macrolide, and it has attracted more and more attention from chemical researchers, due to its unique novel anti-cancer properties and complex chemical structure. Several research teams have reported the total synthesis of Epothilone B. This review focuses on the research progress in the synthesis of Epothilone B. The key steps of various synthetic routes are analyzed, and the advantages and disadvantages of some synthetic routes are briefed. Moreover, suggestions are given about the development trend of Epothilone B.
Epothilone B; anti-cancer; total synthesis; research progress
2014-03-23.
吕宜春(1981-),男,讲师,研究方向为化学分析.*
,E-mail:174434028@qq.com.
TQ 463+.3
A
1008-1011(2014)05-0527-07
10.14002/j.hxya.2014.05.018
